Различные проявления хронической формы ишемической болезни сердца (ИБС), прежде всего стабильная встречаются у 5% лиц старше 40 лет. Среди людей пожилого возраста частота развития хронической формы ИБС возрастает до 10—20% [1—8]. Сведения об отдаленном прогнозе у больных со стабильными проявлениями ИБС немногочисленны, и большинство из них было получено при анализе результатов крупных регистров и популяционных исследований (в первую очередь Фрамингемского), завершенных в 70— 90-х годах прошлого века [9—12]. Было показано, что у мужчин со стабильной стенокардией частота развития нефатального инфаркта миокарда (ИМ) за 2 года наблюдения может достигать 14,3%, а сердечно-сосудистой смерти — 5,5%. У женщин со стенокардией частота развития указанных осложнений была несколько ниже: соответственно 6,2 и 3,8%.
По данным более поздних исследований (HOPE [13], EUROPA [14], CAMELOT [15], PEACE [16], ACTION
[17]), прогноз при хронической форме ИБС представлялся более благоприятным, и суммарная частота развития основных сосудистых осложнений у больных не превышала 1,5—3,0% в год. Следует отметить, что указанные данные были получены в хорошо организованных контролируемых испытаниях, посвященных вторичной профилактике или оценке эффективности инвазивных методов лечения ИБС, и поэтому могут отличаться от реальной клинической практики.
Стратификация риска у больных с хронической формой ИБС представляется крайне важной. Известные стандартные модели — SCORE [18], PROCAM [19], PRIME [20] и Фрамингемская шкала [21], учитывающие только классические факторы (курение, нарушенный липидный состав крови, артериальная гипертония (АГ), сахарный диабет (СД), избыточная масса тела), не могут в полном объеме отражать риск развития сосудистых осложнений у больных ИБС. Необходима дополнительная оценка анамнеза атеротромботических осложнений, тяжести ишемии миокарда, степени нарушения насосной функции левого желудочка, изменений электрокардиограммы. В настоящее время прогностические шкалы разработаны лишь для ранней оценки риска у больных с острым коронарным синдромом (ОКС) [22, 23], а также у больных, подвергаемых чрескожным коронарным вмешательствам (ЧКВ) [24, 25]. Для больных со стабильными формами ИБС подобных моделей оценки сердечно-сосудистого риска, которые бы хорошо зарекомендовали себя в повседневной клинической практике, пока нет.
Цель нашей работы состояла в оценке частоты развития сердечно-сосудистых осложнений (ССО) у больных с хронической формой ИБС на протяжении 5 лет проспективного наблюдения и создания шкалы для оценки долгосрочного риска их развития.
Материал и методы
Для участия в исследовании отбирались пациенты в возрасте старше 35 лет со стабильными проявлениями ИБС. Диагноз ИБС верифицировали данными анамнеза в виде перенесенного эпизода ОКС (более 1 мес назад) или реваскуляризации миокарда, либо с помощью нагрузочных стресс-тестов и коронарографии. Обследование больных включало оценку функционального класса (ФК) стенокардии (согласно классификации Канадского кардиологического общества) и явлений недостаточности кровообращения (согласно классификации Нью-Йоркской кардиологической ассоциации – NYHA). У всех больных регистрировали электрокардиограмму в 12 отведениях и проводили эхокардиографию с оценкой фракции выброса (ФВ) левого желудочка.
Кроме того, проводили обследование для выявления цереброваскулярной болезни (ЦВБ) и атеросклеротического поражения артерий нижних конечностей (АПАНК). Критериями диагноза ЦВБ служили анамнез ишемического инсульта (ИИ) или транзиторной ишемической атаки (ТИА) — более 2 мес назад, реваскуляризация в бассейне сонных артерий, а также наличие каротидного стеноза >50% (в том числе бессимптомного), выявляемого при дуплексном сканировании. Критериями АПАНК были снижение лодыжечно-плечевого индекса (ЛПИ) <0,9 (бессимптомное или с клинической картиной перемежающейся хромоты — ПХ) либо предшествующая реваскуляризация периферических артерий.
Наряду с определением распространенности атеросклеротического процесса предусматривалась оценка классических факторов риска (ФР) развития ССО: нарушений липидного обмена, АГ, курения, СД, а также потенциально значимых социальных факторов (уровень образования, трудоспособность, социальный статус).
Всем больным определяли рост и массу тела с последующим расчетом индекса массы тела — ИМТ
(отношение массы тела в килограммах к величине квадрата роста в метрах). В соответствии с критериями, предложенными ВОЗ [18], нормальными считали ИМТ от 18,5 до 24,9 кг/м2. Повышение ИМТ до 25,0—29,9 кг/м2 расценивали как избыточную массу тела, до 30,0—34,9 кг/м2 — как ожирение I степени, до 35,0—39,9 кг/м2 — как ожирение II степени.
В анализах крови, взятых на этапе включения в исследование, определяли уровни общего холестерина, триглицеридов, глюкозы, гепатоспецифических ферментов, билирубина, а также креатинина с определением скорости клубочковой фильтрации (СКФ), исходя из расчетного показателя клиренса креатинина (формула Кокрофта—Гаулта). В соответствии с критериями Национального общества по заболеваниям почек США [26] снижение клиренса креатинина до 60—
89 мл/мин расценивали как начальную, до 30—59 мл/мин — как умеренную, до 30 мл/мин — как тяжелую почечную недостаточность.
При включении в исследование проводили оценку медикаментозной терапии и в случае необходимос-
ти — ее коррекцию в соответствии с рекомендациями, основанными на современных принципах доказательной медицины. Всем больным в отсутствие противопоказаний был рекомендован прием антиагрегантов (ацетилсалициловая кислота, клопидогрел или их комбинации), β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента (АПФ) и статинов. Кроме того, проводили анализ медицинской документации для выявления сопутствующего эрозивно-язвенного поражения верхних отделов желудочно-кишечного тракта (подтвержденного данными эзофагогастродуоденоскопии) и регистрировали назначение препаратов для защиты желудка, включая ингибиторы протонного
насоса (ИПН).
Противопоказаниями к участию больных в исследовании являлись недавние эпизоды ОКС (менее 1 мес
назад) или ИИ/ТИА (менее 2 мес назад), наличие клинических проявлений тяжелой стенокардии (IV
ФК) либо недостаточности кровообращения (IV ФК по классификации NYHA). Кроме того, не включали
больных с тяжелой сопутствующей патологией, способной оказать самостоятельное влияние на прогноз, в том числе с активным онкологическим процессом, выраженными нарушениями функции органов дыхания (дыхательная недостаточность II—III степени), почек (клиренс креатинина <30 мл/мин) или печени (более чем трехкратное повышение активности трансаминаз или уровня общего билирубина).
Продолжительность наблюдения составила от 3 до 7,5 года (в среднем 5 лет), на протяжении кото-
рых регистрировали следующие фатальные и нефатальные ССО: сердечно-сосудистая смерть, ОКС, ИИ, ТИА, периферический артериальный тромбоз, случаи реваскуляризации пораженного сосудистого бассейна (аортокоронарное шунтирование, ЧКВ, каротидная эндартерэктомия, реваскуляризация артерий нижних конечностей).
Статистический анализ. Статистический анализ данных проводился в системе SAS (Statistical Analysis
System). Для моделирования выживаемости и определения прогностически значимых показателей (клинических, биохимических, генетических) использовали регрессионную модель пропорционального риска (Кокса), реализованную в процедуре SAS PROC PHREG. Была использована макропроцедура, позволяющая тестировать значимость множества непрерывных, категориальных или категоризованных показателей при учете влияния заведомо значимых показателей (таких как возраст), включаемых в модель насильственно. Значимость тестируемых переменных определяли с помощью асимптотического критерия хи-квадрат Вальда. В таблицах и рисунках полученные значения представлены как абс. (%) и M±m.
Результаты
В исследование были включены 503 больных (387 мужчин и 116 женщин), средний возраст которых составил 59,4 года (табл. 1). У 80,5% больных имелся относительно невысокий уровень образования. Каждый пятый пациент трудоспособного возраста не имел постоянной работы по причине стойкой утраты трудоспособности или отсутствия обеспечения занятости со стороны социальных институтов.
Контингент больных оказался достаточно тяжелым. Была выявлена высокая распространенность ФР развития ССО, включая АГ (84,9%), курение (36,4%), СД (18,5%) и ожирение (33,2%). Относительно невысокий средний уровень холестерина (5,2±1,3 ммоль/л) и триглицеридов (1,9±1,0 ммоль/л) был связан с приемом большинством пациентов липидснижающей терапии. У ¾ пациентов имелась стенокардия II—III ФК. Более 50% больных ранее перенесли эпизод ОКС с подъемом или без подъема сегмента ST и почти у 20% имелось тяжелое многососудистое поражение коронарного русла. У 24,4% пациентов определялось клинически значимое атеросклеротическое поражение более чем в одном сосудистом бассейне. Сочетание ИБС с ЦВБ выявлено у 18,5% пациентов, ИБС с АПАНК — у 24,4%;
у 7,9% больных имелось сочетанное поражение во всех трех основных сосудистых бассейнах. Хроническая сердечная недостаточность (ХСН) встречалась относительно редко — у 35 (6,9%) больных. У 34 больных наличие ХСН было связано с перенесенным инфарктом миокарда и АГ, у одного — с тахисистолической формой мерцательной аритмии.
Следует отметить высокую приверженность больных к терапии, улучшающей прогноз. Так, статины
получали 84% больных, ингибиторы АПФ — 70%, β-адреноблокаторы — 90% и антиагреганты — почти
100% больных.
Результаты проспективного наблюдения. Период наблюдения за больными составил от 3,5 до 7,5 года, в среднем 5,4±0,1 года. ССО, зарегистрированные у больных ИБС, представлены в табл. 2. Кумулятивная частота конечной точки, определенной как сумма всех случаев обострения атеротромбоза (фатальных и нефатальных), составила 21,1%. Частота комбинированной точки, объединившей случаи обострения атеротромбоза и реваскуляризации пораженного сосудистого бас-
сейна, составила 31,0%.
Необходимо отметить, что тяжесть состояния пациентов не имела тенденции к стабилизации и ССО возникали примерно с одинаковой частотой на протяжении всех 5 лет наблюдения (табл. 3). Некоторое снижение частоты развития ССО, отмеченное по прошествии этого времени, может быть связано с исключением из анализа наиболее тяжелых больных по причине достижения ими конечных точек.
Выявление показателей для включения в прогностическую шкалу. Основной целью работы был поиск предикторов, определяющих долгосрочный прогноз у больных с хронической формой ИБС. По результатам однофакторного анализа из всех изученных клинических и лабораторных показателей было отобрано 16, у которых p<0,4 (табл. 4).
Развитие ССО оказалось прямо связанным с факторами, характеризующими социальное неблагополучие больных, тяжесть ИБС, а также сопутствующие проявления атеротромбоза в церебральном и периферическом сосудистых бассейнах. Обсуждая значение периферического атеросклероза, следует подчеркнуть, что прогностическую значимость имело не только наличие
классической клинической картины ПХ (таких больных было менее 10%), но и снижение ЛПИ ≥0,9, которое встречалось значительно чаще, и более чем в 50% случаев было бессимптомным (см. табл. 1). Высокие ЛПИ (>1,29), связанные с плохой компрессией сосуда (обычно подобная ситуация наблюдается при выраженном кальцинозе сосудистой стенки), как и низкие, ассоциировались с увеличением риска развития неблагоприятных сердечно-сосудистых исходов в среднем на 30%.
Изучаемая популяция больных характеризовалась высокой распространенностью ожирения. Как отмечено выше, средний ИМТ (28,5 кг/м2) в исследуемой группе больных превышал верхнюю границу нормы, принятую ВОЗ (24,9 кг/м2). Нормальные ИМТ обнаружены только у 109 (21,6%) больных, и лишь у одного пациента имелся дефицит массы тела. Избыточная масса тела выявлена у 226 (44,9%) больных, а ожирение I и II степени — соответственно у 135 (26,8%) и 32 (6,4%). При этом имелась четкая тенденция к более низкой частоте развития ССО у лиц с избыточной массой тела по сравнению с теми, у кого масса тела была нормальной либо обнаружено ожирение: 25,2; 39,2 и 33,5%
соответственно.
Для оценки прогноза в изучаемой популяции помимо классификации ожирения ВОЗ нами был использован стандартный квинтильный анализ. Частота развития неблагоприятных исходов была наименьшей у больных с ИМТ, находящимся во втором—четвертом квинтилях распределения. Риск развития ССО для лиц с показателем ИМТ, находящимся в первом квинтиле (<24,9 кг/м2), был выше на 20%, а для лиц в пятом квинтиле (>31,6 кг/м2) — на 99%.
Таблица 1(1). Клиническая характеристика больных с хронической формой ИБС, включенных в исследование.
Согласно данным, приведенным в табл. 1, содержание креатинина в крови и клиренс креатинина в среднем не выходили за рамки принятой нормы. При более детальном анализе оказалось, что более чем у 50% больных имелось нарушение функции почек со снижением клиренса креатинина ≥90 мл/мин. Начальная почечная недостаточность (клиренс креатинина 60—90 мл/мин) регистрировалась у 42,2%, умеренная (клиренс креатинина 30—60 мл/мин) — у 11,4% больных. Нарушение функции почек ассоциировалось с риском развития ССО. Так, у больных с нормальным клиренсом креатинина частота развития ССО составила 27,5% против 32,1% у больных с начальной почечной недостаточностью и 42,1% мкмоль/л у пациентов с умеренной почечной недостаточностью. Различия между сравниваемыми группами, однако, не были статистически достоверными (p=0,09). Более точными оказались результаты квинтильного анализа. Кумулятивная частота развития ССО у лиц с низким клиренсом креатинина, попавшим в первый квинтиль распределения (<67 мл/мин), была почти в 1,5 раза выше, чем у остальных пациентов: 40,1% против 28,7%; p=0,03 (рис. 1).
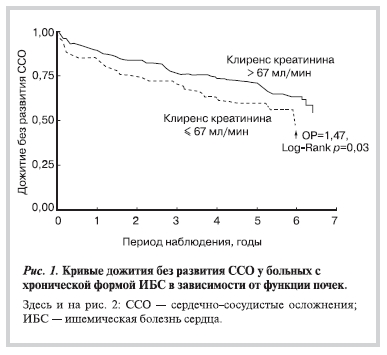
Был проведен поиск факторов, которые могли ассоциироваться со снижением клиренса креатинина.
Вопреки ожиданиям такие традиционные ФР, как АГ, СД, отсутствие терапии ингибиторами АПФ, не были связаны с формированием хронической почечной недостаточности (ХПН). В обследованной популяции больные с нарушенной функцией почек характеризовались более высокой частотой развития сердечной недостаточности (10,9% против 5,9%; p=0,1), отягощенным анамнезом в отношении перенесенных эпизодов ИИ (11,9% против 4,9%; p=0,02) и ТИА (5,9% против 2,5%; p=0,09). Кроме того, эти пациенты были существенно старше (средний возраст в сравниваемых группах 67,5±0,7 года против 57,4±0,4 года; p<0,05), поэтому при оценке отдаленного прогноза с учетом поправки на возраст статистическая значимость результатов квинтильного анализа несколько уменьшилась: относительный риск — ОР 1,47 при 95% доверительном интервале — ДИ от 0,97 до 2,2; p=0,06 (см. табл. 3).
Таблица 2. ССО у больных с хронической формой ИБС (n=503) по данным проспективного наблюдения.
Таблица 3. Частота развития ССО у больных с хронической формой ИБС в различные сроки проспективного наблюдения, %.
Таблица 4. ФР развития ССО у больных с хронической формой ИБС.
У ⅓ больных с хронической формой ИБС в анамнезе было отмечено эрозивно-язвенное поражение
верхних отделов желудочно-кишечного тракта, верифицированное данными эзофагогастродуоденоскопии (см. табл. 1). Чаще всего пациентов включали в исследование при условии стойкой ремиссии продолжительностью не менее 2 мес. Тем не менее относительно недавнее обострение было зарегистрировано у 14,5% пациентов с язвенной болезнью и у 26,0% с эрозивным гастритом. Была выявлена достоверная ассоциация между наличием эрозивного гастрита и развитием ССО (ОР 1,6 при 95% ДИ от 1,2 до 2,4; p=0,02). Для язвенной болезни подобной взаимосвязи
установлено не было.
Нам не удалось определить клинические и лабораторные показатели, которые позволили бы объяснить
худший прогноз в отношении ССО у больных с эрозивным гастритом. Можно лишь предположить, что
негативное влияние было обусловлено уменьшением эффекта клопидогрела (который пациенты могли
получать в связи с процедурами ЧКВ или эпизодами ОКС на протяжении периода наблюдения) на фоне сопутствующего приема ИПН. Следует, однако, отметить, что частота назначения ИПН была небольшой и не различалась между группами эрозивного гастрита и язвенной болезни: 30,1% против 27,7% соответственно. Кроме того, не было выявлено достоверных различий в прогнозе больных с гастритом, принимавших и не принимавших ИПН.
Для моделирования выживаемости и определения показателей, значимых в отношении развития обострения атеротромбоза и потребности в процедурах реваскуляризации, мы использовали регрессионную модель пропорционального риска Кокса. В пошаговый дискриминантный анализ были включены все показатели, значимые при однофакторном анализе, при учете влияния заведомо значащих признаков (возраста), включаемых в модель насильственно.
В обследованной когорте больных со стабильной формой ИБС было выявлено 8 независимых предикторов ССО (рис. 2). Ими оказались наличие стенокардии II—III ФК и постинфарктного кардиосклероза, поражение трех основных коронарных артерий либо ствола левой коронарной артерии, сопутствующие проявления атеротромбоза в церебральном и периферическом сосудистых бассейнах (анамнез ИИ/ТИА, а также низкие либо высокие значения ЛПИ). Кроме того, независимое влияние на прогноз оказывали такие факторы, как избыточная масса тела (ИМТ ≥31,6 кг/м2), нарушение функции почек (клиренс креатинина <67 мл/мин) и наличие в анамнезе эрозивного гастрита. Прогностическая значимость для модели многофакторного риска в целом была достаточно высокой: коэффициент χ2=34,8; p=0,003.
Рисунок 2. Независимые прогностические факторы ССО (смерть, ОКС, ИИ/ТИА, реваскуляризации пораженного сосудистого бассейна) у больных с хронической формой ИБС.
Рисунок 3. Частота обострений атеротромбоза (А) и всех ССО (Б) за 5 лет наблюдения в зависимости от суммы баллов по шкале риска.
В настоящей модели выявленные прогностические факторы оказались практически равнозначными (колебания ОР в диапазоне от 1,3 до 1,8), поэтому каждому из них был присвоено одинаковое значение, равное 1 баллу. Ноль баллов означало отсутствие любого из перечисленных факторов, 1 балл — наличие хотя бы одного фактора и т.д. Максимальное число прогностических факторов у одного больного равнялось шести. В результате получена шкала риска развития ССО для больных со стабильной формой ИБС. Анализ исходов за 5 лет наблюдения продемонстрировал резкое увеличение частоты развития ССО у больных с суммой баллов по шкале риска ≥3 (рис. 3). Таким образом, данная оценка по шкале обладает высокой прогностической ценностью как в отношении развития обострений атеротромбоза (сосудистая смерть, ОКС, ИИ/ТИА), так и отношении всех ССО, включая потребность в процедурах реваскуляризации пораженного сосудистого бассейна. Соответственно больные с хронической формой ИБС, у которых имеется как минимум 3 из 8 определенных нами показателей, могут быть отнесены к группе высокого риска развития ССО.
Обсуждение
Последние десятилетия ознаменовались широким использованием лечебных мероприятий, улучшающих исходы у больных с различными клиническими проявлениями атеротромбоза, включая хроническую форму ИБС. Так, если в 70—80-е годы прошлого века частота развития ССО у больных со стабильной стенокардией лишь немногим отличалась от таковой у больных, недавно перенесших эпизод ОКС, то в настоящее время прогноз у больных со стабильными проявлениями ИБС принято считать относительно благоприятным. Так, по результатам крупных рандомизированных исследований (CAMELOT, ACTION, EUROPA, HOPE и др.), ежегодная частота основных сосудистых осложнений (включая смерть и нефатальный ИМ) у больных с хронической формой ИБС составляет 1,5—3,0% в зависимости от исходной тяжести заболевания и наличия сопутствующих ФР. К сожалению, такие хорошо организованные клинические испытания обладают рядом существенных ограничений, связанных с жесткими рамками, регламентирующими отбор больных и проводимое лечение. Гораздо ближе к реальной ситуации находятся данные медицинских регистров и популяционных исследований, к числу которых относится и настоящая работа.
В качестве сравнения уместно привести результаты наблюдательного исследования, охватившего более 3000 больных со стабильной стенокардией, проживающих в 34 странах Европы (EURO Heart Survey) [27]. На первый взгляд, суммарная частота таких исходов, как смерть и ИМ, в этом исследовании была обычной — 2,3% в год. Однако, если анализ ограничивался только больными с ангиографически подтвержденным коронарным атеросклерозом (n=994), то частота развития ССО оказывалась значительно выше: для суммарного показателя смерти и ИМ она составляла 3,9% в год, а для всех случаев обострений атеротромбоза в коронарном и церебральном бассейне — 21,9% в год. Еще одно крупное исследование [28] объединило результаты пятилетнего наблюдения за почти 2000 амбулаторных больных с недавно установленным диагнозом стабильной стенокардии. За время наблюдения суммарная частота сердечно-сосудистой смерти, нефатального ИМ и процедур реваскуляризации коронарного бассейна составила 25,9%, что практически аналогично данным,
полученным в нашей работе.
Наиболее значимыми для оценки прогноза у больных со стабильными проявлениями атеротомбоза различной локализации (ИБС, ЦВБ и АПАНК) оказались результаты регистра REACH, опубликованные в период с 2006 по 2010 г. [29—31]. В Российской Федерации в регистр были включены 963 больных [32]. Из них более 80% страдали ИБС (изолированной или в сочетании с поражением церебральных и периферических артерий). Исходы у больных, участвовавших в российской части регистра REACH, и исходы в когорте больных с хронической формой ИБС, включенных в наше исследование, оказались
похожими. Так, за 4 года наблюдения в регистре REACH суммарная частота таких исходов, как смерть, ИМ и ИИ, составила 16,9%. По нашим данным, у больных с хронической формой ИБС частота жестких конечных точек, объединивших документированные атеротромботические эпизоды, была почти такой же — 21,2% за 5 лет.
Таким образом, следует признать, что больные со стабильными проявлениями ИБС, несмотря на кажущееся клиническое благополучие, представляют собой группу высокого риска обострений атеротромбоза в коронарном, церебральном и периферическом сосудистых бассейнах. В этой связи представляется актуальной попытка стратификации риска у таких больных с целью оценки прогноза и, возможно, уточнения показаний к инвазивным методам лечения.
Прогностические шкалы хорошо зарекомендовали себя для оценки риска у больных с различными
проявлениями атеротромбоза, включая ОКС [22, 23] и мерцательную аритмию [33]. Делаются успешные попытки определить клинические и ангиографические предикторы долгосрочного прогноза у больных, подвергаемых ЧКВ [24, 25]. Целью нашей работы было создание простой и удобной для использования шкалы, позволяющей прогнозировать развитие неблагоприятных исходов у больных со стабильными проявлениями ИБС. Основой для создания прогностической шкалы послужили рекомендации Европейского кардиологического общества по стратификации риска больных
с хронической формой ИБС [34]. Данные рекомендации предлагают учитывать такие классические факторы, как уровень липидов и глюкозы в крови, анамнез перенесенного ОКС, наличие ХСН, а также тяжесть стенокардии, определенную с помощью различных тестов. Между тем список ФР постоянно расширяется, однако исследований, посвященных комплексной оценке их вклада в развитие осложнений у больных с хронической формой ИБС, практически не проводилось.
Совершенно естественно, что неблагоприятный прогноз у больных с хронической формой ИБС ассоциировался с наличием многососудистого поражения коронарного русла, а также с такими показателями, как социальное неблагополучие, тяжесть стенокардии, анамнез ОКС и ХСН. Результаты нашей работы подтвердили также известное положение о том, что частота развития ССО прямо зависит от сопутствующих проявлений атеротромбоза (в том числе бессимптомных) в церебральном и периферическом сосудистых бассейнах [35, 36]. Данные, касающиеся значимости стандартных ФР, в первую очередь свидетельствуют о хорошо сформированной выборке больных и отсутствии серьезных недостатков при определении основных конечных точек исследования.
Обсуждая ФР развития ССО, следует учитывать особенности популяции, в которой оценивается их влияние на прогноз. В частности, это касается избыточной массы тела и ожирения. Критерии этих состояний, предложенные ВОЗ, общеизвестны. Однако они создавались с учетом в том числе антропометрических показателей населения стран азиатского и африканского регионов, традиционно характеризующегося низким ИМТ. Естественно, что средние значения ИМТ у населения Российской Федерации более высокие, и, таким образом, в нашей стране критерии нормальной массы тела, ассоциирующейся с наилучшим прогнозом, могут оказаться несколько иными. В данном случае речь может идти о более «лояльном» отношении к пациентам с незначительно повышенным ИМТ (предожирением). Прогноз ССО у лиц с ожирением любой степени следует считать неблагоприятным.
Относительно новыми оказались данные о негативном влиянии на прогноз у стабильных больных ИБС умеренно нарушенной почечной функции. До недав него времени неблагоприятным считалось лишь наличие сопутствующей тяжелой ХПН с СКФ менее 30 мл/мин [37]. Как известно, смертность больных с такой патологией достигает 20% в год. В 50% случаев непосредственной причиной смерти являются ССО, возникновение которых обусловлено сопутствующей анемией, АГ и СД, а также повреждением эндотелия вследствие воздействия медиаторов воспаления, гипергомоцистеинемии и нарушений
кальциевого обмена [38].
В отличие от тяжелой ХПН, умеренное нарушение функции почек стали рассматривать в качестве ФР развития ССО сравнительно недавно [18, 22, 39]. Так, в 2004 г. были опубликованы данные объединенного регистра учреждений первичного звена здравоохранения Северной Калифорнии. В регистр были включены 1 120 295 амбулаторных пациентов с различной патологией и известной СКФ [39]. Оказалось, что риск развития ССО возрастал даже при умеренном нарушении функции почек, пропорционально снижению СКФ. При снижении СКФ в пределах 59—45 мл/мин риск развития ССО увеличивался на 40%, а при снижении СКФ до 44—30 мл/мин риск развития ССО возрастал в 2 раза.
Исследования последних лет показали значимость нарушения функции почек в отношении развития ишемических осложнений и кровотечений у больных с ОКС [22, 40]. При этом неблагоприятным считается даже умеренное снижение СКФ <60 мл/мин. Данные о влиянии нарушения функции почек на прогноз у больных со стабильной формой ИБС пока немногочисленны [41]. В 2006 г. эксперты Европейского кардиологического общества [34] сочли необходимым рекомендовать обязательное определение СКФ у таких пациентов, однако уровни СКФ, пригодные для стратификации риска, пока не определены. Ориентируясь на результаты нашей работы, можно обсуждать вопрос об ассоциирующихся с неблагоприятным прогнозом пороговых значениях клиренса креатинина 60—70 мл/мин.
Как указывается в рекомендациях Национального общества по заболеваниям почек США [26], развитие ХПН является следствием старения организма. Тем не менее особо подчеркивается, что СКФ является интегральным показателем, отражающим соматическую отягощенность пациента в отношении большого числа сопутствующих заболеваний, и поэтому ее снижение должно рассматриваться в качестве важного независимого предиктора неблагоприятного прогноза.
Наличие эрозивного гастрита также, вероятно, является маркером соматического неблагополучия больных, а кроме того, может отражать возможное атеросклеротическое поражение ветвей брюшного отдела аорты с развитием хронической ишемии слизистой оболочки желудочно-кишечного тракта. Нельзя исключить также и меньшую приверженность больных с желудочно-кишечными нарушениями к приему различных лекарств, в первую очередь — антиагрегантов. Полученные нами данные о взаимосвязи эрозивного гастрита с развитием ССО могут быть объяснены также возможной сопутствующей инфекцией Helicobacter pylori, роль которой в патогенезе атеротромбоза активно
обсуждается в последнее десятилетие [42].
Обсуждение вопроса о влиянии хронического гастрита на клинические исходы в нашей работе напоминает широко известную дискуссию о неблагоприятных последствиях одновременного приема ИПН и клопидогрела, которые были продемонстрированы в крупных обсервационных исследованиях [43—44]. Напомним, что дизайн этих исследований, так же, как и нашего, не регламентировал ни обследование для выявления гастропатии, ни прием препаратов для защиты желудка. В комментариях к этим исследованиям D. Sibing и A. Kastrati [45] указывалось, что больные, принимавшие ИПН (и, вероятно, имевшие поражение желудочно-кишечного тракта), имели больше сопутствующих заболеваний, что само по себе могло быть маркером худшего клинического исхода. Кроме того, обращалось внимание на возможно меньшую приверженность к приему антитромбоцитарных препаратов.
В заключение следует обратить внимание на особенность обследованной выборки больных, состоявшую в широком назначении препаратов, которые призваны улучшить исходы атеротромбоза (антиагрегантов, статинов, ингибиторов АПФ и β-адреноблокаторов), и сохранявшуюся, несмотря на это, достаточно высокую частоту развития ССО. Нельзя исключить, что последнее связано с несоблюдением предписанного режима применения лекарств, а также с недостижением целевых значений корригируемых ФР: артериального давления, уровня холестерина, глюкозы в крови, ожирением и большим процентом курящих пациентов. Практический вывод состоит в том, что следует более тщательно контролировать действие препаратов, добиваться максимально полной коррекции ФР, а также стремиться к более широкому внедрению в практику инвазивных методов лечения ИБС, главным образом коронарного шунтирования. В первую очередь все это касается больных с высоким риском неблагоприятных исходов, который может быть легко определен с помощью простой и удобной в использовании шкалы, предложенной в настоящей работе.
Выводы
1. У больных с хронической формой ишемической болезни сердца за 5,4 года наблюдения частота обострений атеротромбоза (сердечно-сосудистая смерть, острый коронарный синдром, ишемический инсульт, транзиторная ишемическая атака, периферический тромбоз) составила 21,1%, а суммарная частота всех сердечно-сосудистых осложнений, включая потребность в реваскуляризации пораженного сосудистого бассейна, — 31,0%.
2. Признаками, обладающими прогностической значимостью в отношении сердечно-сосудистых ослож-
нений у больных с хронической формой ишемической болезни сердца, являются наличие стенокардии II—III функционального класса, постинфарктного кардиосклероза, поражение трех основных коронарных артерий либо ствола левой коронарной артерии, сопутствующие проявления атеротромбоза в церебральном и периферическом сосудистых бассейнах (анамнез ишемического инсульта/транзиторной ишемической атаки, а также низкие либо высокие значения лодыжечно-плечевого индекса), избыточная масса тела (индекс массы тела ≥31,6 кг/м2), нарушение функции почек (клиренс креатинина <67 мл/мин) и наличие в анамнезе эрозивного гастрита.
3. Наличие у больных с хронической формой ишемической болезни сердца 3 и более прогностических факторов достоверно ассоциируется с увеличением риска развития сердечно-сосудистых осложнений.



