Одним из важнейших факторов риска развития сердечно-сосудистых осложнений (ССО) является возраст — у женщин старше 65 лет и у мужчин старше 55 лет. Этот возраст взят не случайно: результаты исследований, выполненных на основании принципов доказательной медицины, показывают, что именно в данных возрастных группах начинают активно проявляться метаболические нарушения, влияющие на прогноз ССО. Прежде всего, речь идет о нарушении липидного обмена, распространенность которого в мире значительно возросла [1]. Так, в странах Западной Европы более 50% взрослого населения в возрасте 35—65 лет имеют либо избыточную массу тела (индекс массы тела — ИМТ — от 25 до 29,9 кг/м2), либо ожирение (ИМТ более 30 кг/м2); в США 1/3 всего населения имеют избыточную массу тела (на 20% и более превышающую идеальную массу тела); в России около 30% лиц трудоспособного возраста страдают ожирением, 25% имеют избыточную массу тела.
Всемирная организация здравоохранения (ВОЗ) признала ожирение новой неинфекционной «эпидемией XXI века» [2—4]. По данным многочисленных исследований, абдоминальное ожирение является основным клиническим признаком метаболического синдрома (МС), который включает также нарушение толерантности к глюкозе или сахарный диабет 2-го типа, дислипидемию, артериальную гипертензию (АГ) и гиперурикемию.
Нарушения, объединенные рамками МС, длительное время протекают бессимптомно, но при этом многократно ускоряют развитие АГ, атеросклеротических поражений сосудов и прогрессирование нарушений углеводного обмена [5—10]. Известно, что часть метаболических нарушений можно устранить путем коррекции модифицируемых факторов риска, но немодифицируемые факторы, такие как возраст, могут играть самостоятельную роль в клинической манифестации нарушений метаболизма. Раннее выявление маркеров подобного рода нарушений играет ведущую роль в разработке профилактических мероприятий [11].

Целью данного исследования явилась оценка факторов риска развития АГ и метаболических нарушений у практически здоровых работающих мужчин в возрасте 55 лет.
Материал и методы
В исследование включены 492 работающих мужчины в возрасте 55 лет (М±δ — 55,85±1,95 года), у которых помимо антропометрических показателей (масса тела и рост) и ИМТ, рассчитанного по формуле Кетле, оценивали состояние липидного (общий холестерин — ОХС, триглицериды — ТГ, липопротеиды высокой плотности — ЛВП, липопротеиды низкой плотности — ЛНП), углеводного (глюкоза в плазме крови натощак) и пуринового (мочевая кислота — МК) обменов на автоматическом анализаторе «KONE ULTRA».
 Всем обследуемым пациентам измеряли артериальное давление (АД) с помощью мембранного сфигмоманометра по стандартной методике. АГ констатировали в случае, если регистрировали систолическое АД (САД) >140 мм рт.ст. и диастолическое АД (ДАД) >90 мм рт.ст. (ВНОК, 2011).
Всем обследуемым пациентам измеряли артериальное давление (АД) с помощью мембранного сфигмоманометра по стандартной методике. АГ констатировали в случае, если регистрировали систолическое АД (САД) >140 мм рт.ст. и диастолическое АД (ДАД) >90 мм рт.ст. (ВНОК, 2011).
Морфофункциональное состояние сердечно-сосудистой системы оценивали по данным трансторакальной эхокардиографии (ЭхоКГ) на аппарате Vivid-7. Индекс массы миокарда левого желудочка рассчитывали с помощью программы, разработанной на кафедре терапии и кардиологии ГОУ ДПО «Иркутский ГИУВ» (2008).
Определение толщины интимы—медии (ТИМ) общей сонной артерии осуществляли по данным ультразвукового исследования брахиоцефальных артерий на экстракраниальном уровне. Исследование проводили на аппарате Logiq 5 Expert с использованием линейного датчика с частотой 7,5 МГц по стандартной методике. В соответствии с рекомендациями Европейского общества кардиологов (2010), ТИМ у практически здоровых лиц не превышает 0,9 мм, утолщением считали размеры от 0,9 до 1,3 мм и критерий бляшки — больше 1,3 мм.
Оценку риска развития фатальных сердечно-сосудистых заболеваний (ССЗ) в течение 10 лет определяли с помощью таблицы SCORE (Systematic coronary risk evaluation) [12].
Статистическую обработку полученных данных осуществляли с помощью пакета программ Statistica 8.0 («StatSoft Inc.», США). Для анализа данных между независимыми группами использовали U-критерий Манна—Уитни, для качественных переменных — критерий χ2. Статистически значимыми считали различия при p<0,05. Результаты в тексте представлены в виде М±δ.
Результаты и обсуждение
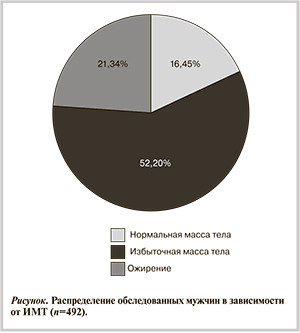
Нарушения липидного обмена выявлены у каждого второго обследованного (см. рисунок).
У 323 (65,65%) обследованных пациентов имелась гиперхолестеринемия, в то время как гипертриглицеридемия регистрировалась крайне редко (n=31; 6,33%) и почти с такой же частотой, как и снижение ЛВП<1 ммоль/л (n=38; 7,77%). Вместе с тем повышение атерогенной фракции холестерина — ЛНП>3 ммоль/л зафиксировано у 369 (75,93%) мужчин. Выраженных нарушений углеводного обмена не отмечено: уровень глюкозы в крови >5,6 ммоль/л выявлен у 80 (16,26%) из 491, а уровень глюкозы в крови >6,9 ммоль/л – всего у 5 (1,02%) обследуемых.
Для анализа взаимосвязи нарушений липидного обмена с углеводным и пуриновым обменами обследуемые были разделены на группы в зависимости от ИМТ (1-я группа — ИМТ<25 кг/м2, n=81; 2-я группа с избыточной массой тела 25<ИМТ<30 кг/м2, n=306; 3-я группа — с ожирением, ИМТ>30 кг/м2, n=105). По возрасту и полу сравниваемые группы пациентов не различались между собой (табл. 1).
Анализ показателей липидного обмена выявил незначительные различия всех атерогенных параметров, за исключением ТГ и ЛВП. Так, уровни ОХС и ЛНП во всех группах находились в пределах физиологической нормы и не различались между собой, при этом уровень ТГ достоверно повышался по мере увеличения ИМТ. Подобная тенденция наблюдалась и в отношении ЛВП. Этот антиатерогенный липопротеид достоверно снижался в группах пациентов по мере повышения ИМТ и во 2-й, и 3-й группах был статистически значимо ниже, чем в 1-й.

Результаты многочисленных исследований убедительно доказали, что увеличение массы тела влияет на уровень АД, приводит к отклонению клинико-биохимических параметров систем транспорта липидов, утилизации глюкозы тканями, опосредованной инсулином, т.е. АГ участвует в процессе развития атеросклероза и связанных с ним заболеваний [13—15]. Результаты нашей работы согласуются с данными Фрамингемского исследования, свидетельствующими о том, что по мере нарастания ИМТ достоверно изменяется уровень гликемии: так, в 1-й группе средний уровень глюкозы в плазме крови натощак был 4,96±0,45 ммоль/л, в то время как в 3-й группе оказался достоверно выше — 5,23±0,94 ммоль/л (р<0,05). Необходимо подчеркнуть, что хотя анализируемые показатели и не выходят за пределы физиологической нормы, прослеживается закономерность не только на стадии клинических проявлений МС, но и на субклинической стадии у практически здоровых мужчин в возрасте 55 лет.
Во многих исследованиях (NHANES и Framingham Heart Study, The Worksite Treatment Program, SHEP) показана роль МК как предиктора сердечно-сосудистой заболеваемости и смертности, а также ее связь с гиперлипидемией, особенно с гипертриглицеридемией и доклиническим поражением органов-мишеней у больных ГБ среднего и высокого риска [16]. Более сильная связь выявлена именно с ТГ, а не с ОХС, что привело к следующему предположению: ТГ являются промежуточным звеном между повышением уровня МК и ОХС [17]. Так, в результате проведенного нами исследования выявлено значимое (p=0,00) различие уровня МК между группой с ИМТ<25 кг/м2 и группой с ИМТ>30 кг/м2, что может свидетельствовать о нарастании нарушений пуринового обмена по мере роста ИМТ (табл. 2).
Крайне интересная взаимосвязь уровня АД и ожирения подтверждена многими исследованиями, в частности Фрамингемским, по данным которого каждые лишние 4,5 кг массы тела увеличивают САД на 4,4 мм рт.ст. [8]. По нашим данным, почти у 1/3 мужчин, включенных в исследование, выявлена АГ (n=143; 29,07%), при этом гипертоническая болезнь (ГБ) I и II стадии регистрировалась примерно с одинаковой частотой — у 72 (51,34%) и 64 (44,76%) соответственно и даже у 7 (4,9%) имелась ГБ III стадии.
Из данных, представленных в табл. 3, видно, что число лиц с АГ оказалось достоверно больше в группе обследованных с ИМТ, превышающим 25 кг/м2, при этом средние уровни АД находилось в пределах физиологической нормы (МОАГ/ВОЗ, 2011).
При анализе показателей, полученных с помощью трансторакальной ЭхоКГ, выявлено, что по мере увеличения ИМТ диаметр аорты и левого предсердия достоверно (p=0,00) увеличиваются, как и возрастает число лиц с утолщением задней стенки левого желудочка и межжелудочковой перегородки (p=0,00), при этом сократительная способность и диастолическая функция сердца не нарушены (табл. 4).

ТИМ традиционно рассматривается в качестве раннего маркера выраженности атеросклеротического сосудистого поражения. В настоящем исследовании констатировано, что у практически здоровых мужчин трудоспособного возраста с увеличением ИМТ наблюдается тенденция к увеличению выявления атеросклеротических бляшек и утолщения эндотелия на уровне брахиоцефальных артерий, однако различия между группами были недостоверными (табл. 5).
Таким образом, клинико-лабораторные и инструментальные исследования, проведенные у мужчин в возрасте 55 лет, которые входят в группу риска развития ССО, позволили сделать выводы, свидетельствующие о неблагоприятном влиянии нарушения липидного обмена, способного индуцировать патологические метаболические нарушения и морфофункциональные изменения сердечно-сосудистой системы.
Выводы
У практически здоровых мужчин в возрасте 55 лет показатели липидного, углеводного и пуринового обменов находятся в пределах физиологической нормы, однако при увеличении индекса массы тела наблюдаются достоверный рост уровня триглицеридов (p=0,01), снижение уровня антиатерогенного липопротеида (p=0,00), повышение концентрации глюкозы в крови натощак (p=0,02) и уровня мочевой кислоты (p=0,01).
По мере нарастания индекса массы тела достоверно (p=0,003) чаще встречается артериальная гипертензия. Морфофункциональное состояние сердечно-сосудистой системы в зависимости от выраженности ожирения проявляется увеличением диаметра аорты и левого предсердия, утолщением задней стенки левого желудочка и межжелудочковой перегородки при сохранной систолодиастолической функции сердца.



