Антагонисты витамина К (АВК), среди которых наиболее известен варфарин, применяются для лечения тромбозов более 50 лет. Доказана высокая эффективность варфарина в первичной и вторичной профилактике тромбоэмболических осложнений у больных фибрилляцией предсердий (ФП). В 5 крупных исследованиях (AFASAK, SPAF, BAATAF, SPINAF, EAFT) было показано, что применение АВК снижает риск возникновения ишемического инсульта на 68% [1—5]. Длительная антикоагулянтная терапия является основой лечения больных с венозными тромбоэмболическими осложнениями — ВТЭО [6] (тромбоз глубоких вен — ТГВ и тромбоэмболия легочной артерии) и пациентов с искусственными механическими клапанами сердца. Пациенты с антифосфолипидным синдромом также нуждаются в профилактике тромбоэмболических осложнений с помощью АВК.
Несмотря на появление новых пероральных антикоагулянтов и получение доказательств их эффективности при лечении пациентов с ФП и ВТЭО, варфарин остается наиболее широко используемым пероральным антикоагулянтом, а у больных с искусственными клапанами сердца, антифосфолипидным синдромом и генетическими тромбофилиями пока не имеет альтернативы.
Однако терапия варфарином сопряжена со сложностями, связанными с узким «терапевтическим окном», необходимостью регулярного контроля международного нормализованного отношения (МНО). Кроме того, варфарин взаимодействует со многими лекарственными препаратами и пищевыми продуктами, что требует особого внимания врача и пациента. Следствием этого являются кровотечения, частота которых при терапии варфарином составляет от 9,0 до 26,5% в год.
При этом крупные кровотечения встречаются с частотой 0,3—4,2% в год, а наиболее часто на фоне терапии АВК отмечаются так называемые малые кровотечения. Наши предыдущие исследования показали, что у пациентов, длительно принимающих варфарин, доля рецидивирующих малых кровотечений при терапевтических значениях МНО составляет около 30%. Эти кровотечения, как правило, не связаны с известным источником кровотечения и возникают при терапевтическом уровне антикоагуляции. Нередко эти кровотечения служат причиной необоснованного прекращения терапии АВК. Причина их возникновения до сих пор не выявлена.
Варфарин не оказывает непосредственного фибринолитического действия, однако динамическое наблюдение за размерами тромбов в ушке левого предсердия у больных ФП [7] и у пациентов с ТГВ [8] продемонстрировало возможность лизиса тромбов на фоне терапии варфарином.
Механизм действия варфарина связан с подавлением синтеза четырех факторов свертывания крови (II, VII, IX, X), что уменьшает образование тромбина. Снижение образования тромбина не только препятствует росту тромбов, но может также стимулировать эндогенный фибринолиз за счет снижения активации активируемого тромбином ингибитора фибринолиза (АТИФ).
Целями нашего исследования были изучение у больных, длительно получающих варфарин, показателей, характеризующих фибринолиз, и оценка их значения в отношении риска развития рецидивирующих кровотечений при терапевтических значениях МНО.
Материал и методы
В настоящий проспективный анализ были включены 78 пациентов (40 мужчин и 38 женщин), средний возраст которых составил 64,3±12,2 года, и имеющих показания к длительному приему варфарина. Больные до включения в исследование не принимали варфарин. Длительность наблюдения за больными составила от 6 до 18 мес, в среднем 13,1±4,2 мес. В качестве АВК был использован варфарин, доза которого была подобрана под контролем МНО. Титрование терапевтической дозы варфарина проводили в соответствии с Российскими рекомендациями по антитромботической терапии у больных со стабильными проявлениями атеротромбоза [9]. Начальная доза в большинстве случаев составляла 5 мг/сут. При назначении варфарина пожилым пациентам начальная доза препарата была уменьшена до 2,5 мг/сут. При подборе индивидуальной дозы варфарина контроль МНО проводили каждые 2—3 дня.
При достижении целевого МНО (2,0—3,0 для больных ФП и 2,5—3,5 для больных с искусственными клапанами сердца), после получения двух последовательных близких значений МНО в пределах терапевтического диапазона следующее определение МНО проводили через 4 нед, а затем ежемесячно или при необходимости. При длительном приеме варфарина важнейшим показателем эффективности проводимой терапии является время нахождения значений МНО в терапевтическом диапазоне (Time in Theraupeutical Range – TTR). Показатель TTR был рассчитан как средняя доля значений МНО (в процентах) для каждого больного, которые находились в пределах терапевтического диапазона.
Пациентов наблюдали амбулаторно. На ежемесячных визитах в клинику проводили осмотр больных с оценкой артериального давления, частоты сердечных сокращений, электрокардиограммы по необходимости, проводили коррекцию медикаментозной терапии. При наличии показаний больных госпитализировали. В период наблюдения больные имели возможность контакта с врачом по телефону.
Для определения развившихся кровотечений мы использовали классификацию S. Fihn и соавт. [10]. Малыми считали кровотечения, не потребовавшие лечения и дополнительного обследования. К большим относили фатальные — повлекшие за собой смерть больного; опасные для жизни — требующие хирургического или ангиографического вмешательства и сопровождающиеся тяжелой кровопотерей; выраженные — явные или скрытые (выявленные при эндоскопическом исследовании) кровотечения: желудочно-кишечное, выраженная гематурия и кровотечения, потребовавшие переливания не менее 2 доз крови.
В зависимости от наличия кровотечений в период наблюдения были сформированы 3 группы пациентов: 1) не имевшие кровотечений за период наблюдения; 2) имевшие за период наблюдения единственное любое кровотечение; 3) страдавшие рецидивирующими малыми кровотечениями при терапевтических значениях МНО на протяжении всего периода наблюдения.
 Определение МНО проводили в течение 1—2 ч после взятия крови. Для определения фибриногена, АТИФ, D-димера и комплекса ПАП отбирали плазму, замораживали и хранили при температуре -70 °С до проведения анализа. Для измерения МНО был использован тромбопластин STA Neoplastin Plus («Diagnostica Stago», Франция) с международным индексом чувствительности 1,25. Определение D-димера проводили при помощи метода иммуноферментного анализа с использованием наборов реактивов Asserachrom D-DI («Diagnostica Stago», Франция). Уровень АТИФ определяли фотометрическим методом с использованием наборов реактивов STA — STACHROM TAFI. Уровень фибриногена определяли методом Клаусса с использованием наборов реактивов STA — Fibrinogen. Уровень ПАП определяли методом иммуноферментного анализа с использованием наборов Technozym PAP complex. Кровь для определения коагулогических показателей брали дважды: до начала лечения и как минимум через 3 мес терапии варфарином.
Определение МНО проводили в течение 1—2 ч после взятия крови. Для определения фибриногена, АТИФ, D-димера и комплекса ПАП отбирали плазму, замораживали и хранили при температуре -70 °С до проведения анализа. Для измерения МНО был использован тромбопластин STA Neoplastin Plus («Diagnostica Stago», Франция) с международным индексом чувствительности 1,25. Определение D-димера проводили при помощи метода иммуноферментного анализа с использованием наборов реактивов Asserachrom D-DI («Diagnostica Stago», Франция). Уровень АТИФ определяли фотометрическим методом с использованием наборов реактивов STA — STACHROM TAFI. Уровень фибриногена определяли методом Клаусса с использованием наборов реактивов STA — Fibrinogen. Уровень ПАП определяли методом иммуноферментного анализа с использованием наборов Technozym PAP complex. Кровь для определения коагулогических показателей брали дважды: до начала лечения и как минимум через 3 мес терапии варфарином.
Статистический анализ был проведен при помощи программы Statistica’99. Для показателей, имеющих нормальное распределение, рассчитывали среднее (М) и стандартное отклонение (SD); результаты представлены как M±SD.
Для количественных непараметрических показателей определяли медиану (Me) и интерквартильный размах (25-й процентиль; 75-й процентиль); результаты представлены как Ме (25%; 75%). Для оценки динамики показателей на фоне лечения варфарином был использован парный непараметрический критерий Вилкоксона. С целью поиска предикторов развития рецидивирующих малых геморрагических осложнений на основании однофакторного анализа были отобраны клинические и лабораторные факторы (p<0,2), которые затем были включены в многофакторный дискриминантный анализ. Различия считали статистически значимыми при p<0,05.
Результаты
В проспективный анализ были включены 78 пациентов с показаниями к длительному приему варфарина. Клиническая характеристика, включенных в исследование больных представлена в табл. 1.
Как видно из результатов, представленных в табл. 1, показанием к назначению варфарина в 80,8% случаев послужило наличие пароксизмальной или постоянной формы ФП. Средняя оценка по шкале CHADS2 составила 2,1±1,3 балла, а по шкале CHA2DS2-VASс — 4,1±1,7 балла. В остальных 19,2% случаев показаниями были перенесенные тромбоэмболические осложнения (7,8%), наличие искусственного клапана сердца (1,3%) и молодой возраст пациентов с ранним закрытием шунтов, стентов, высоким уровнем липопротеина (а) и/или гомозиготным носительством полиморфизма 4G/4G гена PAI (10,3%). Наиболее часто больные страдали гипертонической болезнью — 91%, у 53,8% больных имелась ишемическая болезнь сердца (ИБС), из них у 25,6% был диагностирован постинфарктный кардиосклероз, а 29,5% больных подверглись процедуре чрескожного коронарного вмешательства и/или перенесли операцию коронарного шунтирования. Из сопутствующей патологии у 34,6% больных имелись признаки хронической сердечной недостаточности I—III функционального класса, 19,2% больных перенесли транзиторную ишемическую атаку или инсульт, 19,2% больных страдали сахарным диабетом, у 24,4% было выявлено снижение скорости клубочковой фильтрации (СКФ) ≤60 мл/мин/1,73 м2 и у 15,4% имелось нарушение функции щитовидной железы, медикаментозно компенсированное.
Всего за период наблюдения кровотечения развились у 47 (60,3%) больных, однократные кровотечения — у 21 (26,9%); самыми частыми были повторные малые кровотечения при терапевтическом диапазоне МНО — у 26 (33,3%) больных. Без кровотечений период наблюдения прожил 31 (39,7%) больной.
 Среди 21 больного с однократным кровотечением в период наблюдения у 6 кровотечения развились в 1-й месяц лечения, в период подбора дозы варфарина. Из них в 1-й месяц лечения 3 оказались носителями генотипов, определяющих повышенную чувствительность к варфарину (А/АVKORC1 или аллельных вариантов 2*/2*, 2*/3*, 3*/3*CYP2C9).
Среди 21 больного с однократным кровотечением в период наблюдения у 6 кровотечения развились в 1-й месяц лечения, в период подбора дозы варфарина. Из них в 1-й месяц лечения 3 оказались носителями генотипов, определяющих повышенную чувствительность к варфарину (А/АVKORC1 или аллельных вариантов 2*/2*, 2*/3*, 3*/3*CYP2C9).
У 15 больных однократные кровотечения развились после 1-го месяца лечения. Причиной кровотечений у 4 больных оказались мочекаменная болезнь с движением камня и обострение язвенной болезни желудка, в остальных 11 случаях кровотечения были спровоцированы травмой, операцией, передозировкой препарата (ятрогенной и по неосторожности пациента), добавлением к лечению амиодарона, сопутствующим приемом нестероидных противовоспалительных препаратов (НПВП).
В отдельную группу были выделены 26 пациентов с рецидивирующими малыми кровотечениями, возникавшими без видимых причин при терапевтических значениях МНО.
Время нахождения значений МНО в пределах терапевтического диапазона (TTR) у всех больных составило в среднем 71,5±19,9%, что указывает на адекватную терапию варфарином в целом. Тем не менее у 19 из 78 больных показатель TTR был ниже 65%. Учитывая поставленную задачу, в окончательный анализ мы включили лишь 59 пациентов с адекватной антикоагуляцией (TTR>65%), среди которых малые рецидивирующие кровотечения отмечались у 18. Сравнительная клиническая характеристика пациентов с наличием рецидивирующих кровотечений или без них при терапевтических значениях МНО представлена в табл. 2.
Результаты однофакторного анализа указывают, что у больных с рецидивирующими кровотечениями достоверно чаще встречалась СКФ (CKD-EPI) менее 60 мл/мин/1,73 м2, а также была выявлена тенденция к более частому приему слабительных средств и НПВП.
Динамика коагулогических показателей в ходе лечения варфарином представлена в табл. 3.
На фоне адекватного лечения варфарином отмечено снижение активации свертывания, о чем свидетельствует снижение уровня D-димера с 490 (280; 715) до 361 (236; 469) нг/мл (p=0,0000001). При этом наблюдалось также увеличение уровня комплекса ПАП, отражающего активацию фибринолиза, с 187 (115; 245) до 279 (213; 470) нг/мл (p=0,000003). Нельзя исключить, что активация фибринолиза была обусловлена не только ингибированием свертывания крови, но и снижением уровня АТИФ с 106 (97; 126) до 100 (82; 125) % (p=0,009). Кроме того, на фоне терапии варфарином отмечена тенденция к снижению уровня фибриногена с 3,8 (3,3; 4,2) до 3,5 (3,2; 4,1) г/л (p=0,05).
Учитывая полученные результаты, указывающие на активацию фибринолиза на фоне терапии варфарином, мы более детально проанализировали динамику каждого показателя. Как видно из табл. 4, медиана АТИФ на фоне терапии варфарином снижалась, однако при анализе динамики у каждого пациента снижение АТИФ отмечалось лишь у 42 (71,2%) из 59 больных. Среднее снижение АТИФ у больных с рецидивирующими кровотечениями (n=18) было больше, чем у пациентов (n=41) без кровотечений, —17,8 и 1,4% соответственно.
Как видно из данных, представленных в табл. 4, прослеживается взаимосвязь рецидивирующих кровотечений со степенью снижения АТИФ. Наибольшее количество рецидивирующих кровотечений развилось у больных с наибольшим снижением АТИФ: 14 кровотечений у 30 больных из 1-го и 2-го квартилей, против 4 кровотечений у 29 больных из 3-го и 4-го квартилей (p=0,058).
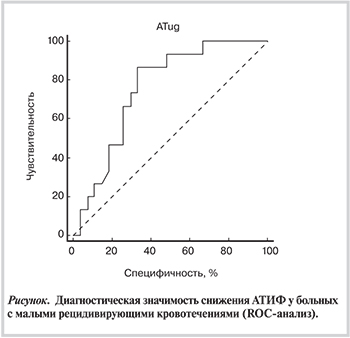
Результаты ROC-анализа (см. рисунок) показали, что снижение АТИФ на терапии фоне варфарином более чем на 15,5% от исходного уровня ассоциируется с развитием малых рецидивирующих кровотечений (чувствительность 87%, специфичность 67%, площадь под характеристической кривой 0,75 при 95% доверительном интервале от 0,6 до 0,9; p=0,029).
При оценке динамики D-димера, ПАП и фибриногена достоверной связи с кровотечениями выявлено не было.
С целью поиска предикторов развития малых рецидивирующих кровотечений при терапевтических значениях МНО был проведен многофакторный дискриминантный анализ, в который на основании результатов однофакторного анализа были включены клинические и лабораторные показатели со значениями p<0,2 (см. табл. 3).
По результатам многофакторного анализа предикторами рецидивирующих малых кровотечений на фоне терапии варфарином оказались следующие показатели: снижение уровня АТИФ от исходного ≥15,5% (p=0,0006), СКФ (CKD-EPI) <60 мл/мин/1,73 м2 (p=0,001), прием НПВП (p=0,045). Отмечена также тенденция к взаимосвязи кровотечений с приемом слабительных препаратов (p=0,088).
Обсуждение
Пименение варфарина ассоциируется с увеличением риска кровотечений, частота которых, по данным крупных исследований, составляет от 9,0 до 26,5%, при этом частота больших кровотечений равна 0,3—4,2% в год [1—5, 11, 12].
Наиболее уязвимым в плане развития геморрагических осложнений является 1-й месяц лечения. В период подбора индивидуальной дозы варфарина высока вероятность развития чрезмерной гипокоагуляции при использовании стандартных схем насыщения. Наиболее часто это наблюдается у носителей генотипов А/А VKORC1 и/или 2*/2*, 2*/3*, 3*/3* CYP2C9, которые определяют повышенную чувствительность к варфарину.
Наши данные указывают, что половина кровотечений, возникших в 1-й месяц лечения на фоне передозировки варфарина, были обусловлены повышенной чувствительностью к препарату, связанной с генетическими особенностями больных, что совпадает с данными других крупных исследований, включая российское многоцентровое исследование ВАРФАГЕН [11].
Наиболее опасными, хотя и не самыми частыми, являются большие кровотечения, которые никогда не остаются без внимания врача и пациента. Крупные кровотечения, как правило, имеют источник. После большого кровотечения при неустраненном источнике антикоагулянтная терапия не возобновляется.
Однако, как показало наше исследование, в структуре всех геморрагических осложнений 55,3% кровотечений, развившихся за период наблюдения, составили малые рецидивирующие кровотечения, возникавшие без видимых причин и источников кровотечений при терапевтическом уровне антикоагуляции. Малые кровотечения, как правило, не угрожают жизни, но тревожат больных и лечащих врачей и часто становятся причиной необоснованной отмены антикоагулянтов, что может послужить причиной фатальных тромбоэмболических осложнений.
Целью нашего исследования был поиск клинических и лабораторных показателей, связанных с рецидивирующими малыми кровотечениями, у больных, получающих варфарин. Для решения поставленной задачи мы ориентировались на известные факторы риска (ФР) развития кровотечений и лабораторные показатели, характеризующие фибринолиз. Варфарин не обладает прямой фибринолитической активностью, однако известно, что лечение варфарином приводит к лизису тромбов. Эти факты дают основания предполагать опосредованное влияние варфарина на систему фибринолиза.
Подтверждением того, что терапия варфарином активирует эндогенный фибринолиз, служит обнаруженное в работе повышение на фоне лечения комплекса ПАП, отражающего образование плазмина. Наблюдавшееся одновременно снижение уровня D-димера, который часто рассматривают как маркер активации фибринолиза, скорее всего, обусловлено изменением баланса между образованием и лизисом фибрина в пользу последнего.
Полученные нами данные о динамике уровня АТИФ позволяют высказать предположение, что активации фибринолиза на фоне терапии варфарином могло способствовать и снижение этого ингибитора. Механизм влияния варфарина на уровень АТИФ нам неизвестен, однако отметим, что о более низком уровне АТИФ у пациентов, получающих варфарин, чем у здоровых доноров, сообщали и другие авторы [12]. АТИФ после активации тромбином приобретает карбоксипептидазную активность, направленную на отщепление С-концевых остатков лизина и аргинина, экспонирующихся на начальных этапах лизиса фибрина и формирующих участки высокого сродства к плазминогену. Их отщепление замедляет лизис сгустка. Концентрация АТИФ в плазме крови на порядок ниже, чем Km (константа Михаэлиса) реакции его активации. Поэтому степень активации АТИФ и, следовательно, его антифибринолитическое действие напрямую зависят как от образования тромбина, так и от уровня АТИФ в плазме [13]
В окончательный анализ нашего исследования были включены больные с ТТR>65%, что соответствует современным требованиям создаваемой антикоагуляции. Тем не менее и при анализе данных всех пациентов были выявлены аналогичные тенденции в динамике показателей, характеризующих фибринолиз.
Поиск ФР малых рецидивирующих кровотечений обнаружил, что они были связаны со сниженной СКФ, приемом НПВП и со снижением уровня АТИФ на фоне терапии варфарином более чем на 15,5%. Стоит отметить, что снижение уровня АТИФ было самым сильным ФР развития рецидивирующих кровотечений. Многофакторный анализ подтвердил наличие связи между снижением АТИФ≥15,5% на фоне терапии варфарином и рецидивирующими кровотечениями.
Другими ФР развития кровотечений оказались снижение СКФ менее 60 мл/мин и прием НПВП. Данные ФР хорошо известны и включены в шкалы для оценки риска геморрагических осложнений HAS-BLED и HEMORR2-HAGES у больных ФП.
В исследовании случай—контроль, включившем 1986 пациентов, было показано, что почечная недостаточность и заболевания печени независимо друг от друга увеличивают риск геморрагических осложнений в 2 раза. Эти данные были подтверждены в исследовании AFFIRM, в котором нарушение функции печени или почек также в 2 раза увеличивало риск развития кровотечений (относительный риск 1,93 при 95% доверительном интервале от 1,27 до 2,93) [14].
Комбинированное использование АВК и НПВП было изучено в ряде исследований. В основном оценивалось влияние сочетанного применения НПВП и АВК на риск развития тяжелых геморрагических осложнений. Так, в некоторых крупных исследованиях было доказано, что прием варфарина и НПВП приводит к 11-кратному увеличению риска развития желудочно-кишечного кровотечения по сравнению с таковым в общей популяции [15, 16].
В нашем исследовании была выявлена тенденция к более частому приему пероральных слабительных препаратов среди больных, имеющих малые рецидивирующие кровотечения. Лекарственные препараты, которые нарушают всасывание веществ в кишечнике: антациды, холестирамин и, в частности слабительные средства, могут уменьшать антикоагулянтный эффект варфарина. Возможно, что нарушение всасывания варфарина снижало его антикоагулянтное действие и МНО и вызывало необходимость увеличения дозы варфарина, что в свою очередь способствовало развитию малых кровотечений.
Выводы
Рецидивирующие малые кровотечения при терапевтических значениях международного нормализованного отношения отмечаются у 33% больных, длительно принимающих варфарин, и составляют 55% от всех развившихся кровотечений.
Показатели, характеризующие свертывающую систему крови (фибриноген и D-димер), на фоне терапии варфарином достоверно снижаются.
Длительная терапия варфарином способствует активации эндогенного фибринолиза, что подтверждает увеличение содержания комплекса плазмин—α2-антиплазмин.
Впервые установлено, что адекватная терапия варфарином снижает содержание активируемого тромбином ингибитора фибринолиза.
Степень снижения активируемого тромбином ингибитора фибринолиза на терапии варфарином ассоциируется с риском развития малых рецидивирующих кровотечений.
Факторами риска развития малых рецидивирующих кровотечений у больных, длительно принимающих варфарин, оказались скорость клубочковой фильтрации менее
60 мл/мин/1,73 м2, прием нестероидных противовоспалительных препаратов и снижение уровня активируемого тромбином ингибитора фибринолиза на фоне терапии варфарином ≥15,5%.



