Ежегодно в мире выполняется около 210 тыс. имплантаций искусственных клапанов сердца (ИКС) [1]. Побочные реакции, связанные с межлекарственными взаимодействиями, представляют главную проблему в клинической практике врача, в том числе специалистов кардиохирургического профиля. Для лекарственных препаратов с узким терапевтическим интервалом, таких как антикоагулянты непрямого действия, необходимо тщательно подбирать и поддерживать дозу. Это может достигаться в том числе и знаниями о генотипическо-фенотипических особенностях пациента.
Наиболее подвержен генетическому полиморфизму изофермент цитохрома Р-450 CYP2C9, который участвует в биотрансформации варфарина. Для данного белка известны альтернативные изоформы (CYP2C9*2 и CYP2C9*3), характеризующиеся значительным снижением активности CYP2C9 [2—5]. Изофермент цитохрома Р-450 2С9 также принимает участие в метаболизме антагониста ангиотензиновых рецепторов лозартана.
Лозартан является пролекарством, т.е. изначально неактивным соединением, и только в печени под действием CYP2C9 образуется активный метаболит Е-3174, который, блокируя рецепторы ангиотензина II, оказывает гипотензивное действие [6, 7]. В последнее время по фармакокинетике лозартана и его метаболита Е-3174 оценивают активность CYP2C9 [8—10]. Определение активности СYP2C9 с помощью лозартанового теста может позволить более адекватно менять дозы варфарина и в значительной степени оптимизировать антикоагулянтную терапию у кардиохирургических больных.
Цель настоящей работы — оценить влияние активности CYP2C9 на подобранные дозы варфарина у пациентов после протезирования клапанов сердца.
Материал и методы
 В ходе исследования проанализированы данные 33 пациентов с протезированием митрального и/или аортального клапанов сердца механическими протезами третьего поколения. Пациенты были оперированы с 2009 по 2011 г. включительно, период послеоперационного наблюдения за пациентами составил от 6 до 12 мес. Среди обследованных было 19 мужчин и 14 женщин. Возраст больных составлял от 12 до 70 лет (средний — 45,5±13,8 года). Обследованным пациентам имплантировано 13 протезов в аортальную позицию, из них 8 дисковых и 5 двустворчатых. В митральную позицию имплантировано 23 протеза, из них 16 дисковых и 7 двустворчатых. При имплантации в двух позициях (аортальной и митральной, 3 пациента) оба протеза были одного вида. Продолжительность лечения в стационаре составила в среднем 14±3 сут.
В ходе исследования проанализированы данные 33 пациентов с протезированием митрального и/или аортального клапанов сердца механическими протезами третьего поколения. Пациенты были оперированы с 2009 по 2011 г. включительно, период послеоперационного наблюдения за пациентами составил от 6 до 12 мес. Среди обследованных было 19 мужчин и 14 женщин. Возраст больных составлял от 12 до 70 лет (средний — 45,5±13,8 года). Обследованным пациентам имплантировано 13 протезов в аортальную позицию, из них 8 дисковых и 5 двустворчатых. В митральную позицию имплантировано 23 протеза, из них 16 дисковых и 7 двустворчатых. При имплантации в двух позициях (аортальной и митральной, 3 пациента) оба протеза были одного вида. Продолжительность лечения в стационаре составила в среднем 14±3 сут.
Оценивали влияние цитохрома Р-450 CYP2C9 и активности CYP2C9 на поддерживающие дозы варфарина у пациентов после протезирования клапанов сердца.
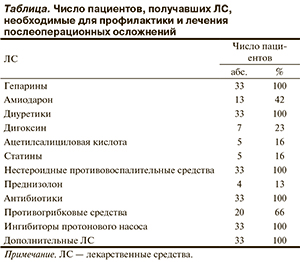
Для профилактики тромботических и тромбоэмболических осложнений всем пациентам на 2—4-е сутки после имплантации ИКС назначали варфарин (варфарин никомед, Никомед Дания АпС). Дозу варфарина подбирали по стандартной схеме, начиная с 5 мг/сут, корректировали в соответствии со значениями международного нормализованного отношения (MHO). Дозу варфарина расценивали как подобранную, если она обеспечивала стабильный терапевтический уровень гипокоагуляции (MHO 2,0—3,0). Клиническими критериями оценки индивидуальной чувствительности к варфарину служили конечная доза варфарина перед выпиской из стационара и доза варфарина, которая требовалась для поддержания полученного эффекта в позднем послеоперационном периоде (через 6—12 мес). До подбора эффективной дозы варфарина терапию дополняли нефракционированным или низкомолекулярным гепарином. Кроме антитромботических препаратов пациенты получали дополнительные лекарственные средства (ЛС), способствующие нормализации деятельности сердца, профилактике и лечению сердечной недостаточности, коррекции функций других органов и систем (таблице).
Носительство аллельных вариантов гена CYP2C9 определяли методом полимеразной цепной реакции с анализом полиморфизма длин рестрикционных фрагментов, предварительно выделив ДНК из лейкоцитов крови.
Активность CYP2C9 оценивали по концентрации метаболита лозартана Е-3174 в моче (собиралась в течение 8 ч) после однократного приема лозартана (лозап, Zentiva, Словацкая Республика) в дозе 50 мг. Концентрацию активного метаболита Е-3174 определяли методом жидкостной хроматографии высокого разрешения.
Активность CYP2C9 у носителей генотипов CYP2C9*1/*1 и CYP2C9-не*1/*1 (CYP2C9*1/*2, CYP2C9*1/*3 и CYP2C9*2/*3) исследовали у кардиохирургических больных и оценивали по фармакокинетике лозартана и его активного метаболита Е-3174. При проведении лозартанового теста не отмечено жалоб или нежелательных лекарственных реакций у участников исследования. Анализ уровня гипокоагуляции в нашем исследовании производили с помощью образцов капиллярной крови на приборе Protime.
Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
 В результате генотипирования по полиморфному маркеру СYP2С9 пациенты распределились следующим образом: носители генотипа СYP2C9*1/*1 — 23 человека; носители генотипа СYP2C9*1/*2 — 8 человек; носители генотипа СYP2C9*1/*3 — 2 человека.
В результате генотипирования по полиморфному маркеру СYP2С9 пациенты распределились следующим образом: носители генотипа СYP2C9*1/*1 — 23 человека; носители генотипа СYP2C9*1/*2 — 8 человек; носители генотипа СYP2C9*1/*3 — 2 человека.
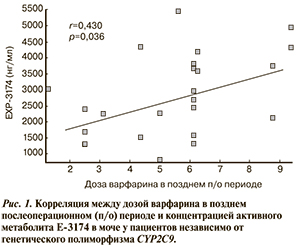
Известно, что у пациентов — носителей генотипов CYP2C9*2 и CYP2C9*3 активность CYP2C9 меньше, чем у носителей генотипа CYP2C9*1/*1, поэтому мы объединили их в одну группу (CYP2C9-не*1/*1). Корреляционный анализ влияния активности CYP2C9 на подобранную дозу варфарина у пациентов после имплантации ИКС независимо от генетического полиморфизма показал, что уровень активного метаболита Е-3174 не влияет на подобранную дозу варфарина в раннем послеоперационном периоде. В позднем послеоперационном периоде независимо от полиморфизма гена CYP2C9 уровень активного метаболита Е-3174 положительно коррелировал с подобранными дозами варфарина (r=0,430; р=0,036) (рис. 1). После распределения пациентов по группам в зависимости от генотипов CYP2C9*1/*1 и CYP2C9-не*1/*1 выявлено, что данная корреляция в большей степени наблюдается у пациентов с генотипом CYP2C9*1/*1 (r=0,479; р=0,051).
У объединенной группы пациентов с генотипом CYP2C9-не*1/*1 (CYP2C9*1/*2 и CYP2C9*1/*3) корреляция отсутствовала (r=0,491; р=0,266). Полученные результаты показывают, что у пациентов в раннем послеоперационном периоде сочетание большого количества ЛС, необходимых для профилактики и лечения послеоперационных осложнений, приводит к сложным фармакодинамическим и фармакокинетическим процессам и изменяет их у варфарина. В то же время после отмены сопутствующей терапии естественные процессы биотрансформации варфарина восстанавливаются, и у пациентов с более интенсивным выведением активного метаболита лозартана наблюдается необходимость к повышению дозы варфарина.
С помощью точного критерия Фишера мы сравнили подобранные дозы варфарина в раннем и позднем послеоперационном периодах у пациентов в зависимости от концентрации активного метаболита Е-3174 (менее и более 2500 нг/мл). В раннем послеоперационном периоде у пациентов с генотипом CYP2С9-не*1/*1 статистически значимые различия между подобранными дозами варфарина отсутствовали (р=1,000 и р=0,523 соответственно). В то же время в позднем послеоперационном периоде у пациентов с концентрацией метаболита Е-3174 в моче менее 2500 нг/мл подобранная доза варфарина была статистически значимо ниже, чем у пациентов с концентрацией метаболита Е-3174 в моче более 2500 нг/мл, независимо от полиморфизма гена CYP2С9 (р=0,008) (рис. 2).
Концентрация активного метаболита Е-3174 в моче менее 2500 нг/мл по результатам лозартанового теста, выполненного до хирургического вмешательства, с чувствительностью 83% и специфичностью 80% служит прогностическим фактором выхода на «низкие» дозы варфарина (менее 5 мг) в позднем послеоперационном периоде, с прогностической ценностью положительного результата 83% и прогностической ценностью отрицательного результата 80% (отношение шансов — ОШ 20 при 95% доверительном интервале — ДИ от 2,284 до 175,13). После распределения пациентов в зависимости от полиморфизма гена CYP2С9 выявлено, что данное различие наблюдается в основном у носителей аллельного варианта CYP2С9*1/*1 (р=0,049).
Концентрация активного метаболита Е-3174 в моче менее 2500 нг/мл по результатам лозартанового теста, выполненного до хирургического вмешательства у пациентов с генотипом CYP2С9*1/*1, с чувствительностью 87% и специфичностью 66% прогностическим фактором выхода на «низкие дозы варфарина» (менее 5 мг) в позднем послеоперационном периоде, с прогностической ценностью положительного результата 70% и прогностической ценностью отрицательного результата 85% (ОШ 14 при 95% ДИ от 1,135 до 172,75). Различия между дозами варфарина в зависимости от концентрации активного метаболита Е-3174 у пациентов с генотипом CYP2С9-не*1/*1 оказались статистически незначимыми (р=0,485).
Для подтверждения полученных результатов мы сравнили подобранные дозы варфарина в зависимости от концентрации активного метаболита Е-3174 в моче с помощью непараметрического критерия Манна—Уитни. При сравнительном анализе подобранных доз варфарина в раннем послеоперационном периоде в зависимости от концентрации активного метаболита Е-3174 в моче (менее и более 2500 нг/мл) статистически значимых различий не выявлено у пациентов с генотипами CYP2С9*1/*1 (р=0,665) и CYP2С9-не*1/*1 (р=0,303).
В позднем послеоперационном периоде у всех пациентов независимо от генетического полиморфизма CYP2С9, доза варфарина при концентрации активного метаболита менее 2500 нг/мл была статистически значимо ниже, чем у пациентов с концентрацией метаболита более 2500 нг/мл (4,55±2,0 и 6,312±2,23 мг соответственно; р=0,054). Генотипирование пациентов показало, что данное различие свойственно в основном лицам с аллельным вариантом CYP2С9*1/*1 (р=0,027), по сравнению с пациентами с аллельными вариантами CYP2С9-не*1/*1 (р=0,549).
 Мы сравнили концентрацию активного метаболита Е-3174 в моче у пациентов с низкой (менее 5 мг) и высокой (более 5 мг) дозой варфарина в зависимости от полиморфизма гена CYP2С9. Статистически значимых различий между концентрацией активного метаболита Е-3174 в моче и подобранной дозой варфарина в раннем послеоперационном периоде у пациентов с генотипами CYP2С9*1/*1 и CYP2C9-не*1/*1 получено не было (р=0,679 и р=0,346 соответственно). Независимо от полиморфизма гена CYP2С9 в позднем послеоперационном периоде, концентрация активного метаболита Е-3174 в моче была статистически значимо ниже у пациентов с низкими подобранными дозами варфарина (3341,78±1214,1 и 2205,61±981,89 нг/мл соответственно; р=0,023).
Мы сравнили концентрацию активного метаболита Е-3174 в моче у пациентов с низкой (менее 5 мг) и высокой (более 5 мг) дозой варфарина в зависимости от полиморфизма гена CYP2С9. Статистически значимых различий между концентрацией активного метаболита Е-3174 в моче и подобранной дозой варфарина в раннем послеоперационном периоде у пациентов с генотипами CYP2С9*1/*1 и CYP2C9-не*1/*1 получено не было (р=0,679 и р=0,346 соответственно). Независимо от полиморфизма гена CYP2С9 в позднем послеоперационном периоде, концентрация активного метаболита Е-3174 в моче была статистически значимо ниже у пациентов с низкими подобранными дозами варфарина (3341,78±1214,1 и 2205,61±981,89 нг/мл соответственно; р=0,023).
После генетического анализа установлено, что к данным различиям в большей степени предрасположены носители генотипа CYP2С9*1/*1 (р=0,084) по сравнению с пациентами с генотипом CYP2С9-не*1/*1 (р=0,146).
Отсутствие взаимосвязи между концентрацией метаболита в моче и дозой варфарина можно объяснить тем, что большое количество применяемых в раннем послеоперационном периоде ЛС взаимодействуют с варфарином не только на уровне биотрансформации (влияя на активность 2С9), но и по типу фармакокинетического взаимодействия на уровнях всасывания, связи с белками плазмы крови, выведения почками, а также по типу фармакодинамического взаимодействия. В позднем послеоперационном периоде количество применяемых ЛС сокращается, вероятность взаимодействия снижается, остается неизменным генетический фактор, поэтому корреляция между метаболитом лозартана и дозой варфарина в позднем послеоперационном периоде становится достоверной. Следует отметить, что была попытка использовать лозартановый тест для расчета поддерживающей дозы варфарина в комбинации с результатами генотипирования CYP2C9 и VKORC1 у 132 пациентов, получающих варфарин с сопутствующей терапией (11±4 ЛС в сутки). После определения концентрации лозартана и его метаболита Е-3174 в моче рассчитывали метаболическое отношение (отношение Е-3174/лозартан). Метаболическое отношение лозартана в моче имело тенденцию повышаться у пациентов, принимающих низкие дозы варфарина (6,5±6,3), по сравнению с таковым у пациентов, получавших средние (4,1±4,3) и высокие дозы (1,7±1,1; р>0,5) [11].
Заключение
Учитывая тяжесть состояния больных после имплантации искусственных клапанов сердца, сопутствующее назначение различных лекарственных средств, влияющих на метаболизм варфарина и высокий риск развития кровотечений, перспективным следует признать индивидуализацию антикоагулянтной терапии. Определение полиморфизма гена CYP2C9 и его активности с помощью лозартанового теста даст более достоверную информацию о поддерживающей дозе варфарина, снизит частоту развития кровотечений и колебаний значений международного нормализованного отношения больных у этой категории. Таким образом, изучение генетического полиморфизма фермента метаболизма варфарина, а также его активности может позволить прогнозировать риск послеоперационных осложнений и индивидуализировать подход к назначению непрямых антикоагулянтов у пациентов после имплантации искусственных клапанов сердца.



