Антагонисты витамина К, среди которых наиболее широко применяется варфарин, активно используются в клинической практике более 60 лет и, несмотря на появление новых пероральных антикоагулянтов, занимают лидирующую позицию среди пероральных антикоагулянтов, применяемых с целью длительной профилактики и лечения тромбозов и тромбоэмболий.
Высокая эффективность варфарина доказана в отношении первичной и вторичной профилактики тромбоэмболических осложнений у больных, страдающих фибрилляцией предсердий (ФП). Мета-анализ 6 исследований (AFASAK I, SPAF, BAATAF, CAFA, SPINAF, EAFT), охвативший 2900 больных ФП, выявил снижение относительного риска развития инсульта на 62% при использовании антагонистов витамина К [1—5]. Варфарин до недавнего времени был единственным препаратом для лечения венозных тромбозов.
Однако существует ряд сложностей, связанных с длительной терапией варфарином. Основная опасность — возможность кровотечений, частота которых, по данным крупных исследований, составляет 9,0—26,5%, среди них на крупные геморрагии приходится 0,3—4,2% в год [1—7]. Наиболее часто кровотечения развиваются в 1-й месяц терапии при подборе индивидуальной дозы препарата.
Известно, что чувствительность к варфарину генетически обусловлена. Кровотечения, возникающие на фоне чрезмерной гипокоагуляции в начале терапии, связаны с носительством аллельных вариантов основного фермента биотрансформации варфарина в печени CYP2C9 и молекулы-мишени VKORС1 [8—10].
В настоящее время известно 3 шкалы для оценки риска кровотечений, разработанных для пациентов с ФП: HAS-BLED, HEMORR2HAGES и ATRIA. Наиболее удобными для врачей представляются шкалы HAS-BLED и HEMORR2HAGES, разработанные сотрудниками Вашингтонского университета на основании анализа 3978 пациентов, National Registry of Atrial Fibrillation (NRAF) [11, 12]. Современные Европейские, Российские и Американские клинические рекомендации для оценки риска кровотечений у больных ФП предлагают использовать шкалу HAS-BLED. Задача данной шкалы — выявить больных с высоким риском кровотечений, устранить у них возможные факторы риска и выбрать наиболее безопасный для больного антикоагулянт.
Тем не менее геморрагические осложнения могут возникнуть и у больных с низким риском кровотечений. Наибольшее число кровотечений возникает в начале лечения, и это связано в первую очередь с фармакогенетикой варфарина. Шкала HAS-BLED в отличие от шкалы HEMORR2HAGES не позволяет оценить вклад полиморфизма генов, ответственных за метаболизм варфарина.
Цель исследования: у больных, длительно принимающих варфарин, сопоставить реальную частоту геморрагических осложнений (ГО) с риском кровотечений, определенным на основании шкал HAS-BLED и HEMORR2HAGES.
Материал и методы
В настоящий анализ были включены 119 пациентов — 72 мужчины и 47 женщин в возрасте от 31 до 79 лет, наблюдавшихся в лаборатории клинических проблем атеротромбоза в связи с показаниями к длительному приему варфарина. Длительность наблюдения за больными составила от 1 года до 10 лет. Все пациенты принимали варфарин в индивидуально подобранной дозе. Средний процент времени пребывания пациентов в терапевтическом диапазоне международного нормализованного отношения — МНО (TTR) составил 65,6±22,7%. Средняя длительность лечения варфарином составила 5,4±3,4 года. Титрование терапевтической дозы варфарина проводилось в соответствии с российскими рекомендациями по антитромботической терапии у больных со стабильными проявлениями атеротромбоза [13]. Алгоритм подбора дозы варфарина представлен в табл. 1.
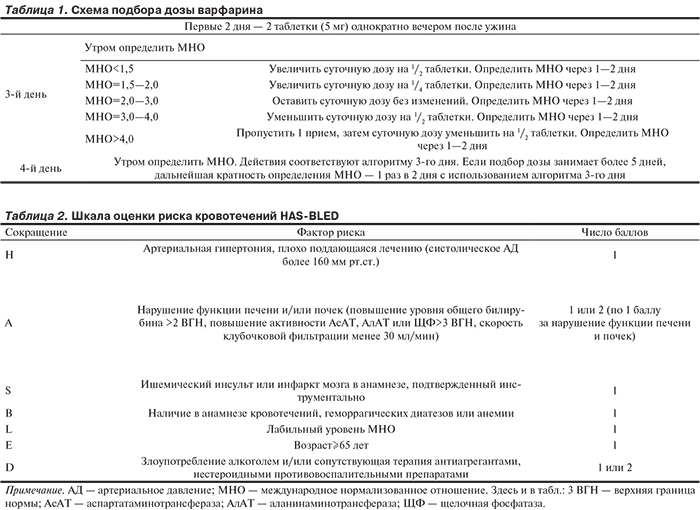
Для оценки риска развития ГО у больных, получающих варфарин, использовали шкалы HAS-BLED и HEMORR2HAGES, которые представлены соответственно в табл. 2 и 3.
В соответствии с набранной суммой баллов больных поделили на группы низкого (менее 3 баллов по шкале HAS-BLED и менее 4 баллов по шкале HEMORR2HAGES) и высокого (3 и более баллов по шкале HAS-BLED и 4 и более баллов по шкале HEMORR2HAGES) риска развития ГО. Риск кровотечений определяли на момент начала терапии варфарином.
В нашем исследовании использовали классификацию кровотечений S. Fihn и соавт. [6]. Малыми считали кровотечения, не потребовавшие лечения и дополнительного обследования, большими — кровотечения, потребовавшие дополнительного обследования или переливания не менее 2 доз крови. Угрожающими жизни считали кровотечения, потребовавшие хирургического или ангиографического вмешательства, вызвавшие необратимые осложнения в органе или остановку сердца. Угрожающие жизни были отнесены к категории больших кровотечений.
Отдельно были проанализированы 3 вида кровотечений: 1) возникшие в течение 1-го месяца, при подборе терапевтической дозы варфарина на фоне МНО>4,0; 2) однократные, возникшие после 1-го месяца лечения варфарином; 3) повторные (неоднократно рецидивирующие) на протяжении всего периода лечения.
Всем пациентам было проведено генотипирование для определения носительства аллельных вариантов основного фермента биотрансформации варфарина в печени CYP2C9 и молекулы-мишени VKORС1 в цельной венозной крови методом полимеразной цепной реакции.
Статистический анализ проводился методами непараметрической статистики при помощи программы Statistica 99 с использованием метода таблиц сопряженности 2×2, критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты
Клиническая характеристика больных представлена в табл. 4. Показанием к назначению варфарина у 98 больных послужило наличие постоянной или пароксизмальной формы ФП (средняя оценка по шкале CHA2DS2-VASc 2,9 балла), у 17 больных — перенесенный тромбоз глубоких вен или тромбоэмболия легочной артерии (ТЭЛА), у 4 пациентов — тромбоз левого желудочка или перенесенный эпизод тромбоэмболии.

Как видно из данных, представленных в табл. 4, 89% пациентов страдали гипертонической болезнью, у 47,9% диагностирована ишемическая болезнь сердца, у 8% выявлена хроническая сердечная недостаточность, язвенное или эрозивное поражение желудка отмечено у 11,8 и 15,1% пациентов соответственно. Сахарный диабет отмечался у 24,4% больных, а заболевание или нарушение функции щитовидной железы у 33,6%.
Средняя частота всех кровотечений за период наблюдения составила 18,02% в год, из них больших – 1,06%, малых — 16,96%. Средняя частота всех кровотечений за 1-й год лечения составила 29,4%, из них больших – 3,3%, малых — 26,1%.
За период наблюдения кровотечения случились у 47 больных:
- у 8 (17%) в 1-й месяц лечения при МНО>4,0;
- у 12 (25,5%) были зафиксированы однократные ГО после 1-го месяца лечения и у 27 (57,6%) больных отмечены рецидивирующие кровотечения после 1-го месяца лечения.
Распределение больных с различными видами кровотечений в группах низкого и высокого риска, рассчитанного по шкалам HAS-BLED и HEMORR2HAGES, представлено в табл. 5.
В соответствии со шкалой HAS-BLED, 61 пациент оказался в группе высокого риска, а 58 — в группе низкого риска кровотечений. Среди 61 пациента из группы высокого риска кровотечения за период наблюдения отмечались у 35:
- у 5 пациентов отмечались ГО в 1-й месяц лечения при МНО>4, у 8 возникали однократные ГО после 1-го месяца,
- а у 22 были повторные ГО после 1 мес лечения.
Среди 58 пациентов группы низкого риска по шкале HAS-BLED кровотечения развились у 12. Из них у 3 пациентов – в 1-й месяц лечения при МНО> 4, у 4 отмечались однократные ГО после 1-го месяца и у 5 больных были повторные ГО после 1 мес лечения.
Таким образом, в соответствии со шкалой HAS-BLED, в группе высокого риска ГО оказался 61 пациент, в которой у 35 (57,4%) были зарегистрированы ГО. В группе низкого риска оказалось 58 пациентов, из которых у 12 (20,7%) были зарегистрированы ГО. Анализ числа больных с кровотечениями не выявил зависимости от степени риска по шкале HAS-BLED (35 больных с кровотечениями среди 61 пациента против 12 кровотечений среди58 пациентов; p=0,23).

По шкале HEMORR2HAGES в группу высокого риска попали 10 пациентов, а 109 оказались в группе низкого риска кровотечений. Среди 10 пациентов с высоким риском кровотечений у 9 за период наблюдения были те или иные кровотечения. Из них у 2 человек отмечались однократные кровотечения спустя 1 мес лечения, а у 7 – повторные ГО спустя 1 мес лечения. Кровотечений в 1-й месяц при МНО>4 не было ни у кого.
Среди 109 пациентов группы низкого риска по шкале HEMORR2HAGES кровотечения произошли у 38, из них у 8 в 1-й месяц лечения при МНО>4, у 10 отмечались однократные ГО после 1-го месяца и у 20 пациентов были повторные ГО после 1-го месяца лечения.
Достоверной зависимости между числом всех кровотечений и суммарной оценкой по шкале HEMORR2HAGES выявлено не было, однако прослеживалась тенденция к увеличению числа больных с кровотечениями в группе высокого риска: 9 (90%) больных с кровотечениями из 10 больных высокого риска против 38 (34,9%) больных с кровотечениями из 109 больных низкого риска (p=0,06).
Группы высокого и низкого риска, определенного на основе шкал HAS-BLED и HEMORR2HAGES, различались лишь по числу пациентов с повторно возникающими кровотечениями. По шкале HAS-BLED из 61 пациента из группы высокого риска были 22 (36,1%) с повторными кровотечениями против 5 (8,6%) с повторными кровотечениями среди 58 больных из группы низкого риска (p=0,0048).
По шкале HEMORR2HAGES пациенты с повторными ГО также встречались чаще в группе высокого риска: 7 (70%) из 10 пациентов против 20 (18,35%) из 109 в группе низкого риска (р=0,018).
При отдельном анализе кровотечений, возникших в связи с передозировкой варфарина (при значении МНО>4 в 1-й месяц лечения), и однократно возникавших кровотечений, начиная со 2-го месяца лечения, статистически значимых различий в группах высокого и низкого риска кровотечений, рассчитанных по обеим шкалам, обнаружено не было.
Повышенная чувствительность к варфарину в виде носительства генотипа А/А VKORC1 и/или аллельных вариантов 2*/2*, 2*/3*, 3*/3* CYP2C9 была выявлена у 25 пациентов, что составило 21% от общего числа больных (табл. 6).
Как видно из данных, представленных в табл. 6, среди 25 носителей аллельных вариантов, ассоциированных с повышенной чувствительностью к варфарину, у 15 отмечались кровотечения: у 6 – повторные, у 3 — однократные, начиная со 2-го месяца лечения, и у 6 — кровотечения в 1-й месяц лечения на фоне передозировки варфарина (МНО>4,0). Таким образом, среди 8 больных с кровотечениями, возникавшими в 1-й месяц лечения на фоне передозировки варфарина (при МНО>4,0), 6 (75%) оказались носителями полиморфизмов, ассоциированных с повышенной чувствительностью к варфарину против 10 носителей полиморфизмов из 72 больных, переживших период наблюдения без кровотечений (р=0,011).
Обсуждение
Кровотечения являются наиболее опасными осложнениями терапии варфарином. По данным разных исследований, частота всех кровотечений составляет 9—26,5%, среди которых на большие геморрагии приходится 0,3—4,2% в год.
Большинство авторов признают, что наибольший риск кровотечений отмечается в начале лечения, что может быть связано с наличием скрытых источников кровотечений и генетически детерминированными особенностями пациентов. Так, в мета-анализе, проведенном L.A. Linkins и соавт., было проанализировано 33 исследования (4374 человеко-лет), частота всех больших кровотечений составила 13,4% в первые 3 мес лечения и в дальнейшем снижалась до 9,1% [14].
В нашем исследовании средняя частота всех кровотечений за 1-й год лечения составила 29,4%, из них больших– 3,3%, малых — 26,1%. В дальнейшем частота кровотечений снизилась и составила 18,02% в год (больших – 1,06% в год, малых — 16,96% в год). Полученные нами данные совпадают с результатами наших предыдущих исследований [8, 9] и других исследователей [14, 15] и подтверждают преобладание малых кровотечений в структуре всех геморрагий, а также указывают на то, что наиболее уязвимым в отношении риска кровотечений является начало терапии варфарином.
Особенность нашего исследования заключается в ретро- и проспективном анализах кровотечений в когорте больных, длительно принимающих варфарин и наблюдающихся в лаборатории клинических проблем атеротромбоза института кардиологии им. А.Л. Мясникова в течение последних 1—10 лет. Наблюдение за пациентами включало подбор индивидуальной дозы варфарина и дальнейший регулярный контроль МНО и состояния пациентов.

Как известно, важнейшим показателем адекватности проводимой терапии антагонистами витамина К является процент измерений МНО, оказавшихся в терапевтическом диапазоне, за период наблюдения (показатель ТТR). Терапия варфарином считается адекватной, если этот показатель составляет не менее 60%. В нашем исследовании средний процент времени пребывания пациентов в терапевтическом диапазоне МНО составил более 65%, что указывает на адекватность проводимой антикоагулянтной терапии. В реальной клинической практике показатель МНО часто не достигает 60%. Так, по данным, опубликованным FDA в США в 2009 г., диапазон МНО в специализированных коагуляционных клиниках составлял 58—68%, а у пациентов, получающих варфарин и наблюдающихся врачами общей практики — 38—63%.
Состояния и заболевания, связанные с риском кровотечений (пожилой возраст, уровень артериального давления более 160 мм рт.ст., перенесенный ишемический инсульт, нарушение функции печени и почек, нестабильное МНО, а также повышения МНО более 4 с развитием кровотечений) легли в основу известных шкал для оценки риска кровотечений. Наиболее распространенными в настоящее время являются шкалы HAS-BLED и HEMORR2HAGES. Шкала HAS-BLED доказала свою прогностическую значимость в независимых когортах более чем у 180 тыс. пациентов с ФП [16]. Результаты оценки риска кровотечений больных по данной шкале коррелировали с риском развития больших геморрагических событий, в частности с внутричерепными кровоизлияниями.
Оценка риска кровотечений по шкалам HAS-BLED и HEMORR2HAGES у пациентов, вошедших в наше исследование, показала разные результаты. По шкале HAS-BLED высокий риск кровотечений был определен у 51,3% пациентов, а по шкале HEMORR2HAGES только у 8,4%.
Большие кровотечения наиболее опасны и не остаются без внимания врача и пациента. Порой кровотечение служит первым проявлением имевшегося у пациента бессимптомного источника кровотечения, после устранения которого терапия антагонистами витамина К может быть возобновлена. Однако в структуре кровотечений превалируют малые, которых и в нашем исследовании оказалось больше, чем больших (26,1% за 1-й год и 16,96% в год в среднем за весь период наблюдения). Малые кровотечения, как правило, не угрожают жизни пациентов, но часто рецидивируют и надоедают пациентам, а также могут послужить основанием для отмены антикоагулянтной терапии. Немотивированная отмена варфарина у пациентов с высоким риском тромботических осложнений, например у пациентов с ФП и высоким риском развития инсульта/тромбоэмболий, тромбозом полостей сердца, может быть причиной фатальных тромбоэмболических осложнений.
Принимая во внимание практическую важность малых кровотечений, особенно рецидивирующих, мы включили в анализ все кровотечения, возникшие за период наблюдения, выделив развившиеся в период подбора дозы на фоне передозировки варфарина (при МНО>4,0), а также однократные и рецидивирующие кровотечения, возникавшие после 1-го месяца лечения варфарином.
В структуре всех кровотечений чаще всего встречались рецидивирующие кровотечения — 57,6% от всех произошедших кровотечений.
В нашем исследовании группы больных высокого и низкого риска кровотечений, рассчитанного по обеим шкалам, различались лишь по числу больных с рецидивирующими кровотечениями. В реальной жизни существует масса причин для возникновения рецидивирующих кровотечений (плохой контроль артериального давления, сопутствующий прием алкоголя, медикаментозных препаратов, декомпенсация деятельности сердца, плохой контроль потенциального источника кровотечения и т.п.).
Шкалы «не работали» в отношении однократно возникающих кровотечений и ГО, связанных с передозировкой варфарина в период подбора дозы. Возможно, это связано с небольшим числом больных в нашем исследовании, но также и с тем, что носительство полиморфизмов генов CYP2C9 и VKORС1 не учитывается в шкале HAS-BLED.
Мы не обнаружили связи между высоким риском кровотечений, определенным по шкалам, и реальным числом больных с кровотечениями, произошедшими в 1-й месяц терапии при МНО>4. Тем не менее именно 1-й месяц лечения антагонистами витамина К наиболее уязвим в отношении риска кровотечений при эмпирическом подборе дозы препарата, что может быть связано с индивидуальной чувствительностью пациентов к варфарину.
В настоящее время известно 58 полиморфных вариантов гена, кодирующего CYP2C9. Наиболее распространенным в популяции является первый аллельный вариант CYP2C9*1 («дикий тип»), при котором скорость метаболизма варфарина стандартна. Носительство второго (CYP2C9*2) и третьего (CYP2C9*3) аллельных вариантов среди европейского населения встречается значительно реже — 11,3 и 8,3% соответственно, они обусловливают замедленное выведение варфарина из организма, а, следовательно, повышение уровня его концентрации в крови, что может привести к чрезмерной гипокоагуляции и развитию кровотечений.
Другим геном, который влияет на величину индивидуальной дозы варфарина, является VKORC1, кодирующий молекулу — мишень антагонистов витамина К в печени, витамин К-эпоксидредуктазный комплекс. В 2005 г. H.Y. Yuan и соавт. изучали влияния полиморфизма G1639А гена VKORС1 на фармакодинамику варфарина. Оказалось, что аллель А ассоциировался с высокой чувствительностью к варфарину, это обусловливало передозировку варфарина в 1-й месяц лечения и способствовало развитию геморрагических осложнений, в то время как аллель G ассоциировался с низкой чувствительностью к данному препарату, что защищало от передозировки [10]. Сочетание указанных аллелей образует 3 возможных генотипа гена VKORC1 по полиморфному локусу 1639: G/G — гомозиготный генотип «дикого типа», G/A — гетерозиготный вариант и А/A — гомозиготный «варфарин-чувствительный» вариант. Распространенность данных генотипов среди европейского населения составляет 39, 47 и 13% соответственно.
Генетически обусловленная повышенная чувствительность к варфарину (носительство генотипа А/А гена VKORC1 и/или генотипов 2*/2*, 2*/3*, 3*/3* гена CYP2C9) была выявлена у 21% больных, что совпадает с результатами российского исследования ВАРФАГЕН, в котором обнаруживали повышенную чувствительность к варфарину у 19% больных [9]. Как и в исследовании ВАРФАГЕН, мы обнаружили связь между частотой кровотечений, возникших в 1-й месяц лечения на фоне передозировки варфарина, и генетически обусловленной повышенной чувствительностью к варфарину.
На современном этапе не считается целесообразным проведение в качестве общепринятого исследования фармакогенетики варфарина, так как подбор дозы препарата не влияет на частоту кровотечений у больных, получающих варфарин [17, 18]. Тем не менее результаты ряда исследований [9, 19] указывают на то, что фармакогенетическое исследование обосновано при первичном назначении препарата, так как позволяет быстрее и эффективнее подобрать дозу варфарина, о чем свидетельствует более высокий показатель МНО в 1-й месяц лечения в группах больных, которым доза препарата подбиралась на основании фармакогенетического исследования.
Ограничениями нашего исследования являются небольшое число включенных пациентов, а также ретропроспективный анализ.
Ретропроспективное наблюдение за когортой больных, получающих варфарин, свидетельствует о несовпадении результатов шкал HAS-BLED и HEMORR2HAGES, касающихся доли больных с высоким риском кровотечений.
Высокий риск кровотечений, определенный на основе обеих шкал, ассоциируется лишь с большей частотой рецидивирующих кровотечений, возникающих уже после подбора терапевтической дозы варфарина. Разницы в кровотечениях, возникших на фоне передозировки варфарина в 1-й месяц лечения, в группах высокого и низкого риска не обнаружено.
У 75% больных с кровотечениями, возникшими на фоне передозировки варфарина в период подбора дозы, имелась генетически обусловленная гиперчувствительность к препарату.
Результаты нашего исследования подтверждают существующее мнение о том, что используемые шкалы далеки от совершенства, а высокий риск кровотечений определяет, прежде всего, необходимость тщательного учета и, по возможности, коррекции всех имеющихся факторов риска кровотечений и проведения тщательного патронажа за пациентами, получающими варфарин.



