Нарастание эпидемии ожирения, характерное для современной детской популяции, приводит к росту риска развития у них таких заболеваний, как гипертоническая болезнь (ГБ), сахарный диабет (СД) 2-го типа, гипоталамический синдром, метаболический синдром (МС) [1—5].
Согласно современным представлениям, риск развития сердечно-сосудистых нарушений, в том числе у детей и подростков с ожирением, в значительной степени обусловлен дисфункцией эндотелия сосудов (ДЭС) [5]. Эндотелий сосудов представляет собой целостную активную систему, реагирующую на различные метаболические, гемодинамические, химические, гормональные и другие нарушения и активно участвующую в поддержании гомеостаза в организме [5—7]. Положение клеток эндотелия на границе между циркулирующей кровью и тканями делает их наиболее уязвимыми для различных патогенных факторов, находящихся в системном и тканевом кровотоке. Под влиянием реактивных свободных радикалов, окисленных липопротеидов низкой плотности, гиперхолестеринемии, гипергликемии, высокого гидростатического давления внутри сосудов происходит повреждение эндотелия сосудов с формированием ДЭС и последующим развитием ангиопатий и атеросклероза [5].
В настоящее время обсуждаются две основные патогенетические теории возникновения ДЭС. Согласно первой, ДЭС рассматривается как первичный дефект, лежащий в основе развития таких осложнений ожирения, как инсулинорезистентность (ИР) при МС и нарушения эндотелийзависимой вазодилатации при артериальной гипертензии (АГ). Сторонники второй теории рассматривают ДЭС как следствие заболевания, возникающего в результате преждевременного старения кровеносных сосудов из-за хронического воздействия высокого артериального давления (АД) и/или метаболических агентов: гипергликемии, гиперхолестеринемии, дислипидемии и др. [5, 6]. Вполне вероятно, что у различных групп пациентов в зависимости от возраста, нозологии и длительности заболевания ведущее значение может иметь одна из патогенетических моделей развития ДЭС или их сочетание.
Особое значение для профилактической педиатрии имеют полученные в последнее время свидетельства обратимости ДЭС у детей при устранении или минимизации факторов риска или на фоне терапии ожирения [5, 8, 9]. Таким образом, очевидна необходимость дальнейшего изучения функции эндотелия сосудов у детей с ожирением, особенно подросткового возраста, для разработки дифференцированных профилактических мероприятий в зависимости от степени риска развития сердечно-сосудистых нарушений.

Цель настоящего исследования: оценить функцию эндотелия сосудов у подростков с ожирением и ее роль в формировании риска развития сердечно-сосудистых нарушений для совершенствования мероприятий по вторичной профилактике заболевания.
Материал и методы
Обследованы 68 подростков в возрасте 11—17 лет (37 мальчиков и 31 девочка) с диагнозом первичного экзогенно-конституционального ожирения по абдоминальному типу. Длительность прогрессивного увеличения массы тела у детей по данным анамнеза составила 6—11 лет, а избыток массы тела — от 26 до 86%. У всех детей избыточность массы тела была за счет жирового компонента. Половое развитие всех детей соответствовало возрастной норме: II—III степень по Таннеру [10]. У 33% подростков с ожирением диагностирован гипоталамический синдром, у 6 (8,8%) — МС с абдоминальным ожирением в сочетании с ИР, дислипидемией, АГ (критерии Международной диабетической федерации, 2007) [11].
Среди обследованных преобладали дети с ожирением II и III степени по Ю.А. Князеву [12] (табл. 1).
 Всем детям проведены антропометрия, взвешивание на весах Bodi Fat Analiser ВF-662W (Tanita Corporation, Japan) с расчетом индекса массы тела (ИМТ) и определением процентного содержания жировой массы. Оценку ИМТ проводили в соответствии с рекомендациями T.J. Cole [13], а процентное содержание жировой массы — по H.D. McCarthy [14]. Лабораторное тестирование включало определение уровня глюкозы в крови натощак, инсулина, общего белка, триглицеридов (ТГ), общего холестерина (ХС), ХС липопротеидов высокой плотности (ЛВП), ХС липопротеидов низкой плотности (ЛНП). Оценку ИР проводили на основании расчета индекса HOMA-R, за пороговое принимали значение 3,5 [15]. АД измеряли с помощью цифрового тонометра AND Medikal UA-787 по стандартной методике (ВОЗ, 1999) [16]. Суточное мониторирование АД (СМАД) проведено на приборе OXFORD MedilogHolter с компьютерной расшифровкой и оценкой в соответствии с рекомендациями Всероссийского научного общества кардиологов (2009) [17]. Оценку сосудодвигательной функции эндотелия проводили с помощью ультразвукового аппарата VIVID-3 линейным мультичастотным датчиком 7,0 МГц по методике D. Celermajere и соавт. [18]. Плечевую артерию (ПА) визуализировали в продольном сечении на 2—4 см проксимальнее локтевого сгиба. Первично диаметр ПА оценивали в покое после 10-минутного отдыха ребенка. Стимулом, вызывающим эндотелийзависимую дилатацию ПА, являлась реактивная гиперемия, создаваемая манжетой, в которой нагнеталось давление на 50 мм рт.ст. выше систолического артериального давления, определенного у ребенка перед началом обследования. Необходимое давление на ПА удерживалось в течение 5 мин. Повторно диаметр ПА оценивали после снятия манжеты через 90 с. Нормальной степенью прироста диаметра ПА в ответ на нагрузку считали увеличение диаметра артерии на 10% и более от исходного, что расценивалось как отрицательная эндотелиальная проба или отсутствие ДЭС. Меньшая степень вазодилатации или вазоконстрикция расценивалась как положительная эндотелиальная проба и трактовалась как патологическая реакция.
Всем детям проведены антропометрия, взвешивание на весах Bodi Fat Analiser ВF-662W (Tanita Corporation, Japan) с расчетом индекса массы тела (ИМТ) и определением процентного содержания жировой массы. Оценку ИМТ проводили в соответствии с рекомендациями T.J. Cole [13], а процентное содержание жировой массы — по H.D. McCarthy [14]. Лабораторное тестирование включало определение уровня глюкозы в крови натощак, инсулина, общего белка, триглицеридов (ТГ), общего холестерина (ХС), ХС липопротеидов высокой плотности (ЛВП), ХС липопротеидов низкой плотности (ЛНП). Оценку ИР проводили на основании расчета индекса HOMA-R, за пороговое принимали значение 3,5 [15]. АД измеряли с помощью цифрового тонометра AND Medikal UA-787 по стандартной методике (ВОЗ, 1999) [16]. Суточное мониторирование АД (СМАД) проведено на приборе OXFORD MedilogHolter с компьютерной расшифровкой и оценкой в соответствии с рекомендациями Всероссийского научного общества кардиологов (2009) [17]. Оценку сосудодвигательной функции эндотелия проводили с помощью ультразвукового аппарата VIVID-3 линейным мультичастотным датчиком 7,0 МГц по методике D. Celermajere и соавт. [18]. Плечевую артерию (ПА) визуализировали в продольном сечении на 2—4 см проксимальнее локтевого сгиба. Первично диаметр ПА оценивали в покое после 10-минутного отдыха ребенка. Стимулом, вызывающим эндотелийзависимую дилатацию ПА, являлась реактивная гиперемия, создаваемая манжетой, в которой нагнеталось давление на 50 мм рт.ст. выше систолического артериального давления, определенного у ребенка перед началом обследования. Необходимое давление на ПА удерживалось в течение 5 мин. Повторно диаметр ПА оценивали после снятия манжеты через 90 с. Нормальной степенью прироста диаметра ПА в ответ на нагрузку считали увеличение диаметра артерии на 10% и более от исходного, что расценивалось как отрицательная эндотелиальная проба или отсутствие ДЭС. Меньшая степень вазодилатации или вазоконстрикция расценивалась как положительная эндотелиальная проба и трактовалась как патологическая реакция.
Статистический анализ данных выполнен с использованием пакета прикладных программ Statistica 8.0. Результаты представлены в виде среднего значения и стандартного отклонения (М±σ). Характер распределения определяли с помощью критерия Колмогорова—Смирнова. Для сравнения величин при их нормальном распределении использовали t-критерий Стьюдента, при распределении, не являющемся нормальным, — непараметрический критерий Манна—Уитни. Сравнение групп по качественному признаку выполняли с помощью критерия χ2 Пирсона или точного критерия Фишера при малой численности сопоставляемых групп. Корреляционный анализ проводили с помощью коэффициента ранговой корреляции Спирмена (r). Различия считались статистически значимыми при p<0,05.
Результаты и обсуждение
Проведенное комплексное обследование позволило установить стабильную АГ у 37% больных ожирением детей; лабильная АГ отмечалась у 23%, у 40% детей АД соответствовало норме.
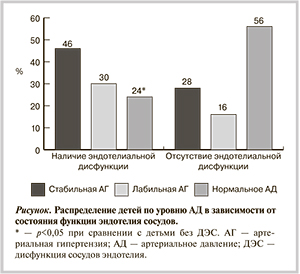
Известно, что ДЭС рассматривается как наиболее ранняя фаза повреждения сосудистой стенки, ранняя фаза развития атеросклероза и/или АГ [19]. Патологическая реакция сосудов выявлена нами у 45 (66%) подростков с ожирением. Причем нормальное АД у детей с ДЭС регистрировалось в 2,3 раза реже, чем у детей с нормальной функцией эндотелия (р<0,05), в то время как стабильная АГ наблюдалась в 1,5 раза чаще у детей с выявленной ДЭС, чем у детей с ожирением и с нормальной функцией эндотелия сосудов (см. рисунок). Лабильная АГ также чаще наблюдалась у детей с ДЭС (у 30 и 16% соответственно).
О более тяжелом течении заболевания у детей с ДЭС свидетельствовали бо'льшая распространенность у них гипоталамического синдрома (42% против 20% у детей с нормальной функцией эндотелия; р<0,04) и МС, который был диагностирован у 8,8% детей с ДЭС и не отмечался у детей с нормальной функцией эндотелия сосудов.
Наличие тесной взаимосвязи между метаболическими нарушениями и сердечно-сосудистыми заболеваниями в настоящее время не вызывает сомнения [19—21]. Такие показатели, как гипергликемия, гиперинсулинемия с развитием ИР рассматривают как факторы, способствующие патогенезу атеросклероза и АГ. Существует множество исследований, рассматривающих тонкие механизмы влияния гиперинсулинемии и ИР на уровень АД при посредничестве эндотелиальной выстилки сосудов. Полагают, что ДЭС играет ключевую роль в патогенезе АГ, связанной с метаболическими нарушениями [22, 23].
Для анализа причинно-следственных связей формирования ДЭС и АГ у подростков с ожирением нами проанализированы клинико-анамнестические и лабораторные данные детей с различным уровнем АД и функцией эндотелия. Было выделено 4 группы детей:
- I — со стабильной АГ и ДЭС (n=20 );
- II — со стабильной АГ и нормальной функцией эндотелия сосудов (n= 10);
- III — с нормальным или лабильным АД (лабильная АГ) и ДЭС (n=25);
- IV — с нормальным или лабильным АД (лабильная АГ) и нормальной функцией эндотелия сосудов (n= 13).
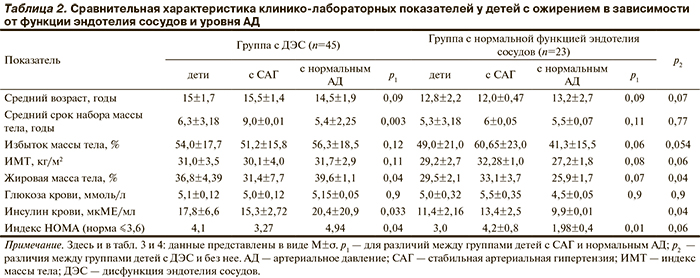
Анализ клинико-анамнестических особенностей течения заболевания в сравниваемых группах детей свидетельствовал о том, что дети с ДЭС имели тенденцию к более высокому показателю среднего возраста и более длительному сроку набора жировой массы по анамнезу заболевания (табл. 2).
Отягощенность наследственного анамнеза по ГБ у детей с ожирением с нарушенной и нормальной функцией эндотелия сосудов не имела существенных различий. Однако у детей со стабильной АГ и ДЭС в 30% случаев родители страдали ранней ГБ (до 40—45 лет), в отличие от наследственного анамнеза детей других групп наблюдения. Данная особенность свидетельствует о наследственном характере нарушения регуляции АД и возможной роли ДЭС как одного из наследуемых факторов, создающих предрасположенность к болезни [24]. Распространенность метаболических нарушений в семьях детей с ожирением также зависела от наличия у подростков ДЭС. У 63% подростков с ДЭС родственники страдали ожирением, 25% кровных родственников страдали СД 2-го типа. У подростков с нормальной функцией эндотелия ожирение выявлено только в 50% семей, а СД 2-го типа — только у 16% членов семей. Сопряженность избыточного отложения жировой массы и функции эндотелия сосудов доказывает полученная закономерность: у подростков с ДЭС процентное содержание жира в организме достоверно превышало аналогичный показатель у детей с нормальной функцией эндотелия сосудов: 36,8 и 29,5% соответственно (р<0,05) (см. табл. 2). Высокое содержание жировой ткани в организме детей с ДЭС сочеталось с высоким уровнем базального инсулина в крови. Установленная нами положительная корреляция между процентом жировой массы в организме и повышенным уровнем базального инсулина (r=0,37) подтверждает данные литературы о том, что количество инсулина в циркуляторном русле прямо пропорционально массе жировых отложений, а избыточная жировая ткань, обладая ауто-, пара- и эндокринной функцией и секретируя адипоцитокины, способна вызывать развитие такого осложнения ожирения, как ИР [25]. ИР установлена нами у 33% детей с ДЭС и отсутствовала у детей с нормальной функцией эндотелия. Формирование ИР является ключевым моментом в развитии метаболических нарушений при ожирении. Гиперинсулинемия способствует развитию дислипидемии, нарушению реологических свойств крови и формированию ДЭС [25], что при прогрессировании ожирения является морфолого-патогенетической основой для формирования атеросклеротической бляшки в сосуде.

Частота выявления лабораторных показателей крови, свидетельствующих о нарушении жирового и углеводного обмена (глюкоза, инсулин, ХС, ТГ), была достоверно выше у подростков с ДЭС, что подтверждает роль данных метаболитов в формировании ДЭС (табл. 3). Нами получена положительная корреляция между ДЭС и повышенными значениями перечисленных показателей (r=0,42; r=0,62; r=0,3; r=0,3 соответственно).
Особого внимания заслуживают дети с ДЭС, но без стабильной АГ. У этих детей имелись наибольшие показатели жировой массы в составе тела; 90% детей с диагностированным МС также были в этой группе. В 45% семей этих детей были больные СД 2-го типа. В группе детей с ДЭС и нормальным или лабильным АД обнаружены наиболее значительные метаболические изменения в крови: у 33% обнаружены высокие уровни глюкозы, ХС и ТГ, у 45% — высокий уровень инсулина (см. табл. 3).
В то же время в родословной у этих детей не было кровных родственников больных ГБ.
На основании изложенного можно предположить, что в этой группе детей ДЭС является следствием метаболических нарушений с риском развития атеросклероза, а затем и АГ. Первоочередное мероприятие профилактики прогрессирования заболевания у таких детей заключается в нормализации обмена веществ со снижением уровня ИР.
У 28,5% детей с ожирением при нормальной функции эндотелия была диагностирована стабильная АГ. У этих детей имелся выраженный избыток общей массы тела (60,65%) (см. табл. 2). У каждого пятого подростка определялся повышенный уровень базального инсулина, а у каждого третьего — снижение уровня ХС ЛВП (см. табл. 3). Таким образом, при прогрессировании заболевания такие дети имеют высокий риск прогрессирования метаболических нарушений и развития осложнений (гипоталамический синдром, МС) с последующим повреждающим воздействием на стенку сосуда.
У подростков с ожирением, у которых отсутствует стабильная АГ и ДЭС, практически не регистрируются изменения лабораторных показателей (см. табл. 2, 3), а риск развития атеросклероза и АГ минимален по сравнению с другими сравниваемыми группами детей.
Наличие и выраженность начальных проявлений атеросклероза и состояние сосудистой стенки оценивались при проведении эндотелиальной пробы с реактивной гиперемией (табл. 4). Различий в исходном диаметре ПА у детей с ожирением при наличии или в отсутствие ДЭС не зафиксировано. Однако у подростков с ДЭС и стабильной АГ исходный диаметр сосуда существенно превышал таковой у детей без АГ, что может свидетельствовать об изменениях сосудистой стенки у этих детей, вероятно, вследствие утолщения средней оболочки сосудистой стенки с уменьшением просвета сосуда [21].
У подростков с установленной ДЭС отмечена достоверно более низкая начальная скорость кровотока в ПА по сравнению с таковой у детей без нарушения функции эндотелия (см. табл. 4). Снижение скорости кровотока у таких детей может быть следствием изменения реологических свойств крови из-за высокой концентрации метаболитов в сосудистом русле, повышенный уровень которых зафиксирован в этой группе (см. табл. 3). В настоящее время получены данные о том, что при МС в результате гликирования белков возникают нарушения реологических параметров крови: снижение эластичности и подвижности эритроцитов, повышение агрегационной активности тромбоцитов и вязкости крови за счет гипергликемии и дислипидемии, что влияет на скорость кровотока. Измененные реологические свойства крови способствуют росту общего периферического сопротивления на уровне микроциркуляции и в сочетании с симпатикотонией, развивающейся при МС, лежат в основе генеза АГ [26].

О наличии выраженных нарушений функции эндотелия у детей с ДЭС свидетельствовали результаты пробы с реактивной гиперемией: получены достоверные различия по диаметру сосуда и его приросту на высоте пробы у детей с ДЭС по сравнению с таковой у подростков с нормальной функцией эндотелия (см. табл. 4). Особенно выраженные изменения указанных параметров мы наблюдали у детей с резкими метаболическими нарушениями: дети с ДЭС и нормальным АД. В то же время стабильная АГ даже при нормальной функции эндотелия сосудов сопровождается снижением эластичности сосудистой стенки, о чем свидетельствовали достоверно меньший диаметр и процент прироста диаметра ПА при проведении пробы с реактивной гиперемией (см. табл. 4). Полученные результаты позволяют отнести детей с ожирением и АГ даже при нормальной функции эндотелия в группу высокого риска нарушения его функции при прогрессировании заболевания.
Выводы
Ожирение у подростков, сопровождавшееся нарушенной функцией эндотелия сосудов, характеризовалось более тяжелым течением, свидетельством чего были высокая жировая масса тела (36,8±4,39%) и частота выявления гипоталамического (42%) и метаболического (8,8%) синдромов.
Формирование дисфункции эндотелия сосудов у подростков с ожирением в значительной степени определяется метаболическими нарушениями (гиперинсулинемией, дислипидемией).
Стабильная артериальная гипертензия, выявленная у 37% подростков с ожирением, в 1,5 раза чаще регистрировалась у детей с дисфункцией эндотелия сосудов.
В ходе обследования и динамического наблюдения детей с ожирением в качестве дополнительного обследования целесообразно проводить эндотелиальную пробу с реактивной гиперемией, при положительном результате которой следует констатировать высокий риск развития атеросклероза и/или артериальной гипертензии и проводить дифференцированные лечебно-профилактические мероприятия, направленные на нормализацию не только уровня артериального давления и обмена веществ, но и функции эндотелия.



