В пожилом возрасте, в отличие от более молодого возраста, хроническая сердечная недостаточность (ХСН) редко встречается в виде изолированного заболевания. Хронические заболевания легких и почек, патология опорно-двигательного аппарата, сахарный диабет (СД) часто наблюдаются у больных с ХСН в этом возрасте и неблагоприятно влияют на течение заболевания [1]. Среди сопутствующих заболеваний особый интерес представляет анемия, распространенность которой при ХСН колеблется от 4 до 61%, что зависит от критериев ее определения и исследуемой популяции [2, 3].
У пожилых людей имеется высокий риск развития анемии из-за сопутствующих заболеваний (хроническая почечная недостаточность, онкологические заболевания), неадекватного приема железа, витамина В12, фолатов и препаратов, вызывающих хроническую кровопотерю. Ряд исследователей представили данные о неблагоприятном влиянии анемии не только на течение, но и на прогноз больных с ХСН [4, 5].
 При ХСН наиболее частой причиной формирования анемии является почечная недостаточность, хотя нередко встречаются больные с ХСН и анемией, но без наличия почечной дисфункции. Сама ХСН может быть причиной развития почечной недостаточности, и более чем у 60% больных с этим заболеванием среднетяжелого и тяжелого течения имеется ХСН [6].
При ХСН наиболее частой причиной формирования анемии является почечная недостаточность, хотя нередко встречаются больные с ХСН и анемией, но без наличия почечной дисфункции. Сама ХСН может быть причиной развития почечной недостаточности, и более чем у 60% больных с этим заболеванием среднетяжелого и тяжелого течения имеется ХСН [6].
Представляет интерес вопрос о влиянии изолированной анемии легкой степени и ее сочетания с почечной дисфункцией на течение ХСН и прогноз у пожилых больных, наблюдающихся на догоспитальном этапе, поскольку ряд вопросов, касающихся анемии у больных этой категории, носит неоднозначный характер и нуждается в дальнейшем изучении.
Цель исследования: определение роли анемии в течении ХСН у лиц пожилого возраста, наблюдавшихся в поликлинических условиях.
Материал и методы
В открытое проспективное исследование были включены 164 больных с ХСН II—IV функционального класса (ФК) по классификации NYHA (II ФК ХСН — 36,7%, III ФК ХСН — 45,6%, IV ФК — 17,7%) вследствие ишемической болезни сердца (ИБС) и артериальной гипертонии (АГ). Возраст больных составил 68 (65—73) лет. Критерии включения в исследование: женщины и мужчины в возрасте 60 лет и старше; стабильное течение ХСН (отсутствие госпитализаций по поводу декомпенсации ХСН в течение предшествующих 3 мес); добровольное согласие на участие в исследовании. Критерии исключения: нестабильная стенокардия и инфаркт миокарда в течение 3 мес перед исследованием; хронические заболевания (в том числе желудочно-кишечного тракта) в фазе обострения.
Диагноз ХСН в соответствии с Российскими национальными рекомендациями ВНОК и ОССН по диагностике и лечению ХСН подтверждался наличием симптомов и/или клинических признаков сердечной недостаточности (в покое или при физической нагрузке), объективными признаками дисфункции сердца (в покое), положительным ответом на терапию. Наличие 1 и 2 признаков являлось обязательным у всех больных.
Объективизация ФК ХСН проводилась с помощью Шкалы оценки клинического состояния (ШОКС) [7] и теста с 6-минутной ходьбой (ТШХ). Концентрацию креатинина, мочевины у больных определяли одновременно в крови методом спектрометрии на анализаторе Beckman Coulter AU 5800 («Olympus»). Тем же методом определяли содержание железа в сыворотке крови. Скорость клубочковой фильтрации (СКФ) почек рассчитывали по формуле MDRD [8]. Фотометрическим методом определяли уровень гемоглобина на анализаторе Beckman Coulter UniCel DxH 800 («Olympus») и на основе гистограммы производили расчетные показателей: средняя концентрация гемоглобина в эритроците (ССГ), средний объем клетки (СОК). Содержание витамина В12, фолиевой кислоты и ферритина в сыворотке определяли хемилюминесцентным методом на анализаторе Beckman Coulter UniCel DxI 800.
 Насыщение трансферрина железом (Tsat) определяли следующим образом: (железо сыворотки/ОЖСС)·100%, при ОЖСС = трансферрин · 20, где ОЖСС — общая железо-связывающая способность сыворотки. О дефиците железа судили по уровню ферритина менее 12 мкг/л у женщин и менее 20 мкг/л у мужчин или при Тsat <15%. Хроническую болезнь почек (ХБП) диагностировали при уровне СКФ ниже 60 мл/мин/1,73 м2 [9].
Насыщение трансферрина железом (Tsat) определяли следующим образом: (железо сыворотки/ОЖСС)·100%, при ОЖСС = трансферрин · 20, где ОЖСС — общая железо-связывающая способность сыворотки. О дефиците железа судили по уровню ферритина менее 12 мкг/л у женщин и менее 20 мкг/л у мужчин или при Тsat <15%. Хроническую болезнь почек (ХБП) диагностировали при уровне СКФ ниже 60 мл/мин/1,73 м2 [9].
Всем больным выполняли эхокардиографию (ЭхоКГ) в одномерном (М-режиме), двухмерном (В-режиме) и допплеровских режимах (импульсно-волновом и постоянно-волновом). Фракцию выброса (ФВ) левого желудочка (ЛЖ) определяли методом Симпсона. ХСН со сниженной ФВ ЛЖ констатировали при ФВ ЛЖ ≤45%, с сохраненной — при ФВ ЛЖ >45%.
Больные получали терапию в соответствии с Национальными рекомендациями по диагностике и лечению ХСН, а также в зависимости от характера анемии получали препараты железа, фолиевой кислоты перорально и витамин В12 — парентерально в терапевтических дозах.
Обследование и наблюдение больных проводилось в ГУЗ г. Москвы «Диагностический клинический центр № 1 УЗ ЮЗАО» от момента включения (январь 2005 г. — август 2009 г.) до завершения исследования в январе 2013 г. Период наблюдения длился от 6 мес до 8 лет и составил 1,85 (1,0—4,75) года. За время наблюдения регистрировали летальный исход по поводу сердечно-сосудистой причины и других причин.
Статистическую обработку данных проводили с использованием пакетов программ SPSS 16.0 и Statistica 6.0. Данные проверяли на нормальность распределения и представляли в виде медианы (Me) и 25-го и 75-го перцентилей. При сравнении двух независимых величин применяли ранговый критерий U Манна—Уитни. Для исследования взаимосвязи между непрерывными показателями применяли коэффициент ранговой корреляции Спирмена. Связь возможных факторов риска с неблагоприятным исходом оценивали в модели пропорционального риска Кокса. Многофакторному анализу предшествовал однофакторный. В многофакторный регрессионный анализ включали переменные, для которых значения критерия статистической значимости при однофакторном анализе составляли р<0,1, а также признаки, которые могли быть связаны с изучаемым исходом по данным предшествующих исследований. Многофакторный регрессионный анализ выполняли пошаговым методом. При этом первоначально выделяли признак, наиболее тесно связанный с изучаемым исходом. Последующие переменные включали только в случае, если их добавление к уже отобранным факторам демонстрировало значимость вклада на уровне α≤0,1. Различие считали статистически значимыми при p<0,05.
Результаты
Анемия выявлялась у 54 из 164 (32,9%) больных пожилого возраста, находившихся под нашим наблюдением. В целом по группе уровень гемоглобина и эритроцитов составил 13,7 (12,9—14,6) г/дл и 4,6 (4,3—5,0) млн/мл; у больных с анемией — 12,3 (11,9—12,9) г/дл и 4,3 (4,0—4,5) млн/мл; без анемии — 14,2 (13,7—15,0) г/дл и 4,8 (4,5—5,0) млн/мл, соответственно (р<0,001).
У всех больных анемия была легкой степени тяжести (Hb >9 г/дл). Распределение значения гемоглобина у наблюдавшихся больных представлено в табл. 1.
Согласно классификации по морфологии клетки (нормоцитарная анемия — средний объем клетки, СОК 80—95 фл, микроцитарная — СОК <80 фл, макроцитарная — СОК >95 фл), у 63% больных имелась нормоцитарная анемия. Микроцитарная (17%) и макроцитарная анемии (20%) встречались гораздо реже. Дефицит железа выявлен у 17 (31,5%) больных, витамина В12 — у 20,7%, фолатов — у 22%.
Характеристика наблюдавшихся больных представлена в табл. 2.
 По сравнению с больными без анемии больные с анемией были старше, имели более низкий индекс массы тела (ИМТ), у них чаще встречались нарушенная функция почек и СД. По сравнению с больными с нормальным уровнем гемоглобина у больных с анемией наблюдали более тяжелое течение сердечной недостаточности по ШОКС (р=0,004; ОШ 1,17 при 95% ДИ от 1,05 до 1,31) с выраженной одышкой (р=0,023; ОШ 2,25 при 95% ДИ от 1,12 до 4,50) и периферическими отеками (р=0,007; ОШ 2,24 при 95% ДИ от 1,24 до 4,05). Помимо этого, по данным однофакторного регрессионного анализа, анемия ассоциировала с СД (р=0,041; ОШ 2,2 при 95% ДИ от 1,03 до 4,69), повышенным уровнем креатинина (р=0,012; ОШ 2,76 при 95% ДИ от 1,25 до 6,12) и ХБП (р<0,001; ОШ 5,66 при 95% ДИ от 2,51 до 12,77).
По сравнению с больными без анемии больные с анемией были старше, имели более низкий индекс массы тела (ИМТ), у них чаще встречались нарушенная функция почек и СД. По сравнению с больными с нормальным уровнем гемоглобина у больных с анемией наблюдали более тяжелое течение сердечной недостаточности по ШОКС (р=0,004; ОШ 1,17 при 95% ДИ от 1,05 до 1,31) с выраженной одышкой (р=0,023; ОШ 2,25 при 95% ДИ от 1,12 до 4,50) и периферическими отеками (р=0,007; ОШ 2,24 при 95% ДИ от 1,24 до 4,05). Помимо этого, по данным однофакторного регрессионного анализа, анемия ассоциировала с СД (р=0,041; ОШ 2,2 при 95% ДИ от 1,03 до 4,69), повышенным уровнем креатинина (р=0,012; ОШ 2,76 при 95% ДИ от 1,25 до 6,12) и ХБП (р<0,001; ОШ 5,66 при 95% ДИ от 2,51 до 12,77).
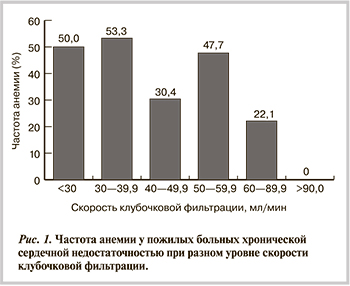
Кардиоренальный анемический синдром — КРАС (наличие анемии и СКФ <60 мл/мин) определялся у 38 (23,2%) из 164 больных — у 21 (20,6%) мужчины и у 17 (27,4%) женщин (р=0,315). Необходимо отметить, что вероятность развития КРАС у пожилых больных с ХСН увеличивалась при уровне гемоглобина 12 г/дл и менее и СКФ 49 мл/мин и менее (р=0,009; ОШ 5,32 при 95% ДИ от 1,53 до 18,54). Частота развития анемии у пожилых больных с ХСН при разном уровне СКФ представлена на рис. 1.
За период наблюдения умерли 15 из 54 (27,8%) больных с анемией и 33 из 110 (30%) — без анемии (р=0,768). Выживаемость больных, независимо от наличия или отсутствия анемии, оказалась одинаковой (рис. 2). Причинами летального исхода у 7 больных с анемией был острый инфаркт миокарда (ОИМ), у 2 — острая сердечная недостаточность (ОСН), у 2 — декомпенсация ХСН, у 3 — нарушение ритма сердца, у 1 — несердечная причина. ОИМ был причиной летального исхода у 17, ОСН — у 6, декомпенсация ХСН — у 5, нарушение ритма сердца — у 2, несердечные причины — у 3 больных без анемии.
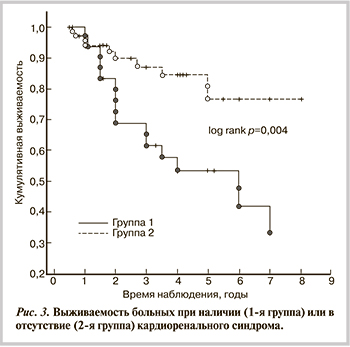
Отмечена более низкая выживаемость больных при наличии у них КРАС по сравнению с больными ХСН того же возраста, но с сохраненной функцией почек и без анемии (рис. 3). Среди больных с КРАС умерли 15 из 38 (39,5%), без КРАС — 11 из 67 (16,4%; р=0,009). Причинами летального исхода у 7 больных с КРАС был ОИМ, у 2 — ОСН, у 2 — декомпенсация ХСН, у 3 — нарушение ритма сердца, у 1 — несердечная причина.
По данным многофакторного регрессионного анализа, возраст старше 75 лет (р=0,002; ОШ 3,58 при 95% ДИ от 1,59 до 7,99), СД (р=0,018; ОШ 2,68 при 95% ДИ от 1,19 до 6,04), наличие в анамнезе ИМ (р=0,013; ОШ 2,7 при 95% ДИ от 1,24 до 6,04), систолическое АД менее 110 мм рт.ст. (р=0,030; ОШ 2,49 при 95% ДИ от 1,09 до 5,71), полная блокада левой ножки пучка Гиса — БЛНПГ (р=0,012; ОШ 2,79 при 95% ДИ от 1,26 до 8,22), уровень креатинина более 130 мкмоль/л (р=0,004; ОШ 3,53 при 95% ДИ от 1,51 до 8,22) независимо ассоциировали с неблагоприятным исходом у пожилых больных с ХСН и КРАС.
Обсуждение
В настоящее время не существует единогласно принятого уровня гемоглобина, ниже которого можно ставить диагноз анемии, осложняющей течение ХСН. Рационально определять анемию при концентрации гемоглобина менее общепринятого в популяции на 5% [10]. Всемирная организация здравоохранения (2001) рекомендует для постановки диагноза «анемия» в общей популяции использовать уровень гемоглобина 13,0 г/дл и ниже у мужчин и 12,0 г/дл и ниже — у женщин, который является также диагностическим критерием диагноза «анемия», осложнившей течение ХСН. Согласно этим критериям, анемия выявлялась у 32,9% больных пожилого возраста с ХСН, находившихся под нашим наблюдением, что соответствует существующим представлениям о распространенности анемии среди больных с ХСН [11, 12].
У всех больных анемия была легкого течения и в большинстве случаев нормоцитарная. Дефицит железа, витамина В12 и фолатов встречался у 31,5, 20,7 и у 22% больных соответственно, что также согласуется с большинством ранее опубликованных данных по характеру анемии при ХСН [13—15].
КРАС определялся у 23,2% больных. Вероятность его развития повышалась более чем в 5 раз (ОШ 5,32) при уровне гемоглобина 12 г/дл и менее и СКФ 49 мл/мин и менее. Комплексное взаимодействие анемии, нарушенной функции почек и ХСН не вызывает сомнений. Сердечная недостаточность способствует гипоперфузии почек, ренальной вазоконстрикции, перераспределению кровотока в почках, что приводит к нарушению их функции [16, 17].
Анемия, развивающаяся у больных с ХСН и сниженной функцией почек, определяется дефицитом продукции эритропоэтина вследствие необратимого уменьшения массы функционирующей почечной ткани или ее относительной ишемии из-за снижения сердечного выброса. Данное взаимодействие представляет собой патофизиологическую основу для существования кардиоренального клинического синдрома [18]. Данный синдром был предложен для описания формирования и прогрессирования почечной недостаточности вторично на фоне ХСН, но этот термин также используется для определения негативных воздействий сниженной функции почек на сердечно-сосудистую систему [19].
Эритропоэтин продуцируется периканальцевыми фибробластами коркового вещества почек в ответ на локальную тканевую гипоксию и является основным регулятором продукции эритроцитов, поскольку контролирует пролиферацию и дифференцировку эритроидных предшественников. Потенциальными благоприятными эффектами действия эритропоэтина являются повышение уровня гемоглобина, замедление апоптоза, мобилизация клеток-предшественников из костного мозга, усиление неоангиогенеза, уменьшение ишемии миокарда за счет улучшения реперфузии. По мере прогрессирования почечной недостаточности структуры, продуцирующие эритропоэтин, замещаются фиброзной тканью, что сопровождается утратой ими гормонпродуцирующих качеств. В результате гипоперфузии почек нарастает ишемия эндотелиоцитов перитубулярных капилляров и фибробластов, локализующихся в тубулоинтерстиции, и уменьшается продукция эритропоэтина. С момента возникновения анемии происходит ремоделирование сердца, чему способствуют повышенная активность как симпатической части вегетативной нервной системы, так и ренин-ангиотензин-альдостероновой системы. Процесс ремоделирования ЛЖ ведет к гибели кардиомиоцитов путем апоптоза и некроза, кардиальному фиброзу, миокардиопатии и формированию ХСН.
 Подавление костномозговой функции с формированием анемии при ХСН может реализоваться и через воспалительные реакции, поскольку при данном заболевании повышается уровень провоспалительных цитокинов, в частности, α-фактора некроза опухоли. Последний способствует уменьшению синтеза эритропоэтина почками, снижению его активности в костном мозге и замедлению высвобождения железа из ретикуло-эндотелиальной системы [20—22].
Подавление костномозговой функции с формированием анемии при ХСН может реализоваться и через воспалительные реакции, поскольку при данном заболевании повышается уровень провоспалительных цитокинов, в частности, α-фактора некроза опухоли. Последний способствует уменьшению синтеза эритропоэтина почками, снижению его активности в костном мозге и замедлению высвобождения железа из ретикуло-эндотелиальной системы [20—22].
Прогноз у больных с ХСН остается одним из самых неблагоприятных, несмотря на существенные изменения в технологии лечения сердечной недостаточности. С момента постановки диагноза ХСН врачу необходимо оценить ряд прогностических факторов у каждого больного: возраст и пол; сопутствующие заболевания; тяжесть и причину (например, ишемическую) сердечной недостаточности. Кроме того, оцениваются функциональные (функциональный класс по классификации NYHA, ТШХ, ФВ ЛЖ) и лабораторные показатели (уровни натрийуретического пептида, холестерина, креатинина, гемоглобина и др.) [23]. К сопутствующим заболеваниям, неблагоприятно влияющим на прогноз у больных с ХСН, особенно в пожилом возрасте, относятся дисфункция почек и анемия. Показано, что дисфункция почек встречается почти у 50% больных с сердечной недостаточностью, а с возрастом ее частота неуклонно возрастает [24, 25]. Помимо этого, больные с ХСН и хронической почечной недостаточностью имеют очень высокий риск летального исхода. Смертность таких больных может достигать 28% в течение 6 мес от момента декомпенсации ХСН и ухудшения функции почек [26].
Согласно нашим данным, выживаемость больных с ХСН, имевших и не имевших анемический синдром, была одинаковой, что, по нашему мнению, объясняется нетяжелым течением анемии. Однако при КРАС выживаемость больных была ниже, чем у больных с сохраненной функцией почек и без анемии. Аналогичные данные представлены в работе K. Lu и соавт. [27], согласно которым КРАС выявлялся у 30% амбулаторных больных с ХСН и был определен как предиктор летального исхода.
Полученные нами результаты показали, что возраст (ОШ 3,58), СД (ОШ 2,68), перенесенный ИМ (ОШ 2,7), низкое систолическое артериальное давление (ОШ 2,49), БЛНПГ (ОШ 2,79) и повышенный уровень креатинина (ОШ 3,53) предопределяли более тяжелое течение заболевания и оказались предикторами летального исхода у больных с сердечной недостаточностью и сопутствующим КРАС. Возраст больных, перенесенный ИМ, БЛНПГ являются установленными факторами неблагоприятного исхода у этой категории больных [28—30]. Роль повышенного уровня креатинина и низкого артериального давления в качестве независимых факторов летального исхода у больных с ХСН также показана во многих работах [31—34].
Таким образом, в свете современной проблемы ХСН и анемии приобретает важность мультидисциплинарное взаимодействие в диагностике и лечении больных с КРАС. В рамках этой программы следует уделять пристальное внимание контролю течения анемии, АГ и ИБС у таких больных. Со своей стороны, кардиологам необходимо применять индивидуальный интенсивный подход к больным с ХСН, назначая максимально рекомендуемые дозы препаратов. Результатом такого сотрудничества будет существенное улучшение самочувствия, качества жизни и прогноза у больных с ХСН.
Заключение
Анемия выявлялась у 32,9% больных пожилого возраста с хронической сердечной недостаточностью, находившихся на догоспитальном этапе наблюдения. Кардиоренальный анемический синдром встречался у 23,2% больных, а вероятность его увеличивалась при снижении уровня гемоглобина 12 г/дл и менее и скорости клубочковой фильтрации 49 мл/мин и менее (отношение шансов 5,32). Выживаемость больных с хронической сердечной недостаточностью, имевших и не имевших анемический синдром, не отличалась, однако при наличии кардиоренального анемического синдрома выживаемость была ниже, чем при сохраненной функции почек и в отсутствие анемии. Возраст старше 75 лет, сахарный диабет, перенесенный инфаркт миокарда, низкое систолическое артериальное давление, блокада левой ножки пучка Гиса и повышенный уровень креатинина в крови влияли на летальность пожилых больных с хронической сердечной недостаточностью, анемией и сниженной функцией почек.
Ограничения. Ограничением нашего исследования является небольшое число больных с хронической сердечной недостаточностью и анемией, что необходимо принимать во внимание при интерпретации результатов. К тому же, мы не анализировали группы больных с анемией и без нее в зависимости от фракции выброса левого желудочка (сохраненная и сниженная).
Конфликт интересов не заявляется.



