Несмотря на значительный прогресс в области экспериментальных и клинических исследований, проблема развития острого инфаркта миокарда (ИМ) продолжает оставаться актуальной. Известно, что тяжесть повреждения миокарда при его ишемии зависит, в том числе от степени накопления норадреналина в интерстициальном пространстве миокарда [1]. Одной из причин выраженного повышения уровня норадреналина в интерстициальном пространстве миокарда является реверсия в условиях ишемии нормального механизма его обратного захвата. Показано, что в условиях ишемии белок (транспортер норадреналина) не захватывает норадреналин, выделившийся в интерстициальное пространство, а активно эвакуирует его из симпатических нервных окончаний [2].
Попытка предотвратить накопление норадреналина в интерстициальном пространстве с помощью блокатора его обратного захвата до начала ишемии оказалась успешной, и величина инфаркта уменьшалась [3]. Однако до настоящего времени остается неясным, как будет влиять на величину ИМ блокада обратного захвата норадреналина (ОЗН) в период реперфузии, когда восстанавливается нормальное функционирование механизма обратного захвата норадреналина.
Цель исследования: изучить влияние блокады ОЗН в реперфузионном периоде на величину инфаркта при локальной ишемии миокарда в условиях ишемического пре- и посткондиционирования.
Материал и методы
Работа выполнена на 46 крысах-самцах Вистар со средней массой тела 355,2±14,8 г, содержавшихся в обычных условиях вивария. Эксперименты проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. №755).
Животным под уретановым наркозом (2,1±0,07 мг/кг внутрибрюшинно) выполняли трахеотомию. Искусственную вентиляцию легких осуществляли при помощи аппарата Model 683 («Harvard Apparatus», США) смесью воздуха с 20% кислорода. В течение эксперимента контролировали электрокардиограмму. Температуру тела крысы, измеряемую в прямой кишке, поддерживали путем подогрева операционного стола. Левостороннюю торакотомию выполняли в пятом межреберье. После рассечения перикарда с помощью нейлоновой нити формировали петлю вокруг левой коронарной артерии на расстоянии 1—2 мм ниже ушка левого предсердия. Оба конца петли вводили в отверстия пластикового окклюдера.
 Протокол эксперимента. Животные были случайным образом разделены на 6 групп. В 1-й группе (n=7) осуществляли окклюзию (30 мин) и реперфузию (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
Протокол эксперимента. Животные были случайным образом разделены на 6 групп. В 1-й группе (n=7) осуществляли окклюзию (30 мин) и реперфузию (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
Во 2-й группе (n=7) выполняли то же, что и в 1-й, но в начале реперфузии животным вводили дезипрамин (0,8 мг/кг) — неселективный ингибитор обратного захвата норадреналина.
В 3-й группе (n=6) выполняли ишемическое прекондиционирование тремя 3-минутными окклюзиями, разделенными 3-минутными периодами реперфузии. После этого осуществляли окклюзию (30 мин) и реперфузию (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
В 4-й группе (n=7) выполняли то же, что и в 3-й, но в начале реперфузии животным вводили дезипрамин (0,8 мг/кг).
В 5-й группе (n=9) через 10 с после 30-минутной окклюзии выполняли ишемическое посткондиционирование шестью 10-секундными окклюзиями, разделенными 10-секундными периодами реперфузии. Затем следовала реперфузия (120 мин). В начале реперфузии вводили 1 мл раствора Рингера внутривенно.
В 6-й группе (n=10) выполняли то же, что и в 3-й, но в начале реперфузии животным вводили дезипрамин (0,8 мг/кг).
Микродиализ. В 1—4-й группах в зону ишемии, которая обнаруживалась по обесцвечиванию ткани миокарда при кратковременном затягивании нитей окклюдера, вживляли диализный зонд. В экспериментах использовали линейные микродиализные зонды на базе полиакрилнитриловой мембраны («CGH Medical Inc.», «Lakewood», США) длиной 6 мм с внешним диаметром около 300 мкм и критической массой пропускания 29 000 дальтон. С обеих сторон к мембране приклеивали входной и выходной полиимидные капилляры с внутренним диаметром около 150 мкм («Microlumen», США). Для уменьшения «мертвого объема» и обеспечения прочности и несминаемости мембраны внутрь зонда вставляли нейлоновое волокно диаметром 70 мкм. Подачу перфузата осуществляли насосом MD-1001 («BAS», США) со скоростью 2 мкл/мин.
Аналитическая процедура. Норадреналин диализата определяли при помощи жидкостной хроматографии высокого разрешения с электрохимической детекцией. Система состояла из насоса Shimadzu LC-10ADvp, инжектора Rheodyne 9125 с петлей 10 мкл и колонки Hypersil (C18,2×150 мм, 5 мкм). Скорость подачи элюента составляла 0,07—0,1 мл/мин. Электрохимическое детектирование осуществляли сдвоенным электродом с диаметром стеклоуглеродных пластин 3 мм (CC-5) и контроллерами LC-4B. Потенциалы верхнего и нижнего по течению элюента электродов устанавливали соответственно +0,6 и +0,02 В относительно референтного электрода Ag/AgCl. Хроматограммы накапливали и обрабатывали при помощи системы Мультихром. Анализ концентрации норадреналина в большинстве экспериментов выполняли по показаниям второго, более устойчивого к загрязнениям электрода.
Подвижная фаза состояла из 0,05 М одноосновного фосфата натрия, 0,05 М лимонной кислоты, 80 мг EDTA и 500 мг октилсульфоната натрия на 1 л при рH 5,6 устанавливаемом при помощи 6 M NaOH. Подвижную фазу фильтровали через нейлоновые фильтры 0,2 мкм и дегазировали вакуумом. Метанол, дополнительно дистиллированный, добавляли до концентрации 12% (v/v). Сквозная чувствительность системы была на уровне 0,5 пикограмма норадреналина в 10 мкл образце (отношение сигнал/шум 3:1).
Сбор (10-минутные интервалы) образцов диализата для определения норадреналина в интерстициальном пространстве миокарда начинали не ранее чем через 30 мин после вживления. Содержание норадреналина в диализате в реперфузионном периоде представлено как отношение (%) к содержанию норадреналина на 30-й минуте окклюзии.
После окончания эксперимента для определения перфузируемой зоны (зоны риска) вновь окклюзировали коронарную артерию и внутривенно вводили 4 мл 2% раствора Эванса синего. Раствор Эванса синий окрашивает только перфузируемый миокард, а неперфузируемый остается неокрашенным. Животное забивали сверхдозой анестетика, сердце извлекали и иссекали область зоны риска (неокрашенный участок левого желудочка). После этого область зоны риска рассекали на слои толщиной около 1 мм и эти пластины инкубировали при температуре 37 °С в течение 20 мин в 1% растворе трифенилтетразолия. В этих условиях интактный миокард окрашивается в красный цвет, а зона инфаркта остается неокрашенной. После инкубации полоски миокарда сканировали и рассчитывали отношение площади инфаркта ко всей зоне риска.
Статистическую обработку результатов исследования проводили с помощью программы Ststistica 8.
При анализе данных использовали критерий Манна—Уитни. Данные представлены в виде среднего значения и его ошибки (М±m). Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
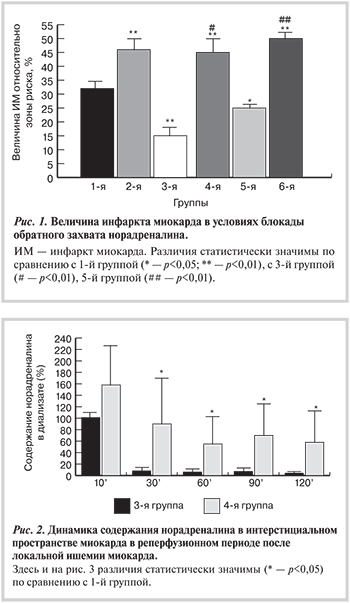
После 30-минутной ишемии и 120- минутной реперфузии у животных 1-й (контрольной) группы величина зоны ИМ составила 32,0±3,1% зоны риска (рис. 1). У животных 2-й группы, которым вводили дезипрамин, размер инфарктной зоны увеличивался до 46,1±3,4% (р=0,006).
Ишемическое прекондиционирование (3-я группа) приводило к уменьшению зоны инфаркта до 15,3±3,1% (р=0,008 по сравнению с 1-й группой). У животных с ишемическим прекондиционированием и введением дезипрамина в реперфузионном периоде размер ИМ увеличивался до 44,7±4,7% (р=0,0027 по сравнению с 3-й группой) и не отличался от такового у животных 2-й группы (p>0,05).
Ишемическое посткондиционирование (5-я группа) приводило к уменьшению зоны инфаркта до 22,2±2,6% (р=0,028 по сравнению с 1-й группой). У животных с ишемическим посткондиционированием и введением дезипрамина в реперфузионном периоде (6-я группа) размер ИМ увеличивался до 50,3±3,1% (р=0,018 по сравнению с 5-й группой), существенно не отличаясь от такового у животных 2-й группы (p>0,05).
Анализ содержания норадреналина в диализате на протяжении реперфузионного периода продемонстрировал различие в его динамике в 1-й и 2-й группах (рис. 2). В контрольной группе (1-я группа) содержание норадреналина в диализате после прекращения окклюзии быстро снижалось, так что уже к 30-й минуте реперфузии было существенно ниже окклюзионного уровня. В экспериментальной группе содержание норадреналина в диализате не уменьшалось практически на протяжении всего периода реперфузии.
В 3-й и 4-й группах отмечалась схожая динамика. В группе с ишемическим прекондиционированием (3-я группа) во время реперфузии содержание норадреналина в диализате снижалось, тогда как в 4-й группе оставалось на повышенном уровне (рис. 3).
Известно, что в условиях ишемии происходит массивный выброс норадреналина в интерстициальное пространство миокарда из симпатических нервных окончаний [4]. Характерной особенностью накопления норадреналина в интерстициальном пространстве является его этапный характер. В начале ишемии повышение уровня норадреналина обусловлено экзоцитозом и ограничивается обратным захватом. Через 20 мин ишемии наступает реверсия механизма ОЗН, что ведет к дальнейшему быстрому и значительному увеличению содержания норадреналина в интерстициальном пространстве миокарда [2].
Существенное повышение содержания норадреналина в интерстициальном пространстве миокарда является одним из факторов, дозозависимо усугубляющих его повреждение [1].
 Таким образом, предотвращение накопления норадреналина в интерстициальном пространстве во время ишемии могло бы способствовать уменьшению повреждения миокарда. Действительно, было показано, что введение блокатора ОЗН дезипрамина до начала ишемии способствует уменьшению размера ИМ. Этот благоприятный эффект авторы связывали со снижением накопления норадреналина в интерстициальном пространстве вследствие угнетения ОЗН, инвертированного во время ишемии [3].
Таким образом, предотвращение накопления норадреналина в интерстициальном пространстве во время ишемии могло бы способствовать уменьшению повреждения миокарда. Действительно, было показано, что введение блокатора ОЗН дезипрамина до начала ишемии способствует уменьшению размера ИМ. Этот благоприятный эффект авторы связывали со снижением накопления норадреналина в интерстициальном пространстве вследствие угнетения ОЗН, инвертированного во время ишемии [3].
Вместе с тем нормальный механизм ОЗН быстро восстанавливается с началом реперфузии, и концентрация норадреналина в интерстициальном пространстве снижается достаточно эффективно. Можно предположить, что блокада ОЗН в этот период будет способствовать ишемическому повреждению. Ранее мы продемонстрировали, что блокада ОЗН в реперфузионном периоде приводит к увеличению размера ИМ. Вероятно, это связано с повышением содержания норадреналина в интерстициальном пространстве миокарда при быстром восстановлении нормального механизма ОЗН [5].
В настоящее время хорошо известно, что ишемическое прекондиционирование уменьшает повреждение миокарда при его ишемии. И в нашем исследовании ишемическое прекондиционирование (3-я группа) вело к двукратному уменьшению величины ИМ (по сравнению с 1-й группой). Описаны многочисленные механизмы, с помощью которых может осуществляться защита миокарда ишемическим прекондиционированием. Эти механизмы до конца не изучены. Однако показано, что ишемическое прекондиционирование приводит к уменьшению накопления норадреналина в интерстициальном пространстве миокарда [6], вероятно, вследствие более продолжительного функционирования нормального механизма ОЗН. Введение блокатора ОЗН не только приводило к увеличению размера ИМ у животных с ишемическим прекондиционированием (4-я группа). Блокада ОЗН у животных этой группы полностью нивелировала защитный эффект прекондиционирования, так что величина инфарктной зоны у них не отличалась от таковой у животных 2-й группы.
Несмотря на сходный конечный результат (уменьшение повреждения миокарда), механизмы естественной защиты от ишемии (ишемическое пре- и посткондиционирование) имеют различия [7]. Поскольку механизм защиты миокарда при ишемическом посткондиционировании напрямую не связан с обменом норадреналина в симпатических нервных окончаниях в миокарде, можно было предположить, что ишемическое посткондиционирование способно обеспечить необходимую степень защиты от ишемии даже на фоне блокады ОЗН в реперфузионном периоде.
У животных 5-й группы нашего исследования ишемическое посткондиционирование способствовало уменьшению размера ИМ, что согласуется с данными литературы [7, 8]. Вместе с тем введение ингибитора ОЗН в начале реперфузионного периода полностью нивелировало этот защитный эффект.
Считается, что одним из ведущих механизмов повреждения миокарда при ишемии-реперфузии является активация свободнорадикального окисления [9]. Ограничение этого процесса в значительной мере обусловливает защитное действие ишемического посткондиционирования [8].
В то же время в качестве одного из объяснений цитотоксичности норадреналина был представлен факт положительной корреляции уровня медиатора с образованием свободных гидроксильных радикалов в интерстициальном пространстве миокарда [10]. Существует мнение, что генерация свободных радикалов зависит не столько от самого норадреналина, сколько от его метаболита, образующегося в результате действия моноаминооксидазы А — 3,4-дигидроксифенилгликольальдегида. Именно в реакциях с этим субстратом образуются свободные радикалы при окислительном стрессе [11].
Вероятно, накопление норадреналина в интерстициальном пространстве миокарда можно рассматривать в качестве универсального фактора повреждения миокарда, воздействие которого при ингибировании обратного захвата не удается предотвратить активацией естественных механизмов защиты (ишемического пре- и посткондиционирования).
В последнее время исследователи уделяют все больше внимания транспортерам, обеспечивающим обратный захват моноаминов. Так, доказано участие транспортера норадреналина в старении, развитии хронической сердечной недостаточности [12], хронической гипоксии [13], эссенциальной гипертонии [14]. Интересной представляется также неравномерность распределения транспортера норадреналина в сердце. Показано, что его концентрация, а соответственно и активность в левом желудочке, существенно выше, чем в предсердиях или правом желудочке [15]. Есть мнение, что именно функциональная способность транспортера норадреналина существенным образом влияет на распределение симпатической активности между сердцем, сосудистой системой и почками [16].
Вместе с тем существует значительное структурное сходство между транспортерами серотонина и норадреналина [17]. Это означает, вероятно, и функциональное подобие, поскольку неселективные ингибиторы обратного захвата серотонина обладают способностью также препятствовать ОЗН.
Дезипрамин, который мы использовали в эксперименте, является производным имипрамина — неселективного ингибитора обратного захвата серотонина, препарата из группы трициклических антидепрессантов, которые широко применяются в клинической практике до настоящего времени.
Более того, имипрамин фигурирует в рекомендациях Американской ассоциации кардиологов 18]. Однако его применение ограничивается случаями нестабильной стенокардии и ИМ без подъема сегмента ST. Результаты нашего исследования ставят под сомнение обоснованность применения у пациентов с ишемической болезнью сердца в раннем постинфарктном периоде как трициклических антидепрессантов, так и препаратов, обладающих способность блокировать обратный захват моноаминов.
Полученные данные подтверждают потенциальную опасность торможения обратного захвата норадреналина в раннем реперфузионном периоде после ишемии миокарда.
Не случайно именно с приемом трициклических антидепрессантов (препаратов, обладающих способностью блокировать обратный захват серотонина и норадреналина) связывают повышенный риск развития острого ИМ [19]. Однако предполагалось, что повреждающее действие инициируется серотонином. Действительно, в научной литературе имеются различные представления о механизмах повреждающего действия серотонина при ишемии/ИМ. Его неблагоприятное воздействие связывали с прямым вазоактивным эффектом [20], усилением агрегации тромбоцитов [21]. Наше исследование продемонстрировало другой механизм потенциальной опасности использования неселективных блокаторов обратного захвата серотонина, связанный с повышением концентрации норадреналина в интерстициальном пространстве миокарда.
Таким образом, блокада ОЗН в раннем реперфузионном периоде после ишемии приводит к увеличению повреждения миокарда, а также препятствует реализации естественных защитных механизмов — ишемического пре- и посткондиционирования.



