В настоящее время все более интенсивно развивается персонализированная терапия, направленная на индивидуальный подбор доз лекарственных препаратов для каждого пациента. Данный подход актуален и в кардиологии. Важным аспектом современной кардиологической практики является профилактика тромбозов и ретромбозов, что имеет большое значение для пациентов, перенесших хирургические вмешательства на сосудах и установку стентов. Одним из основных препаратов для проведения антитромбоцитарной терапии в настоящее время является клопидогрел, применение которого позволяет снизить частоту развития тромботических осложнений у кардиологических пациентов.
Клопидогрел является пролекарством. Его всасывание в кишечнике и поступление в кровь связано с Р-гликопротеином, кодируемым геном MDR1 (ABCB1). В дальнейшем 85% дозы превращаются в неактивное карбоксильное производное за счет действия эстераз плазмы. Оставшиеся 15% дозы претерпевают двухступенчатое окисление под действием изоформ цитохрома Р450, превращаясь сначала в 2-оксо-клопидогрел, а затем — в активное тиольное производное. Кроме того, в образовании активного метаболита принимает участие фермент параоксоназа PON1. Активная форма клопидогрела необратимо ингибирует связывание АДФ с рецепторами P2Y12 тромбоцитов. В дальнейшем происходит ингибирование связывания фибриногена с рецептором GP IIb/IIIa и снижение агрегации тромбоцитов [1].
Таким образом, исходя из известных этапов метаболизма клопидогрела, можно выделить некоторые генетические маркеры, определение которых перед назначением препарата может позволить оптимизировать подбор дозы.
Одними из таких маркеров являются ген ABCB1 и его полиморфные варианты. По имеющимся данным, гаплотип C3435T связан со снижением активности P-гликопротеина. Показано, что для носителей гаплотипа C3435T характерно снижение концентрации активного метаболита клопидогрела в плазме, что связывают с ухудшением клинического прогноза [2, 3].
В качестве другого маркера рассматривается ген цитохрома CYP2C19. Так, полиморфные варианты CYP2C19*2 и *3 ассоциированы со снижением активности фермента и повышением риска тромбозов, что приводит к увеличению риска смерти от сердечно-сосудистых осложнений на 53% [3]. Показано, что у пациентов — носителей хотя бы одного аллеля CYP2C19*2 отмечается более высокая реактивность тромбоцитов после приема клопидогрела, что ассоциируется с неблагоприятным клиническим исходом после установки коронарного стента и повышением вероятности его тромбоза [4].
В то же время полиморфный вариант CYP2C19*17 связан с повышением активности цитохрома, что выражается в увеличении частоты кровотечений на фоне приема клопидогрела [5].
Таким образом, наличие определенных полиморфных вариантов генов CYP2C19 и ABCB1 становится фактором, влияющим на всасывание и метаболизм клопидогрела, что изменяет его активность и терапевтический эффект. Следовательно, определение полиморфизмов этих генов может быть полезным в процессе подбора оптимальной дозы клопидогрела перед началом терапии.
Цель исследования — изучение распространенности аллельных вариантов гена CYP2C19 *1, *2, *3, *17, полиморфных вариантов гена ABCB1 у пациентов, получающих клопидогрел по медицинским показаниям, и определение вклада указанных полиморфизмов в эффективность препарата.
Материал и методы
В настоящее исследование включены пациенты Центра новых медицинских технологий в Академгородке, НИИ патологии кровообращения им. Е.Н. Мешалкина и Государственной Новосибирской областной клинической больницы, страдающие сердечно-сосудистыми заболеваниями, которым была запланирована терапия клопидогрелом по медицинским показаниям. Обязательными условиями включения были наличие данных об агрегации тромбоцитов с АДФ до и после назначения препарата, а также отсутствие противопоказаний к приему препарата. Все пациенты давали информированное согласие на участие в исследовании по форме, соответствующей этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека».
 В исследуемую группу вошли 158 пациентов — мужчины и женщины, с сердечно-сосудистыми заболеваниями. Некоторые из этих больных перенесли хирургические вмешательства на сосудах. Средний возраст пациентов достигал 57,5±8,3 года, доля мужчин составила 90% (139 человек), доля женщин — 10% (19 человек). У 55,7% пациентов имелись в анамнезе чрескожные коронарные вмешательства, 50% перенесли стентирование артерий, 8,9% — шунтирование.
В исследуемую группу вошли 158 пациентов — мужчины и женщины, с сердечно-сосудистыми заболеваниями. Некоторые из этих больных перенесли хирургические вмешательства на сосудах. Средний возраст пациентов достигал 57,5±8,3 года, доля мужчин составила 90% (139 человек), доля женщин — 10% (19 человек). У 55,7% пациентов имелись в анамнезе чрескожные коронарные вмешательства, 50% перенесли стентирование артерий, 8,9% — шунтирование.
Все пациенты принимали препарат клопидогрел (действующее вещество — гидросульфат 391,5 мг, что соответствует содержанию клопидогрела 300 мг).
Для оценки лабораторной эффективности клопидогрела определяли агрегационную способность до и после получения препарата в дозе 600 мг (нагрузочная доза) методом оптической трансмиссионной агрегометрии с использованием АДФ в концентрации 20 мкмоль/л в качестве агониста агрегации.
Для генетического тестирования выделяли ДНК из лейкоцитов периферической крови методом фенольно-хлороформной экстракции с последующим осаждением этанолом. Определение полиморфных вариантов исследуемых генов осуществляли с помощью метода полимеразной цепной реакции в реальном времени с использованием праймеров, комплементарных участкам генов, которые содержат исследуемые полиморфизмы, и анализа полиморфизма длин рестриктивных фрагментов.
Для проведения анализа полученных результатов использовали программный пакет Statistica 6.0. Для статистической обработки результатов применяли регрессионный анализ. Минимальную вероятность справедливости нулевой гипотезы принимали при уровне значимости 5% (p<0,05).
Результаты и обсуждение
В качестве меры изменения агрегационных показателей использовали резистентность, рассчитываемую как отношение разности показателей агрегации тромбоцитов с АДФ до (АТ0) и после (АТКл) приема клопидогрела, отнесенное к исходному значению агрегации: ПР (%) = (АТ0–АТКл)·100/АТ0.
В зависимости от значения показателя резистентности, характеризующего изменение агрегации тромбоцитов с АДФ до и после приема клопидогрела, пациенты были разделены на группы согласно приведенным в литературе рекомендациям [6—8]. Пациенты с показателями резистентности от 0 до 10% были отнесены к группе нечувствительных к клопидогрелу. В настоящее время считается, что у пациентов этой группы имеется неблагоприятный клинический прогноз после установки стента [7]. Доля таких пациентов составила 7,6%.
 Пациенты с показателями резистентности от 10 до 30% были отнесены к группе промежуточного ответа (20,9%), а пациенты с показателями резистентности более 30% — к группе чувствительных к клопидогрелу (58,9%). В то же время у отдельных пациентов наблюдался парадоксальный ответ — агрегация тромбоцитов с АДФ повышалась после приема клопидогрела. Доля таких пациентов составила 12,7%.
Пациенты с показателями резистентности от 10 до 30% были отнесены к группе промежуточного ответа (20,9%), а пациенты с показателями резистентности более 30% — к группе чувствительных к клопидогрелу (58,9%). В то же время у отдельных пациентов наблюдался парадоксальный ответ — агрегация тромбоцитов с АДФ повышалась после приема клопидогрела. Доля таких пациентов составила 12,7%.
Полученные результаты сопоставимы с данными литературы, однако следует отметить, что доля пациентов, проявляющих парадоксальный ответ, по данным литературы, не превышает 2% [8]. Существует ряд возможных объяснений развитию парадоксального ответа на прием клопидогрела. Данный эффект может быть связан со следующими явлениями:
1. Вклад генетических факторов. Ген MDR1 и P-гликопротеин — транспортный белок, активность которого лимитирует всасывание клопидогрела в кишечнике.
Ген цитохрома CYP2C19: вклад полиморфных вариантов *2, *3 и *17. Цитохром CYP2C19 является одним из основных участников окисления неактивной формы клопидогрела и превращения ее в активный метаболит.
Другие цитохромы (CYP3A4, CYP2B6, CYP2C9 и др.), которые также вносят свой вклад в окисление клопидогрела.
Параоксоназа PON1 — один из участников превращения 1-оксоклопидогрела в активное тиольное производное. Следует отметить, что в настоящее время нет единого мнения о степени ее вклада в метаболическую активность клопидогрела и степени выраженности ответа на него [9, 10].
Особенности рецепторных систем тромбоцитов, которые могут быть обусловлены как изменениями рецептора P2Y12, непосредственно связывающегося с активным производным клопидогрела, так и изменениями рецептора GP IIb/IIIa [11]. Однако в настоящее время не выявлено достоверной связи между наличием полиморфных вариантов гена рецептора P2Y12 и ответом на клопидогрел [12].
Возможные лекарственные взаимодействия и особенности приема лекарственных препаратов. Необходимо отметить, что частично лекарственные взаимодействия могут быть обусловлены активностью системы белков-цитохромов. Так, сочетанный прием клопидогрела и ингибиторов протонного насоса, в частности, омепразола, приводит к снижению антиагрегантных свойств первого препарата за счет того, что в метаболизме обоих лекарственных средств участвуют белки-цитохромы.
В настоящее время активно обсуждается целесообразность назначения препаратов этих двух групп, однако единого решения пока не принято [13, 14].
2. Влияние других факторов, например, сопутствующей соматической патологии, недостаточная дозировка, снижение всасывания препарата и т.д. Важную роль в вариабельности терапевтического ответа играет наличие у пациентов сахарного диабета 2-го типа или инсулинорезистентности.
В дальнейшем проводился анализ представленности изучаемых полиморфизмов в исследуемой группе и анализ корреляционных связей между наличием тех или иных полиморфных вариантов генов — участников метаболизма клопидогрела – и выраженностью лабораторной реакции на препарат (табл. 1).
Полиморфный вариант CYP2C19*3 не был представлен в исследуемой группе, что согласуется с имеющимися данными о его низкой распространенности. Кроме того, в группе исследования выявлен всего один гомозиготный носитель варианта CYP2C19*2. Показано наличие достоверного вклада аллельного варианта CYP2C19*2 в лабораторную эффективность клопидогрела. Медиана резистентности у пациентов «дикого» типа выше, чем у гетерозиготных носителей полиморфного варианта *2 (p<0,05), а это свидетельствует о большей выраженности лабораторного ответа на клопидогрел у представителей генотипа *1/*1. Таким образом, может быть сделан вывод о том, что пациенты исследуемой группы, имеющие полиморфный вариант *2, несколько хуже отвечают на клопидогрел, и степень снижения агрегации тромбоцитов после приема клопидогрела у них ниже, чем у представителей «дикого» типа.
В то же время для других маркеров — CYP2C19*17, ABCB1 C3435T — такого вклада выявлено не было. Следует отметить, что распространенность гомозигот ABCB1 3435TT (36,1%) выше, чем гомозигот «дикого» типа CC (19,6%), и сопоставима с таковой для гетерозигот CT (44,3%). Это соотносится с общемировыми данными, приведенными в базах данных NCBI. Приведенные данные должны учитываться при назначении терапии препаратами — субстратами P-гликопротеина. Однако при проведении статистического анализа выявлено отсутствие статистически достоверного вклада полиморфных вариантов гена ABCB1 в лабораторный ответ на клопидогрел (р=0,54).
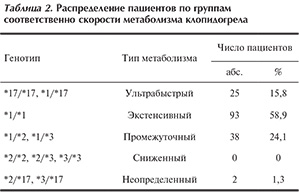
В последующем пациенты были разделены на группы в зависимости от скорости метаболизма клопидогрела, определяемой согласно наличию тех или иных полиморфных вариантов гена CYP2C19, от ультрабыстрого до замедленного метаболизма лекарственного субстрата. Кроме того, отдельно была выделена группа промежуточного ответа — пациенты, являющиеся носителями аллелей, обладающих противоположным эффектом — CYP2C19*2 и CYP2C19*17. В настоящее время однозначно не определено влияние такого сочетания полиморфных вариантов на скорость метаболизма клопидогрела (табл. 2).
В результате анализа получены следующие результаты: среднее значение резистентности в группе ультрабыстрого ответа выше, чем в группе экстенсивного ответа (p<0,01), в свою очередь превышающее значение в группе промежуточного и неопределенного ответа (p<0,05). Это подтверждает данные о том, что аллельный вариант *17 характеризуется повышением функции цитохрома, а вариант *2 связан со снижением этого показателя. Кроме того, значение резистентности в группе неопределенного ответа ниже, чем в группе носителей промежуточного ответа. Следует отметить, что в настоящее время не полностью определен вклад каждого полиморфного варианта в активность работы цитохрома у носителей генотипа *2/*17. Исходя из наших данных, можно сделать вывод, что влияние аллеля CYP2C19*2 на агрегацию тромбоцитов превышает влияние аллеля CYP2C19*17. Выявлены достоверные различия среднего значения резистентности между группами ультрабыстрого и экстенсивного ответа, а также между группами ультрабыстрого и неопределенного ответа (p<0,01).
Отдельно проанализирована группа пациентов с парадоксальной лабораторной реакцией на прием клопидогрела. При этом не выявлено достоверных ассоциаций между парадоксальной реакцией и наличием исследуемых генетических маркеров (p>0,05).
Заключение
В настоящем исследовании проведен анализ вклада известных генетических маркеров — генов цитохрома CYP2C19 и транспортного белка ABCB1 в лабораторный ответ на клопидогрел. Среди пациентов, участвовавших в исследовании, выделена группа лиц с парадоксальным ответом на препарат, заключавшимся в повышении агрегации тромбоцитов с АДФ на фоне приема клопидогрела. Установлена связь полиморфного варианта CYP2C19*2 с изменением агрегации тромбоцитов после приема клопидогрела, в то время как для других маркеров такая связь не выявлена. Кроме того, было показано, что у пациентов из группы ультрабыстрого ответа имеется более высокая резистентность, чем в группе экстенсивного ответа, которая, в свою очередь превышает таковую в группе промежуточного и неопределенного ответа.
Работа выполнена при поддержке Междисциплинарного интеграционного проекта №91 СО РАН.



