Под вторичной профилактикой понимают профилактику повторного инсульта, если у пациента был инсульт (ишемический или геморрагический), или профилактику первого инсульта после транзиторной ишемической атаки (ТИА). Риск возникновения повторного ишемического инсульта (ИИ) в 9 раз выше по сравнению с первичным с пациентами того же пола и возраста [1, 2].
Значение вторичной профилактики цереброваскулярных осложнений в последние годы значительно возросло, поскольку в России достигнуты успехи в снижении смертности от инсульта и, следовательно, увеличилось число выживших больных, нуждающихся во вторичной профилактике. Кроме того, у пациентов, перенесших инсульт или ТИА, в 2—3 раза повышен риск развития инфаркта миокарда (ИМ), нестабильной стенокардии и внезапной сердечной смерти [2]. В то же время вопросы назначения антигипертензивной, гиполипидемической и антитромбоцитарной терапии вызывают трудности в клинической практике.
Антигипертензивная терапия. Между уровнем артериального давления (АД) и риском развития инсульта также существует линейная зависимость [3]. Так, в исследовании UK-TIA выявлено, что с увеличением уровня систолического АД (САД) увеличивается и риск развития инсульта, а также то, что снижение САД на 10 мм рт.ст. снижает риск развития повторного инсульта на 28% [3]. Следовательно, существует взаимосвязь между уровнями САД и диастолического АД (ДАД) и риском развития инсульта, нижний предел которой установлен; пока это взаимосвязь обнаружена даже при уровне САД 115 мм рт.ст. [4].
Хотя многочисленные рандомизированные исследования и мета-анализы подтверждают важность лечения АГ в профилактике первичного сердечно-сосудистого заболевания в целом и инсульта в частности, проведено лишь несколько исследований с прямой оценкой эффективности лечения АГ при вторичной профилактике у лиц с инсультом или ТИА в анамнезе [5, 6]. Мета-анализ рандомизированных исследований показал, что у пациентов с инсультом или ТИА в анамнезе антигипертензивные препараты уменьшают риск развития повторного инсульта [6]. Мета-анализ включал 7 рандомизированных исследований, проведенных до 2002 г.: Dutch TIA с β-адреноблокатором атенололом [7], PATS (Post stroke Antihypertensive Treatment Study) с диуретиком индапамидом [8], HOPE (Heart Outcomes Prevention Evaluation) с ингибитором ангиотензинпревращающего фермента (АПФ) рамиприлом [9], и PROGRESS (Perindopril Protection Against Recurrent Stroke Study) с ингибитором АПФ периндоприлом (в сочетании с индапамидом или без) [20], и еще три менее крупных исследования [11—13]. В совокупности в этих исследованиях участвовали 15 527 пациентов с ТИА или внутричерепным кровоизлиянием, которые были рандомизированы в периоде от 3 нед до 14 мес от развития этого события и наблюдались в течение 2—5 лет. Ни в одном из исследований не оценивали эффекты нелекарственных вмешательств.
В целом лечение антигипертензивными препаратами ассоциировалось с достоверным снижением риска развития повторного инсульта (относительный риск — ОР — 0,76 при 95% доверительном интервале — ДИ — от 0,63 до 0,92), а также ИМ (ОР 0,79 при 95% ДИ от 0,63 до 0,98) и любых сосудистых осложнений (ОР 0,79 при 95% ДИ от 0,66 до 0,95) [6]. Более выраженное снижение САД ассоциировалось с большим снижением риска развития повторного инсульта.
В связи с небольшим числом исследований проведение сравнений между антигипертензивными препаратами ограничено. Достоверное снижение риска повторного развития инсульта наблюдалось при использовании диуретиков как в виде монотерапии, так и в комбинации с ингибиторами АПФ, однако не обнаружено при использовании β-адреноблокаторов или ингибиторов АПФ в виде монотерапии; тем не менее следует отметить, что статистическая мощность для анализа была небольшой (особенно что касается оценки β-адреноблокаторов) [6].
 Позже были опубликованы результаты двух других крупных рандомизированных исследований по оценке эффективности антигипертензивной терапии у пациентов с инсультом в анамнезе: MOSES (Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention) [14] и PRoFESS (Prevention Regimen for Effectively Avoiding Second Strokes) [15]. В исследовании MOSES участвовали 1405 пациентов с АГ и инсультом или ТИА в анамнезе давностью менее 2 лет, которые были рандомизированы в группу приема эпросартана (блокатора рецепторов ангиотензина II 1-го типа — БРА) или в группу приема нитрендипина (антагониста кальция) [14]. Уровни снижения АД были сходными при использовании этих двух препаратов. Общая частота развития инсультов и ТИА (с учетом повторных случаев) была меньше у лиц, рандомизированных в группу эпросартана (относительный риск — ОР 0,75 при 95% ДИ от 0,58 до 0,97), при этом не отмечалось снижения риска первичного комбинированного исхода (смерть, кардио- или цереброваскулярное осложнение; ОР 0,79 при 95% ДИ от 0,66 до 0,96). Наибольший вклад в профилактику цереброваскулярных осложнений внесло снижение риска развития ТИА [14]. В исследовании PRoFESS приняли участие более 20 тыс. пациентов с ИИ, которые были рандомизированы в группу приема телмисартана или группу плацебо в течение 90 дней после события [15]. Терапия телмисартаном не сопровождалась снижением риска развития повторного инсульта (ОР 0,95 при 95% ДИ от 0,86 до 1,04) или основных сердечно-сосудистых осложнений (ОР 0,94 при 95% ДИ от 0,87 до –1,01) при среднем периоде наблюдения 2,5 года. Однако более интенсивное лечение другими антигипертензивными препаратами в группе плацебо привело к недооценке влияния лечения телмисартаном на риск развития повторного инсульта.
Позже были опубликованы результаты двух других крупных рандомизированных исследований по оценке эффективности антигипертензивной терапии у пациентов с инсультом в анамнезе: MOSES (Morbidity and Mortality After Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention) [14] и PRoFESS (Prevention Regimen for Effectively Avoiding Second Strokes) [15]. В исследовании MOSES участвовали 1405 пациентов с АГ и инсультом или ТИА в анамнезе давностью менее 2 лет, которые были рандомизированы в группу приема эпросартана (блокатора рецепторов ангиотензина II 1-го типа — БРА) или в группу приема нитрендипина (антагониста кальция) [14]. Уровни снижения АД были сходными при использовании этих двух препаратов. Общая частота развития инсультов и ТИА (с учетом повторных случаев) была меньше у лиц, рандомизированных в группу эпросартана (относительный риск — ОР 0,75 при 95% ДИ от 0,58 до 0,97), при этом не отмечалось снижения риска первичного комбинированного исхода (смерть, кардио- или цереброваскулярное осложнение; ОР 0,79 при 95% ДИ от 0,66 до 0,96). Наибольший вклад в профилактику цереброваскулярных осложнений внесло снижение риска развития ТИА [14]. В исследовании PRoFESS приняли участие более 20 тыс. пациентов с ИИ, которые были рандомизированы в группу приема телмисартана или группу плацебо в течение 90 дней после события [15]. Терапия телмисартаном не сопровождалась снижением риска развития повторного инсульта (ОР 0,95 при 95% ДИ от 0,86 до 1,04) или основных сердечно-сосудистых осложнений (ОР 0,94 при 95% ДИ от 0,87 до –1,01) при среднем периоде наблюдения 2,5 года. Однако более интенсивное лечение другими антигипертензивными препаратами в группе плацебо привело к недооценке влияния лечения телмисартаном на риск развития повторного инсульта.
Следовательно, четко доказана польза от снижения АД как такового в профилактике повторного инсульта. Поэтому пациентам с ИИ или ТИА в анамнезе рекомендуется назначение антигипертензивной терапии с целью профилактики как повторного инсульта, так и других сосудистых осложнений. Это положение нашло отражение в Российских рекомендациях по диагностике и лечению АГ (IV редакция, 2010), новых Европейских рекомендациях по АГ (2013), а также Американских рекомендациях по профилактике инсульта у пациентов с инсультом или ТИА (разработаны Американской ассоциацией сердца и Американской ассоциацией по изучению инсульта) [16—18]. Европейские и американские эксперты выносят данному положению самый высокий уровень согласно критериям доказательной медицины — класс I, уровень доказательности A [17, 18].
Согласно Российским рекомендациям (2010) и Европейским рекомендациям (2013) целевой уровень АД для пациентов с АГ, перенесших инсульт или ТИА, составляет менее 140/90 мм рт.ст., т.е. такой же, как и у больных с АГ без инсульта или ТИА в анамнезе [16, 17]. Европейские эксперты оценивают уровень доказанности данного положения на уровне IIaВ [17].
В Российских рекомендациях по диагностике и лечению АГ специально подчеркивается, что для достижения целевого АД у пациентов, перенесших инсульт или ТИА, АД следует снижать с использованием этапной схемы, учитывая индивидуальную переносимость и избегая эпизодов гипотонии, а особый контроль АД необходим в ночные часы [16].
Оптимальный режим медикаментозной антигипертензивной терапии для лечения больных этой категории не определен, поскольку прямые сравнения между режимами лечения крайне ограничены. В Российских рекомендациях по диагностике и лечению АГ говорится, что если роль снижения АД не вызывает сомнений, то для уточнения способности антигипертензивных препаратов различных классов снижать риск развития цереброваскулярных осложнений требуются дальнейшие исследования [16]. Поэтому для контроля АД в настоящее время могут использоваться антигипертензивные препараты всех классов и их рациональные комбинации [16].
Одним из осложнений мозгового инсульта являются постинсультные когнитивные нарушения и деменция [19].
 Основными когнитивными функциями считают речь, гнозис (восприятие информации), память, интеллект и праксис (произвольное, целенаправленное двигательное действие), речь, память и интеллект [20]. Выделяют легкие, умеренные и тяжелые когнитивные расстройства (акад. Н.Н. Яхно, 2005 г.) [20]. Легкие когнитивные расстройства — снижение одной или нескольких когнитивных функций по сравнению с исходным более высоким уровнем (индивидуальной нормой), не влияющее на бытовую, профессиональную и социальную деятельность, в том числе на наиболее сложные ее формы.
Основными когнитивными функциями считают речь, гнозис (восприятие информации), память, интеллект и праксис (произвольное, целенаправленное двигательное действие), речь, память и интеллект [20]. Выделяют легкие, умеренные и тяжелые когнитивные расстройства (акад. Н.Н. Яхно, 2005 г.) [20]. Легкие когнитивные расстройства — снижение одной или нескольких когнитивных функций по сравнению с исходным более высоким уровнем (индивидуальной нормой), не влияющее на бытовую, профессиональную и социальную деятельность, в том числе на наиболее сложные ее формы.
Умеренные когнитивные нарушения — это расстройства одной или нескольких когнитивных функций, которые выходят за рамки среднестатистической возрастной нормы, но не вызывают дезадаптацию [20].
Тяжелые когнитивные расстройства (деменция) — расстройства когнитивных функций, которые приводят к полной или частичной утрате независимости и самостоятельности пациента, т.е. вызывают профессиональную, социальную и/или бытовую дезадаптацию [20]. Согласно МКБ-10 деменцию диагностируют при нарушении памяти и, по крайней мере, еще одной когнитивной функции (речь, праксис, гнозис, мышление) — при условии, что они затрудняют профессиональную деятельность или социальную адаптацию и сохраняются не менее 6 мес. Принципиальным отличием от легких и умеренных когнитивных расстройств является наличие инвалидизации — невозможность сохранять профессиональную деятельность или социальную, в том числе бытовую, дезадаптацию [21].
Постинсультную деменцию принято диагностировать при наличии ее временной связи с клинически явным эпизодом нарушения мозгового кровообращения. Она может проявляться в первые 3 мес после инсульта (ранняя постинсультная деменция) или в более поздние сроки, но обычно не позднее 1 года после инсульта (поздняя постинсультная деменция) [22].
Когнитивные нарушения различной степени тяжести выявляются у 40—70% пациентов, перенесших инсульт [19]. Распространенность деменции в первые 3—6 мес после инсульта колеблется от 5 до 32%, а спустя 12 мес — от 8 до 26% [21]. Наиболее высок риск развития деменции в первые 6 мес после инсульта, однако повышенный риск возникновения деменции у лиц, перенесших инсульт, сохраняется, по крайней мере, в течение нескольких лет [19, 21]. В 5-летней перспективе риск развития деменции у лиц, перенесших инсульт, оказывается примерно в 4—5 раз выше, чем в общей популяции [19, 21].
В 2013 г. опубликован мета-анализ по влиянию антигипертензивной терапии на когнитивные функции [23]. Вторая часть данного мета-анализа, включавшая 17 исследований (13 734 пациента), посвящена сравнению эффекта антигипертензивных препаратов 5 основных классов (диуретики, β-адреноблокаторы, антагонисты кальция, ингибиторы АПФ и БРА) на когнитивные функции с плацебо и между собой [23]. Оказалось, что только БРА достоверно улучшают когнитивные функции по сравнению с плацебо (р=0,02), тогда как у антигипертензивных препаратов других 4 классов достоверных по сравнению с плацебо влияний на когнитивные функции не обнаружено. Кроме того, БРА оказались достоверно эффективнее по влиянию на когнитивные функции по сравнению с диуретиками (р=0,04), β-адреноблокаторами (р=0,01) и ингибиторами АПФ (р=0,04). Их сравнение с антагонистами кальция выявило сходную тенденцию (р=0,06). В то же время при сравнении влияния на когнитивные функции антигипертензивных препаратов всех других классов между собой (антагонисты кальция — ингибиторы АПФ, антагонисты кальция — β-адреноблокаторы, антагонисты кальция — диуретики, ингибиторы АПФ — β-адреноблокаторы, ингибиторы АПФ — диуретики, β-адреноблокаторы — диуретики) достоверных различий не отмечено [23]. Результаты этого мета-анализа свидетельствуют, что антигипертензивные препараты 2 классов, блокирующие ренин-ангиотензин-альдостероновую систему, достоверно различаются по влиянию на когнитивные функции. В этой связи представляет интерес прямое сравнение валсартана (представитель БРА) и эналаприла (представитель ингибиторов АПФ) на память у пожилых больных АГ [24]. В данном исследовании приняли участие 144 пациента с мягкой и умеренной артериальной гипертонией — АГ (ДАД ≥95 мм рт.ст. и ≤110 мм рт.ст.), оно включало 2-недельный «отмывочный» период и 16-недельный период лечения валсартаном в дозе 160 мг 1 раз в день или эналаприлом в дозе 20 мг 1 раз в день. Достоверное по сравнению с исходным улучшение памяти (2 теста — тест запоминания слов и тест вспоминания слов) выявлено только в группе валсартана [24].
Антитромбоцитарная терапия при некардиоэмболическом инсульте или ТИА (в частности, при атеросклеротическом, лакунарном или криптогенном инфаркте). В Российской Федерации зарегистрировано 3 антитромбоцитарных препарата, которые могут и должны применяться для профилактики сосудистых осложнений у пациентов с инсультом или ТИА в анамнезе: ацетилсалициловая кислота (АСК), комбинация АСК и дипиридамола и клопидогрел. В среднем эти препараты уменьшают ОР развития инсульта, ИМ или смерти приблизительно на 22% [25], однако между ними существуют важные различия, которые непосредственно влияют на их выбор в той или иной клинической ситуации.
АСК. Имеются данные целого ряда исследований о том, что АСК предотвращает инсульт у пациентов с недавно перенесенным инсультом или ТИА; эти исследования объединены в мета-анализ [26]. По данным мета-анализа плацебо-контролируемых исследований по применению АСК для профилактики повторного инсульта, снижение ОР развития инсульта любого типа (геморрагического или ишемического) составило 15% (при 95% ДИ от 6 до 23%) [26]. Выраженность благоприятного эффекта примерно одинакова при применении препарата в дозах от 50 до 1500 мг в сутки [26], хотя данные для доз <75 мг малочисленны. Однако вероятность развития побочных эффектов АСК зависит от дозы и, естественно, крайне высока при применении высоких доз. Главным побочным эффектом АСК является желудочно-кишечное кровотечение; риск его развития тем выше, чем больше доза препарата: у пациентов, которые применяют АСК в дозе ≥325 мг в сутки в течение длительного времени, ежегодный риск выраженного желудочно-кишечного кровотечения в 2,5 раза выше, чем у пациентов, не принимающих этот препарат [27]. Терапия АСК ассоциируется также с повышением риска развития геморрагического инсульта, хотя оно меньше, чем снижение риска развития ИИ [28].
Комбинация дипиридамола и АСК. Дипиридамол подавляет активность фосфодиэстеразы и усиливает опосредуемое простациклином подавление агрегации тромбоцитов [29]. Эффективность дипиридамола в комбинации с АСК у пациентов с ТИА или инсультом изучали в 4 рандомизированных клинических исследованиях. В совокупности эти исследования показали, что данная комбинация не менее эффективна, чем монотерапия АСК, при вторичной профилактике инсульта, однако хуже переносится пациентами. Первым из крупных исследований стало исследование ESPS-1 (European Stroke Prevention Study) [30], в котором 2500 пациентов были рандомизированы на группу плацебо или группу комбинации АСК 325 мг и дипиридамола немедленного высвобождения 75 мг 3 раза в сутки. Через 2 года частота развития инсульта или смерти составила в группе АСК и дипиридамола 16%, тогда как в группе плацебо — 25% (снижение ОР 33%; p<0,001) [30].
Следующим крупным исследованием стало исследование ESPS-2 с участием 6602 пациентов с инсультом или ТИА в анамнезе, рандомизированных согласно факторному протоколу на 4 группы со следующей терапией: 1) АСК 25 мг 2 раза в сутки и дипиридамол замедленного высвобождения 200 мг 2 раза в сутки; 2) АСК 25 мг 3 раза в сутки; 3) только дипиридамол замедленного высвобождения; 4) плацебо [31]. По сравнению с группой плацебо риск развития инсульта в группе АСК снизился на 18% (p=0,013), в группе дипиридамола — на 16% (p=0,039), в группе комбинированной терапии — на 37% (p<0,001). По сравнению с монотерапией АСК комбинированная терапия АСК и дипиридамолом снизила риск развития инсульта на 23% (p=0,006), а риск развития инсульта или смерти на 13% (p=0,056). В группе дипиридамола частота кровотечений достоверно не возрастала, однако в группе комбинированной терапии чаще возникали такие побочные эффекты, как головная боль и симптомы нарушения функции желудочно-кишечного тракта [31].
В третьем крупном проспективном рандомизированном открытом простом слепом исследовании ESPRIT (European Australasian Stroke Prevention in Reversible Ischemia Trial) у мужчин и женщин с ТИА или ИИ давностью менее 6 мес сравнивали эффективность монотерапии АСК и комбинации АСК с дипиридамолом в профилактике инсульта, ИМ, сосудистой смерти или тяжелого кровотечения [32]. Доза АСК могла варьировать в зависимости от решения лечащего врача от 30 до 325 мг/сут, средняя доза в каждой группе составила 75 мг/сут. Среди пациентов, распределенных на группу дипиридамола, 83% получали форму с замедленным высвобождением, а остальные — форму с немедленным высвобождением. Через 3,5 года первичная конечная точка была достигнута у 13% пациентов в группе комбинированной терапии и у 16% — в группе с применением только АСК (ОР 0,80 при 95% ДИ от 0,66 до 0,98; снижение абсолютного риска — АР — 1% в год при 95% ДИ от 0,1 до 1,8) [32]. Однако исследование было открытым, что потенциально таит в себе большой риск системных ошибок и снижает ценность полученных данных.
Четвертым исследованием было исследование PRoFESS [33], однако речь о нем пойдет далее.
Клопидогрел является антагонистом рецептора АДФ тромбоцитов [29]. Он необратимо и селективно связывается с рецепторами АДФ, в результате чего подавляется активация тромбоцитов на ранних стадиях, нарушается агрегация в ответ на АДФ; помимо этого снижается способность к активации рецепторов GPIIb/IIIa. Эффект клопидогрела проявляется через 3—5 дней, длительность действия — 72 ч после отмены препарата [29]. Клопидогрел интенсивно метаболизируется в печени, и уже его метаболит непосредственно подавляет агрегацию [29]. Антиагрегационный эффект проявляется в первые сутки, достигая стадии стабилизации через 3—7 дней. В данной стадии агрегация АДФ подавляется на 40—60%. Полное его удаление из циркуляции наблюдается через 5 дней [29].
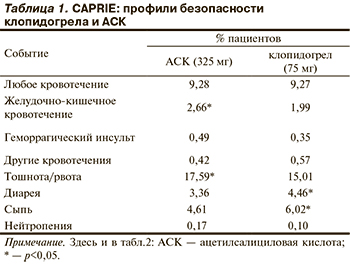
Эффективность клопидогрела в виде монотерапии для профилактики повторного инсульта продемонстрирована в двух исследованиях, в одном его сравнивали с АСК [27], в другом — с комбинацией АСК и дипиридамола [33]. В каждом из исследований частота первичных исходов была одинаковой в группах лечения. В исследовании CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events) [27] клопидогрел сравнивали с АСК в отдельности. Более 19 тыс. пациентов с инсультом, ИМ или заболеванием периферических сосудов были рандомизированы в группу приема АСК в дозе 325 мг/сут или клопидогрела 75 мг/сут. Ежегодная частота развития ИИ, ИМ или сосудистой смерти составила 5,32% в группе клопидогрела и 5,83% в группе АСК (снижение ОР 8,7% при 95% ДИ от 0,3 до 16,5; p=0,043). При анализе в подгруппах пациентов, у которых на момент включения в исследование CAPRIE имелся инсульт, наблюдалась сходная тенденция. В этой подгруппе ежегодная частота развития повторного инсульта, ИМ или сосудистой смерти составила 7,15% в группе клопидогрела и 7,71% в группе АСК (снижение ОР 7,3% при 95% ДИ от –6 до 19%; p=0,26) [27]. Таким образом, было доказано, что клопидогрел является более эффективным антитромбоцитарным препаратом, чем АСК, в предотвращении повторного осложнения у пациентов, перенесших инсульт. В группе клопидогрела достоверно реже отмечены желудочно-кишечные кровотечения, а также побочные эффекты в области верхних отделов желудочно-кишечного тракта (табл. 1) [27].
Клопидогрел (монотерапия, доза 75 мг/сут) сравнивали с комбинацией АСК и дипиридамола замедленного высвобождения в исследовании PRoFESS, которое было спланировано как исследование с доказательством «не хуже контроля» [33]. В группе из 20 332 пациентов с ИИ, которых наблюдали в среднем в течение 2,5 года, повторный инсульт возник у 9% в группе АСК с дипиридамолом и у 8,8% в группе клопидогрела (ОР 1,01 при 95% ДИ от 0,92 до 1,11). Поскольку верхняя граница доверительного интервала пересекала порог установления не меньшей эффективности (ОР 1,075), исследователи сделали вывод, что результаты не смогли показать, что комбинация АСК с дипиридамолом не менее эффективна, чем клопидогрел.
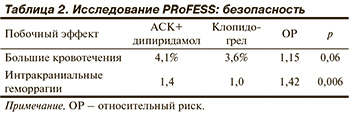
Клопидогрел продемонстрировал достоверно лучшую переносимость по сравнению с комбинацией АСК с дипиридамолом [33]. Так, у пациентов, получавших АСК с дипиридамолом замедленного высвобождения, чаще возникали тяжелые кровотечения, а также чаще регистрировались внутричерепные кровотечения (табл. 2) по сравнению с таковыми в группе клопидогрела. В группе применения комбинации АСК и дипиридамола замедленного высвобождения также чаще отмечались нежелательные явления, приводившие к отмене препарата (16,4 и 10,6% соответственно). Показано, что комбинированная терапия переносится хуже, чем терапия одним антиагрегантным препаратом.
Хотя применение клопидогрела и АСК рекомендуется вместо приема только АСК при острых коронарных синдромах, результаты исследования MATCH (Management of Atherothrombosis with Clopidogrel in High-Risk Patients with Recent Transient Ischemic Attacksor Ischemic Stroke) свидетельствуют об отсутствии сопоставимого ОР и пользы у пациентов с инсультами или ТИА, которых начали лечить вне острого периода [34]. В этом исследовании сравнивали эффективность комбинации клопидогрела 75 мг и АСК 75 мг с монотерапией клопидогрелом 75 мг у пациентов, недавно перенесших ТИА или ИИ [34]. В группе из 7599 пациентов, которых наблюдали на протяжении 3,5 года, оценивали частоту первичного комбинированного исхода, включавшего ИИ, ИМ, сосудистую смерть или повторную госпитализацию в связи с любым центральным или периферическим ишемическим осложнением. В исследовании не обнаружено значимой пользы комбинированной терапии, по сравнению с приемом только клопидогрела, в снижении риска первичного исхода или любого из вторичных исходов. Риск тяжелого кровотечения в группе комбинированной терапии был достоверно выше, чем в группе приема только клопидогрела, при этом АР угрожающего жизни кровотечения увеличился на 1,3% [34].
Консенсус назначения антитромботической терапии для профилактики инсульта (Американская коллегия торакальных врачей, 2008) подводит резюме в применении антиагрегантов для профилактики повторного инсульта [35]:
- АCК 75—325 мг/сут (1A); 50—100 мг/сут (1В);
- Комбинация АСК 25 мг с медленно высвобождающейся формой дипиридамола 200 мг 2 раза в день (1А);
- Клопидогрел 75 мг/сут (1А);
- Комбинация АСК с дипиридамолом эффективнее АСК (2А);
- Клопидогрел эффективнее АСК (2В).
Клопидогрел так же эффективен, как комбинация АСК с дипиридамолом (2А).
Следовательно, клопидогрел имеет лучшее соотношение эффективности и переносимости для профилактики повторного инсульта. Только высокая стоимость была значительным недостатком данного препарата и ограничивала его применение в широкой практике. Поэтому крайне важно появление генериков, имеющих 3 уровня эквивалентности с оригинальным препаратом (фармацевтическая, биологическая и терапевтическая), как, например, лопирел (Актавис) [36—38].
Cтатины в профилактике повторного инсульта. До недавнего времени было неясно, какую роль играют (и играют ли вообще) статины у пациентов с инсультом без установленной ишемической болезни сердца (ИБС), в отношении профилактики повторного инсульта. Ретроспективный анализ в подгруппе из 3280 участников исследования HPS (Heart Protection Study) показал, что у этих пациентов, перенесших ишемическое цереброваскулярное осложнение с клиническими проявлениями в среднем 4,3 года назад, терапия статином привела к снижению риска основных сосудистых осложнений на 20% (ОР 0,80 при 95% ДИ от 0,71 до 0,92) [39]. В то же время относительно снижения частоты развития повторных инсультов симвастатин не обеспечивал пользы (ОР 0,98 при 95% ДИ от 0,79 до 1,22) и ассоциировался как с недостоверным снижением риска развития ИИ на 19%, так и с недостоверным увеличением практически в 2 раза риска развития геморрагического инсульта (симвастатин — 1,3%, плацебо — 0,7%; ОР 1,91 при 95% ДИ от 0,92 до 3,96; симвастатин — 4,3%, плацебо — 5,7%; p<0,0001) [39]. Ввиду поискового характера этого ретроспективного анализа в подгруппах в исследовании HPS остается неясным, получают ли пациенты с инсультом в конечном счете пользу от лечения статином в виде снижения риска развития сосудистых осложнений (в том числе повторного инсульта), особенно пациенты без диагностированной ИБС [40].
В исследовании SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels) 4731 пациент с инсультом или ТИА в анамнезе и относительно невысокими уровнями холестерина (ХС) липопротеидов низкой плотности — ЛНП (от 100 до 190 мг/дл) и без установленной ИБС был рандомизирован в группу приема аторвастатина в высокой дозе (80 мг в сутки) или в группу плацебо [41]. В течение периода наблюдения (в среднем 4,9 года) фатальные и нефатальные инсульты возникли у 11,2% пациентов, получавших аторвастатин, и у 13,1% пациентов, получавших плацебо (снижение АР за 5 лет составило 2,2%; ОР 0,84 при 95% ДИ от 0,71 до 0,99; p=0,03). Снижение АР развития основных сердечно-сосудистых исходов за 5 лет составило 3,5% (ОР 0,80 при 95% ДИ от 0,69 до 0,92; p=0,002) [41].
Терапия статином в целом хорошо переносилась, отмечалось лишь несколько более частое увеличение уровней печеночных ферментов и содержания креатинфосфокиназы, однако не было ни одного случая развития печеночной недостаточности, ни избыточного числа случаев развития миопатии, миалгии или рабдомиолиза [41]. Заболеваемость геморрагическим инсультом была выше в группе применения аторвастатина (n=55, или 2,3%), чем в группе плацебо (n=33, или 1,4%; ОР 1,66 при 95% ДИ от 1,08 до 2,55), хотя различий по заболеваемости фатальным геморрагическим инсультом между группами не было (17 случаев в группе аторвастатина и 18 в группе плацебо) [41].
По данным исследования SPARCL, число пациентов, которых необходимо лечить для профилактики одного повторного инсульта в течение 1 года, составляет 258, а для профилактики одного нефатального инсульта — 288 [41, 42]. Несмотря на то что в исследование не включали пациентов с ИБС, уменьшение частоты развития различных осложнений ИБС преобладало над уменьшением частоты развития инсультов, в связи с чем можно предполагать, что бессимптомная ИБС часто является одним из сопутствующих состояний у пациентов с инсультом даже в отсутствие ИБС в анамнезе.
В исследовании SPARCL оценивали пользу и риск, связанные с достижением определенной степени снижения уровня ХС ЛНП и национальных рекомендуемых в руководствах целевых уровней. У пациентов со снижением уровня ХС ЛНП более чем на 50% отмечалось снижение комбинированного риска развития нефатального и фатального инсульта на 35%. Хотя риск развития ИИ снизился на 37% (ОР 0,63 при 95% ДИ от 0,49 до 0,81), риск развития геморрагических инсультов не возрастал (ОР 1,02 при 95% ДИ от 0,60 до 1,75). Достижение уровня ХС ЛНП <70 мг/дл ассоциировалось с уменьшением риска развития инсульта на 28% (ОР 0,72 при 95% ДИ от 0,59 до 0,89; p=0,0018) без увеличения риска развития геморрагического инсульта (ОР 1,28 при 95% ДИ от 0,78 до 2,09; p=0,3358), однако доверительные интервалы для последней точечной оценки были широкими [42].
Ретроспективный анализ данных небольшого числа пациентов с ИБС в исследовании SPARCL (n=55 в группе активного лечения, n=33 в группе плацебо) позволил установить, что повышенный риск развития геморрагического инсульта был связан с такими факторами, как геморрагический инсульт в анамнезе (ОР 5,65 при 95% ДИ от 2,82 до 11,30; p<0,001), мужской пол (ОР 1,79 при 95% ДИ 1,13 до 2,84; p=0,01), возраст (10-летние интервалы; ОР 1,42 при 95% ДИ 1,16 до 1,74; p=0,001) и наличие АГ II—III стадии на последнем визите в исследовании (ОР 6,19 при 95% ДИ 1,47 до 26,11; p=0,01) [43].
В Российских рекомендациях по диагностике и лечению атеросклероза (V пересмотр, 2012) записано, что статины рекомендуется назначать пациентам, которые перенесли ИИ и ТИА, обусловленные атеросклерозом мозговых артерий (класс I А); статины не эффективны при геморрагическом инсульте (класс IIb) [35]. Согласно стратификации риска пациенты, перенесшие ИИ или ТИА, относятся к категории очень высокого риска, им необходимо изменить образ жизни и сразу начать медикаментозную гиполипидемическую терапию статинами (независимо от уровня ХС ЛПН) [44]. Целевой уровень ХС ЛПН у этих больных должен быть менее 1,8 ммоль/л или снижение не менее чем на 50% от исходного уровня [44]. Исходя из такого целевого уровня ХС ЛПН, пациентам, перенесшим инсульт, необходимы высокие дозы аторвастатина или розувастатина, поскольку только в таком случае возможно достижение целевого уровня ХС ЛПН.
Необходимость в назначении высоких доз статинов для групп пациентов с очень высоким риском подчеркивается и в Американских рекомендациях (2013) [45]. В них, в частности, сказано, что для групп пациентов с очень высоким риском показана высокоинтенсивная статинотерапия, для этого используются аторвастатин в больших дозах или розувастатин [45].
Следовательно, терапия статинами в высоких дозах показана всем пациентам, перенесшим атеротромботический ИИ или ТИА, независимо от исходного уровня ХС ЛПН.
Поскольку пациенты после инсульта получают большое количество различных лекарственных препаратов, из-за возможности лекарственного взаимодействия представляется целесообразным отдавать предпочтение розувастатину, так как его молекула не взаимодействует с системой цитохрома P450 3А4, через которую метаболизируется большинство лекарственных препаратов [29]. В этом состоит отличие розувастатина от аторвастатина (а также симвастатина), при приеме которых имеется риск нежелательных лекарственных взаимодействий, приводящий в ряде случаев либо к ослаблению эффекта, либо к нежелательным лекарственным реакциям [29]. Кроме того, розувастатин можно принимать в любое время суток независимо от приема пищи, что также выделяет его среди других статинов [29]. Как подробно рассмотрено выше, для пациентов, перенесших инсульт или ТИА, характерны когнитивные нарушения различной степени тяжести, в том числе нарушения памяти, поэтому данная особенность розувастатина является для этой категории больных крайне важной.
Продемонстрировать современные схемы лечения для профилактики цереброваскулярных и сердечно-сосудистых осложнений у больных, перенесших инсульт, можно на следующем клиническом примере.
Женщина, 70 лет, не работает. Жалобы на периодические головокружения, снижение памяти, внимания, шаткость походки.
Анамнез настоящего заболевания: 1 год назад перенесла ИИ. Повышение АД в течение 8 лет, до инсульта получала фиксированную комбинацию эналаприла 10 мг с гидрохлоротиазидом 12,5 мг, на этом фоне АД стабильно на уровне 150/90—95 мм рт.ст. Однако беспокоил сухой кашель, поэтому антигипертензивная терапия была изменена — назначены атенолол в суточной дозе 50 мг и гидрохлоротиазид 12,5—25 мг. В настоящее время принимает атенолол в виде монотерапии в дозе 50 мг, АСК в дозе 75 мг на ночь.
Семейный анамнез не отягощен. Вредные привычки: не курит, никогда не курила, алкоголем не злоупотребляет.
Настоящее состояние: кожные покровы обычной окраски, влажности и эластичности. Периферических отеков нет. Индекс массы тела 22 г/м2. Перкуторно над всей поверхностью легких определяется ясный легочный звук. При аускультации дыхание везикулярное, хрипов нет. Частота дыхания 18 в минуту. Область сердца не изменена. Перкуторно: смещение левой границы относительной тупости сердца (расположена на 1 см кнаружи от левой среднеключичной линии). При аускультации тоны ясные, ритмичные, шумов нет. Пульс 64 уд/мин. Среднее АД (3 измерения на визите): 158/92 мм рт.ст. Живот не увеличен в объеме, при пальпации мягкий, безболезненный. Размеры печени по Курлову 9×8×7 см. Симптом поколачивания отрицательный с обеих сторон. Неврологический статус: контактна. Умеренные симптомы орального автоматизма. Легкая асимметрия оскала. Язык по средней линии. Легкая дизартрия. Легкий левосторонний гемипарез, больше выраженный в руке. Мышечный тонус повышен по спастическому типу. Асимметрия сухожильных рефлексов. Левосторонний адиадохокинез. Симптом Бабинского слева положительный. Левосторонняя гемигипестезия.
Данные дополнительных лабораторных и инструментальных методов исследования: общий анализ крови и мочи — без патологии. Биохимический анализ крови: креатинин 84 мкмоль/л, общий ХС — 5,6 ммоль/л, ХС ЛПН 2,6 ммоль/л, триглицериды 1,8 ммоль/л, ХС липопротеидов высокой плотности 0,9 ммоль/л, калий 4,2 ммоль/л, капиллярная глюкоза (натощак) 4,6 ммоль/л, аспартатаминотрансфераза 38 ед/л, аланинаминотрансфераза 40 ед/л, креатинфосфокиназа 110 ME, прямой билирубин 3,4 мкмоль/л.
Электрокардиограмма: ритм синусовый, правильный. Частота сердечных сокращений 59 уд/мин. Вертикальное положение электрической оси сердца.
Эхокардиография: камеры сердца не расширены. Клапанный аппарат интактен. Гипертрофия миокарда левого желудочка. Глобальная сократимость в норме. Нарушений локальной сократимости не выявлено. Нарушение диастолической функции левого желудочка по 1-му типу.
Консультация окулиста: ангиосклероз сосудов сетчатки.
Ультразвуковое исследование сонных и позвоночных артерий: гемодинамически незначимые стенозы обеих внутренних сонных артерий (сужение от 20 до 50%), утолщение интимы—медии. Патологическая извитость позвоночных артерий.
Магнитно-резонансная томография головного мозга: киста в правом полушарии головного мозга.
Показано следующее лечение. Антигипертензивная терапия: целевой уровень АД менее 140/90 мм рт.ст. (130—139/80—89 мм рт.ст.) [16]. Учитывая очень высокий риск развития сердечно-сосудистых осложнений — комбинированная антигипертензивная терапия, предпочтительнее — фиксированная комбинация антигипертензивных препаратов [16]. Ввиду наличия гипертрофии миокарда левого желудочка по данным эхокардиографии целесообразным представляется комбинация блокаторов ренин-ангиотензин-альдостероновой системы (БРА имеют преимущества в связи с отличной переносимостью, сопоставимой с плацебо) с тиазидным диуретиком или антагонистом кальция [16]. Кроме того, БРА, например валсартан, улучшают когнитивные функции, что очень важно в данной клинической ситуации. Темпы снижения АД: использовать ступенчатую схему [16]. При подборе дозировок антигипертензивных препаратов учитывать не только уровень АД, но и переносимость снижения АД.
Клопидогрел 75 мг один раз в сутки. Аторвастатин (40—80 мг) или розувастатин (20—40 мг), представляется целесообразным отдать предпочтение розувастатину в связи с более низким риском лекарственного взаимодействия. Необходимый целевой уровень ХС ЛПН — менее 1,8 ммоль/л, контроль безопасности (аспартатаминотрансфераза, аланинаминотрансфераза, креатинфосфокиназа, прямой билирубин) [44, 45].
Таким образом, современные возможности лечения больных, перенесших инсульт или ТИА, позволяют с оптимизмом смотреть в будущее, хотя, конечно, имеется необходимость дальнейших исследований. Правильное назначение антигипертензивной, антитромбоцитарной и гиполипидемической терапии позволит снизить риск развития повторного инсульта и сердечно-сосудистых осложнений у этой категории пациентов.



