L-карнитин (далее — карнитин) впервые выделен в 1905 г. из экстрактов мышечных тканей [1]. Это сделали сотрудники кафедры медицинской химии Московского университета профессор медицинской химии Владимир Сергеевич Гулевич (1867—1933) и физиолог, и биохимик, профессор Робертс Кримбергс (1874—1941). В.С. Гулевич и Р. Кримбергс назвали новое соединение карнитином, ссылаясь на источник его выделения (с латинского «carne» означает «плоть», «мясо»). В 1927 г. определили молекулярную формулу и показали, что карнитин – это γ-амино-β-окси-масляная кислота [2].
В природе биологическую активность и значение имеет только L-карнитин, а другой оптический изомер, D-карнитин, блокирует действие L-карнитина. Так как было установлено, что мышечная ткань содержит много карнитина, различные гипотезы выдвинуты о его роли в нормальной физиологии. В 40—50-е гг. XX века проведено много исследований по изучению роли карнитина в развитии насекомых, а в 1952 г. даже был сделан вывод, что карнитин — это витамин Bt, необходимый для развития червей и личинок [3, 4]. Однако предположение, что карнитин является витамином, оказалось ошибочным, так как в 1961 г. выяснилось, что карнитин появляется в организме в результате биосинтеза [5]. На протяжении многих лет карнитину приписывали всевозможные эффекты, в том числе стимуляцию аппетита и синтеза белка, способствование увеличению массы тела у недоношенных новорожденных и др. [6], однако множество из этих предположений не было подтверждено в клинических исследованиях.
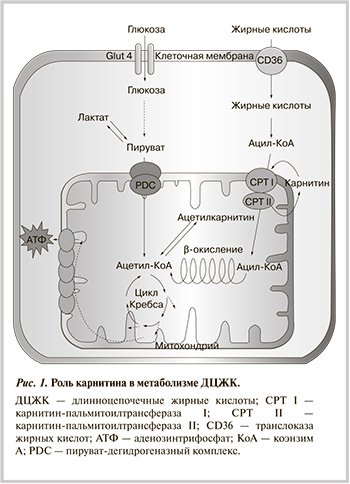 В 50—60-е гг. прошлого века была определена роль карнитина в метаболизме длинноцепочечных полиненасыщенных жирных кислот – ДЦЖК [7, 8], а также роль карнитин-пальмитоилтрансферазы и ацилкарнитиновых эфиров в транспорте ацильных групп ДЦЖК через мембраны митохондрий для осуществления β-окислении жирных кислот (ЖК) [9]. Кроме того, было установлено, что существует активный транспорт карнитина и то, что биопрекурсор карнитина γ-бутиробетаин конкурирует с карнитином [10, 11]. Были также выявлены и врожденные заболевания, связанные с нарушениями метаболизма карнитина или с недостаточной концентрацией карнитина, необходимой для нормальной работы мышечных тканей. Лишь в конце 90-х гг. была произведена молекулярная и функциональная идентификация переносчика карнитина OCTN2 человека [12], а совсем недавно определена структура фермента человека γ-бутиробетаингидроксилазы, синтезирующего карнитин [13].
В 50—60-е гг. прошлого века была определена роль карнитина в метаболизме длинноцепочечных полиненасыщенных жирных кислот – ДЦЖК [7, 8], а также роль карнитин-пальмитоилтрансферазы и ацилкарнитиновых эфиров в транспорте ацильных групп ДЦЖК через мембраны митохондрий для осуществления β-окислении жирных кислот (ЖК) [9]. Кроме того, было установлено, что существует активный транспорт карнитина и то, что биопрекурсор карнитина γ-бутиробетаин конкурирует с карнитином [10, 11]. Были также выявлены и врожденные заболевания, связанные с нарушениями метаболизма карнитина или с недостаточной концентрацией карнитина, необходимой для нормальной работы мышечных тканей. Лишь в конце 90-х гг. была произведена молекулярная и функциональная идентификация переносчика карнитина OCTN2 человека [12], а совсем недавно определена структура фермента человека γ-бутиробетаингидроксилазы, синтезирующего карнитин [13].
До сих пор активно проводятся исследования по оценке фармакологической активности и потенциальном применении карнитина и его производных соединений для лечения различных заболеваний [14], а также возможности регулирования системы карнитина для достижения кардиопротективного действия [15]. Результаты исследований карнитина противоречивы, так как одновременно показано его кардиопротективное действие [16] и участие в развитии атеросклероза [17].
Роль карнитина в энергетическом метаболизме клеток. Для получения энергии клетки мышц используют ЖК и углеводы. После попадания энергетических субстратов в клетку происходят специфические процессы катаболизма, в результате которых образуется общий метаболит — ацетилкоэнзим А (ацетил-КоА). Затем ацетил-КоА вступает в реакции цикла трикарбоновых кислот (Кребса) и последующие процессы дыхательной цепи митохондрий, в результате чего образуется энергия в виде АТФ. Карнитин является одним из факторов, который определяет интенсивность использования ДЦЖК, следовательно, и вклад ЖК в энергетический метаболизм клетки.
Мышцы не способны самостоятельно синтезировать карнитин, поэтому получают его из крови. На первом этапе катаболизма свободные ЖК активируются, образуя ацилкоэнзим А (ацил-КоА). Затем на внешней мембране митохондрий фермент карнитин-пальмитоилтрасфераза I (CPT I) присоединяет карнитин к ацил-КоА. В результате реакции образуется ацилкарнитин, который способен проходить сквозь мембрану митохондрии (рис. 1). Однако повышенная концентрация молекул активированных ДЦЖК (ацилкарнитины и ацил-КоА) в клетках вызывает снижение активности нескольких ферментов, тормозит транспорт АТФ из митохондрий в цитозоль и разобщает процессы окисления и фосфорилирования в дыхательной цепи митохондрий [18, 19]. Такая ситуация наблюдается, к примеру, в случае недостаточной оксигенации тканей.
Карнитин-пальмитоилтрансфераза II (СPT II) катализирует реакцию, обратную СPT I, т.е., внутри митохондрий из ацилкарнитина снова образует ацил-КоА, который затем в реакциях β-окисления расщепляется до ацетил-КоА. Стоит отметить, что СPT I катализируемая реакция является одной из стадий, определяющей скорость окисления ДЦЖК. Поэтому существенно снижая концентрацию карнитина, замедляется транспорт ДЦЖК в митохондрии и последующее β-окисление. В то же время ЖК с короткой цепью (C2—C8) могут пройти через мембрану митохондрий без помощи карнитина.
Карнитин регулирует как транспорт ДЦЖК в митохондрии, так и отношение ацетил-КоА/свободный КоА, и тем самым – активность пируватдегидрогеназного комплекса (PDС) [20]. При повышение отношения ацетил-КоА/свободный КоА активируется киназа PDС, которая затем фосфорилирует и инактивирует PDС. Такая ситуация создается, например при интенсивной физической нагрузке, когда в результате действия PDС, который окисляет пируват, образуется слишком много ацетил-КоА, который эффективно не может включаться в реакции цикла трикарбоновых кислот. Карнитин при помощи карнитинацетилтранферазы замещает КоА, образуя ацетилкарнитин. Таким образом, обеспечивается достаточное количество свободного ацетил-КоА, чтобы беспрепятственно могли проходить реакции PDС и цикла трикарбоновых кислот [21]. Это свидетельствует о значении карнитина не только в окислении ДЦЖК, но и в метаболизме углеводов. Можно сделать вывод, что система карнитина в организме играет важную роль в поддержании энергетического гомеостаза клеток.
Гомеостаз карнитина. В организме гомеостаз карнитина обеспечивается приемом пищи, биосинтезом, а также интенсивной реабсорбцией карнитина в проксимальных почечных канальцах [22]. В организме присутствует строго регулируемая система активного транспорта карнитина (рис. 2), благодаря которой концентрация карнитина в мышечной ткани (в том числе, в ткани сердца) в несколько десятков раз выше, чем в крови [23].
Основными пищевыми продуктами, содержащими карнитин, являются молочные продукты и мясо, особенно говядина. Малые количества карнитина содержатся также во многих других пищевых продуктах (рис. 3).
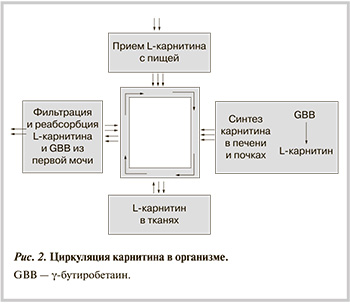 В почках и печени, а также в семенниках мужчин происходит биосинтез карнитина из лизина и метионина с образованием промежуточного продукта γ-бутиробетаина (GBB) [27]. Известно, что в случае не-вегетарианской диеты 1/4 необходимого карнитина синтезируется в организме, а остальные 3/4 человек получает из пищевых продуктов. Следует отметить, что у женщин и вегетарианцев концентрация карнитина в плазме примерно на 20% меньше, чем у мужчин в условиях невегетарианской диеты [28, 29]. Исследования показали, что скорость абсорбции L-карнитина в кишечнике ограничена, и, следовательно, биодоступность 1—6 г карнитина в случае приема внутрь составляет только 5—18%, а употребляя продукты, которые обычно содержат гораздо меньше L-карнитина, его биодоступность может достичь 75% [30].
В почках и печени, а также в семенниках мужчин происходит биосинтез карнитина из лизина и метионина с образованием промежуточного продукта γ-бутиробетаина (GBB) [27]. Известно, что в случае не-вегетарианской диеты 1/4 необходимого карнитина синтезируется в организме, а остальные 3/4 человек получает из пищевых продуктов. Следует отметить, что у женщин и вегетарианцев концентрация карнитина в плазме примерно на 20% меньше, чем у мужчин в условиях невегетарианской диеты [28, 29]. Исследования показали, что скорость абсорбции L-карнитина в кишечнике ограничена, и, следовательно, биодоступность 1—6 г карнитина в случае приема внутрь составляет только 5—18%, а употребляя продукты, которые обычно содержат гораздо меньше L-карнитина, его биодоступность может достичь 75% [30].
Таким образом, употребляя L-карнитин в качестве лекарственного средства для лечения дефицита карнитина или в качестве пищевой добавки, надо помнить, что будет поглощена лишь небольшая его часть, и благодаря эффективной работе переносчиков карнитина, основная его часть будет выведена вместе с мочой. В случае приема высоких доз карнитина (>6 г) ожидается выделение триметиламина через кожу (в виде пота), что сопровождается неприятным характерным рыбным запахом тела [31].
Kарнитин как пищевая добавка. Дополнительный прием карнитина в виде пищевой добавки является спорным вопросом. С медицинской точки зрения использование карнитина необходимо в случаях недостаточности, вызванной врожденными генетическими заболеваниями (например, мутации генов – переносчиков карнитина), приема некоторых лекарственных препаратов (например, вальпроевой кислоты в случае эпилепсии) или гемодиализа у больных почечной недостаточностью [32, 33].
В настоящее время все более распространенным становится использование карнитина в виде пищевых добавок и коктейлей в надежде, что увеличение концентрации карнитина в организме активирует метаболизм ЖК, а это будет способствовать снижению массы тале. Хотя недавно было показано, что увеличение концентрации карнитина в мышцах на 20% предотвратило увеличение массы тела, вызванное углеводной диетой [34], но клинические испытания достоверно не подтверждают эффективность использования карнитина для этого [35, 36].
Прием карнитина спортсменами не улучшает их физические качества: силу, выносливость, скорость. Неэффективность можно объяснить относительно небольшой биодоступностью карнитина в нормальных условиях, в результате чего карнитин не достигает митохондрий, где он мог бы активировать метаболизм ЖК.
Нормальный метаболизм ЖК обеспечивает энергией клетки сердца, поэтому эффекты карнитина изучались в экспериментальных и клинических исследованиях в области сердечно-сосудистых заболеваний (ССЗ) [14]. Тем не менее однозначного ответа относительно эффективности карнитина не удалось найти. Исследование CEDIM2 показало, что карнитин снижает смертность в течение первых 5 дней после острого инфаркта миокарда, однако не влияет на общую смертность за 6 мес [37]. Несмотря на то что результаты недавнего мета-анализа показали, что карнитин может снизить смертность у пациентов с острым инфарктом миокарда, нужны более крупные исследования и дополнительные данные, для объективной оценки кардиопротективного эффекта использования карнитина [16].
Аналогичным образом обстоит дело и с исследованиями по оценке эффективности применения карнитина при сахарном диабете (СД). Хотя некоторые исследования показали, что в плазме больных СД снижена концентрация карнитина [38, 39], другие исследования не подтвердили этих наблюдений [40—42]. Мы показали, что у больных СД повышенные концентрации карнитина коррелируют с более частыми осложнениями СД, такими как невропатия и артериальная гипертония [43]. Следует отметить, что многие исследования не изучали взаимосвязь эффектов с изменениями концентрации карнитина после его приема, поэтому нельзя сделать вывод о том, что наблюдаемые изменения действительно связаны с приемом карнитина.
Карнитин и атеросклероз. Влияние введения карнитина на развитие атеросклероза изучены в нескольких экспериментальных моделях. В 2001 г. показано, что введение карнитина замедляет развитие атеросклероза у кроликов, получавших пищу с высоким содержанием холестерина [44], так как концентрация карнитина в плазме крови не была измерена, неизвестно была ли она повышена.

За несколько последних лет опубликованы экспериментальные данные, согласно которым карнитин может быть связан с синтезом проатерогенных метаболитов в организме [17, 45]. Кишечные микроорганизмы, метаболизируя карнитин, синтезируют триметиламин (TMA) [46, 47], который затем в печени под действием флавинзависимой монооксигеназы (FМО) окисляется, образуя триметиламин-N-оксид (ТМАО). Предыдущие исследования показали, что повышенные концентрации ТМАО связаны с развитием атеросклероза и риском развития сердечно-сосудистых осложнений (ССО) [48, 49]. Кроме того, увеличение концентрации карнитина и ТМАО в плазме крови связано с повышенным риском развития ССЗ и увеличением числа случаев тяжелых ССО (смерть, инфаркт миокарда) [17].
Доказано, что у вегетарианцев концентрация карнитина ниже не только в плазме крови, но и в мышцах, в которых депонируется большинство карнитина организма [34].
Кроме того, концентрация ТМАО у вегетарианцев тоже значительно ниже, чем у всеядных людей, и кишечные микроорганизмы вегетарианцев в меньшей степени способны метаболизировать карнитин и холин, образуя ТМА/ТМАО [17]. Указанные результаты позволяют предположить, что сниженный риск развития ССЗ у вегетарианцев связан с пониженной концентрацией ТМАО. Это подтверждается результатами исследования, которые продемонстрировали, что у пациентов с более высокой концентрацией ТМАО в плазме наблюдался повышенный риск развития тяжелых ССО [50]. Групповые исследования EPIC-Оксфорд также показали, что вегетарианцы значительно реже госпитализировались в стационары, а риск смерти от ишемической болезни сердца у них был ниже, чем у невегетарианцев [51].
Концентрацию ТМАО в организме можно регулировать фармакологическим путем. Результаты экспериментальной модели атеросклероза показали, что антибиотики широкого спектра действия уменьшают образование ТМА, концентрацию ТМАО и атеросклеротические бляшки в кровеносных сосудах [17]. Однако предыдущие клинические испытания не оправдали ожиданий, при длительном применении антибиотиков не уменьшился атеросклероз и риск развития ССЗ. Следует отметить, что ингибитор биосинтеза и транспорта карнитина милдронат снижает не только концентрацию карнитина в плазме крови человека [52], но и уменьшает концентрацию ТМАО, которая повышалась на фоне диеты [53]. Милдронат — первый известный препарат, который способствует выведению ТМАО вместе с мочой (рис. 4).
Заключение
Для понимания того, какой подход к снижению уровня ТМАО был бы более эффективным для лечения атеросклероза и снижения риска развития ССО, необходимо проведение дальнейших исследований. В то же время пока продолжаются исследования, следовало бы применять пищевые добавки, содержащие высокие дозы карнитина с осторожностью.



