Дисплазия соединительной ткани — ДСТ (dis — нарушение; plasio — развитие) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах вследствие генетически измененного фибриллогенеза внеклеточного матрикса с нарушением процессов катаболизма и анаболизма соединительной ткани, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений локомоторных и висцеральных органов с прогредиентным течением [1].
 В любой системе организма развитие патологического процесса изменяет афферентное влияние на кардиовазомоторные центры, особенно, если имеются отклонения параметров внутренней среды организма (газового состава, электролитного равновесия и пр.), как, например, у пациентов с ДСТ [2]. Изменения регуляции сердца носят приспособительный характер, обеспечивая его гиперфункцию и кровообращения в целом, и направлены на устранение возникающих отклонений. На этом фоне происходят нарушения обмена веществ соответственно возросшей функции миокарда. Продолжительная гиперфункция миокарда в неблагоприятных условиях генетических дефектов чревата возникновением дефицита энергетических возможностей. Кроме того, наличие нарушений обмена кислорода при бронхолегочном синдроме и гипервентиляции при синдроме вегетососудистой дистонии, который в 80% наблюдается у пациентов с ДСТ, также вносит вклад в усугубление дефицита энергии [3]. Напряженное функционирование симпатического звена при ДСТ приводит к нарушению экономичности работы сердца, функционирующего в этих условиях с максимальной затратой энергии. Это ведет к нецелесообразному расходу ресурсов и истощению миокарда. Наличие клапанного синдрома у лиц с ДСТ способствует локальной или распространенной кардиомиопатии, которая также приводит к усугублению нарушений обмена веществ. Подобные изменения связаны с выраженной тракцией папиллярных мышц при пролабировании клапанного аппарата или натяжением аномальных хорд, препятствующих кровоснабжению миокарда. Присоединение регургитации при клапанном синдроме увеличивает нагрузку на миокард, сопровождающуюся усугублением энергетических расстройств.
В любой системе организма развитие патологического процесса изменяет афферентное влияние на кардиовазомоторные центры, особенно, если имеются отклонения параметров внутренней среды организма (газового состава, электролитного равновесия и пр.), как, например, у пациентов с ДСТ [2]. Изменения регуляции сердца носят приспособительный характер, обеспечивая его гиперфункцию и кровообращения в целом, и направлены на устранение возникающих отклонений. На этом фоне происходят нарушения обмена веществ соответственно возросшей функции миокарда. Продолжительная гиперфункция миокарда в неблагоприятных условиях генетических дефектов чревата возникновением дефицита энергетических возможностей. Кроме того, наличие нарушений обмена кислорода при бронхолегочном синдроме и гипервентиляции при синдроме вегетососудистой дистонии, который в 80% наблюдается у пациентов с ДСТ, также вносит вклад в усугубление дефицита энергии [3]. Напряженное функционирование симпатического звена при ДСТ приводит к нарушению экономичности работы сердца, функционирующего в этих условиях с максимальной затратой энергии. Это ведет к нецелесообразному расходу ресурсов и истощению миокарда. Наличие клапанного синдрома у лиц с ДСТ способствует локальной или распространенной кардиомиопатии, которая также приводит к усугублению нарушений обмена веществ. Подобные изменения связаны с выраженной тракцией папиллярных мышц при пролабировании клапанного аппарата или натяжением аномальных хорд, препятствующих кровоснабжению миокарда. Присоединение регургитации при клапанном синдроме увеличивает нагрузку на миокард, сопровождающуюся усугублением энергетических расстройств.
Следовательно, при ДСТ происходят динамические изменения обмена, функции и структуры миокарда как врожденного, так и приобретенного характера. Патогномоничных субъективных признаков возникающих изменений обмена веществ в миокарде не существует. Явления метаболической недостаточности миокарда у пациентов с ДСТ сопровождаются болями в сердце, астенизацией личности (раздражительностью, нарушением сна, плаксивостью), понижением артериального давления или реже повышением, снижением работоспособности и как следствие низким уровнем качества жизни (КЖ). Формирующаяся метаболическая кардиомиопатия при ДСТ, не имея специфических субъективных симптомов и клинических проявлений, определяет потенциально повышенный риск формирования аритмического синдрома и внезапной смерти в молодом возрасте у пациентов данной категории.
В связи с этим представляется патогенетически обоснованным применение препаратов, таких как цитопротектор милдронат, способного сохранять функциональную активность миокарда, повышать его жизнеспособность и в значительной степени ускорять восстановление функции миокарда [4].
 В многочисленных исследованиях милдронат продемонстрировал свой терапевтический потенциал в условиях тяжелых повреждений миокарда благодаря известным эффектам: восстановлению транспорта АТФ от митохондрии к цитозолю, торможению β-окисления жирных кислот, уменьшению потребности клеток в кислороде [5—7].
В многочисленных исследованиях милдронат продемонстрировал свой терапевтический потенциал в условиях тяжелых повреждений миокарда благодаря известным эффектам: восстановлению транспорта АТФ от митохондрии к цитозолю, торможению β-окисления жирных кислот, уменьшению потребности клеток в кислороде [5—7].
Цель исследования: оценить эффективность применения милдроната при восстановительном лечении пациентов с ДСТ.
Материал и методы
В исследование включены 240 пациентов с признаками ДСТ, из них 130 (54,16%) мужчин, в возрасте от 18 до 35 лет (средний возраст 24,4±7,6 года). В качестве группы контроля обследованы 50 практически здоровых лиц без признаков ДСТ, из них 26 (52%) мужчин, средний возраст в группе 21,34±2,24 года, сопоставимых по полу и возрасту с пациентами с ДСТ.
Критерии включения: возраст от 18 до 35 лет, признаки недифференцированной ДСТ, подписанное информированное согласие. Критерии исключения: наследственные синдромы патологии соединительной ткани у пациента и/или родственников, наличие острых или обострение хронических заболеваний внутренних органов, врожденных или приобретенных пороков сердца, прием препаратов с заведомо известной антиоксидантной активностью за 3 мес до исследования; указания на индивидуальную непереносимость исследуемого препарата; невозможность по каким-либо причинам участвовать в проспективном исследовании. Все пациенты были консультированы генетиком.
 Комплексное обследование включало детальное изучение субъективных жалоб, эхокардиографию (ЭхоКГ) на аппарате VIVID-4, проведение велоэргометрии (ВЭМ) по общепринятым методикам [8, 9], запись электрокардиограммы (ЭКГ) в 12 общепринятых отведениях. Для оценки КЖ использовали русифицированную версию опросника SF-36, апробированную в Институте клинико-фармакологических исследований Санкт-Петербурга. Субъективную оценку переносимости препарата оценивали с помощью визуальной аналоговой шкалы. Все пациенты с ДСТ получали милдронат по 5 мл 10% внутривенно 10 дней, затем внутрь по 1 капсуле (250 мг) 2 раза в день в течение 4 мес. Первичное и контрольное обследования проводили до начала лечения и через 4 мес в конце исследования на фоне лечения.
Комплексное обследование включало детальное изучение субъективных жалоб, эхокардиографию (ЭхоКГ) на аппарате VIVID-4, проведение велоэргометрии (ВЭМ) по общепринятым методикам [8, 9], запись электрокардиограммы (ЭКГ) в 12 общепринятых отведениях. Для оценки КЖ использовали русифицированную версию опросника SF-36, апробированную в Институте клинико-фармакологических исследований Санкт-Петербурга. Субъективную оценку переносимости препарата оценивали с помощью визуальной аналоговой шкалы. Все пациенты с ДСТ получали милдронат по 5 мл 10% внутривенно 10 дней, затем внутрь по 1 капсуле (250 мг) 2 раза в день в течение 4 мес. Первичное и контрольное обследования проводили до начала лечения и через 4 мес в конце исследования на фоне лечения.
Обработку полученных данных проводили в программе SPSS 13.00. В рамках параметрической статистики данные представляли как M±s (среднее±среднеквадратичное отклонение), в рамках непараметрической статистики — в виде медианы (интерквартильный размах). Статистическую обработку осуществляли с использованием метода Бернеса—Фишера — для проверки гипотезы о равенстве средних в выборке в зависимости от характера распределения, критерий ранговых знаков Вилкоксона — при сравнении числовых данных двух связанных групп, анализа таблиц сопряженности (точный двусторонний критерий Фишера, χ2). Статистически значимым считали различия при p<0,05.
Результаты
У большинства пациентов с ДСТ диагностированы признаки диспластикозависимых изменений нескольких органов и систем, как правило, 2—4 системы. Так, в 73% случаев наблюдалось сочетание костно-суставного синдрома с пролапсами митрального клапана, в 40% случаев деформации грудной клетки и позвоночника встречались вместе с гипермобильностью суставов (табл. 1).
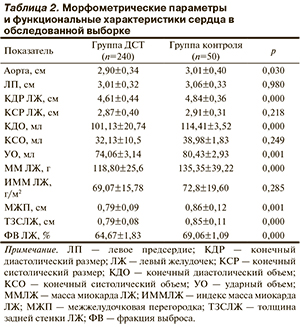
При оценке стандартных морфометрических и функциональных характеристик сердца, по данным ЭхоКГ, установлено, что количественные параметры, такие как масса миокарда левого желудочка (ММЛЖ), толщина задней стенки левого желудочка (ЗСЛЖ) и межжелудочковой перегородки (МЖП) в группе с ДСТ по сравнению с контролем были закономерно меньше, чем в группе контроля. Линейные размеры левого желудочка (ЛЖ), такие как конечный диастолический размер (КДР), были значимо меньше у лиц с ДСТ, чем в группе контроля, а конечный систолический размер (КСР) имел тенденцию к меньшему значению, при этом индексированные показатели, наоборот, превышали аналогичные в группе контроля. Схожие закономерности отмечены и для объемных показателей: меньшее значение конечного диастолического объема (КДО), тенденция к уменьшению конечного систолического объема (КСО) и ударного объема (УО). Фракция выброса (ФВ) была достоверна ниже в группе ДСТ (табл. 2).
 Большинство пациентов из группы ДСТ на момент включения в исследование предъявляли разнообразные жалобы: сердцебиение — 199 (82,9%), боль в области сердца — 56 (23,3%), перебои в работе сердца — 144 (60%), головокружение — 208 (86,7%). Абсолютное большинство пациентов отмечали плохую переносимость физической нагрузки в связи с утомляемостью — 176 (73,3%), Ощущения мелькание «мушек» перед глазами испытывали 88 (36,7%) пациентов, снижение настроения — 192 (80%), повышенную раздражительность — 163 (67,9%).
Большинство пациентов из группы ДСТ на момент включения в исследование предъявляли разнообразные жалобы: сердцебиение — 199 (82,9%), боль в области сердца — 56 (23,3%), перебои в работе сердца — 144 (60%), головокружение — 208 (86,7%). Абсолютное большинство пациентов отмечали плохую переносимость физической нагрузки в связи с утомляемостью — 176 (73,3%), Ощущения мелькание «мушек» перед глазами испытывали 88 (36,7%) пациентов, снижение настроения — 192 (80%), повышенную раздражительность — 163 (67,9%).
Маркером нарушений процессов метаболизма в миокарде у пациентов с ДСТ являлись изменения на ЭКГ в виде деформаций конечной части желудочкового комплекса — изменения зубца Т различного характера (инверсия, снижение) до косовосходящего смещения сегмента ST (не более 2 мм) [10].
По данным ЭКГ, у большинства пациентов группы исследования выявлялись изменения конечной части желудочкового комплекса, которые мы трактовали в аспекте метаболической кардиомиопатии. I степень нарушения реполяризации (увеличение амплитуды зубца T V2—4, синдром TV2>TV6 и укорочение сегмента ST) выявлялась у 133 (55,4%) пациентов; II степень (инверсия зубца Т, смещение сегмента ST в отведениях V2—V3 вниз от 0,5 до 1,0 мм) — у 101 (42,1%), III степень нарушений реполяризации (инверсия зубца Т, косовосходящее смещение сегмента ST до 2,0 мм) определялась реже — в у 6 из 240 (2,5%).
С целью оценки толерантности к физической нагрузке (ТФН) проведена ВЭМ. Согласно полученным данным, в группе ДСТ чаще регистрировалась низкая ТФН — у 161 (67,08%), у 79 (32,92%) констатирована средняя ТФН. По типу реакции на нагрузку пациенты с ДСТ характеризовались преобладанием дистонических реакций — 157 (65,41%), что согласуется с данными литературы [11, 12].
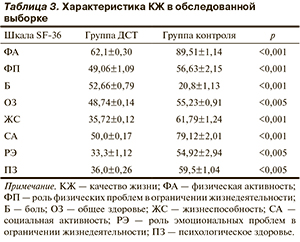
Анализ полученных данных по опроснику SF-36 показал, что у улиц из группы ДСТ по сравнению с контролем отмечается ухудшение КЖ вследствие боли, быстрой утомляемости и снижения работоспособности (ролевое физическое функционирование), что определило более негативное отношение к состоянию своего здоровья представителей данной группы исследования (табл. 3).
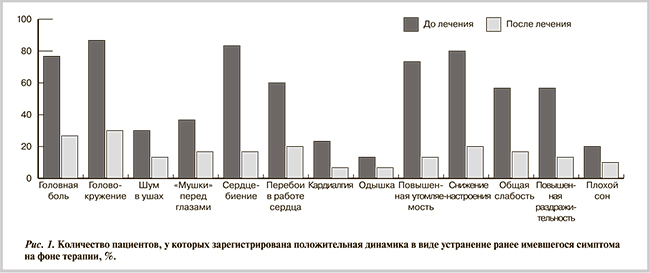
 Участие в клиническом исследовании завершили все 240 пациентов из группы ДСТ. Побочных явлений на фоне приема препарата за период наблюдения не зарегистрировано. Переносимость препарата большинством пациентов характеризовалась как хорошая и очень хорошая (средняя оценка 8,67 балла). Анализ субъективного статуса пациентов в конце периода наблюдения проводился исходя из критерия «устранение имевшегося на момент включения в исследование симптома — положительный эффект терапии» и продемонстрировал достоверные различия по абсолютному большинству параметров через 4 мес терапии (рис. 1).
Участие в клиническом исследовании завершили все 240 пациентов из группы ДСТ. Побочных явлений на фоне приема препарата за период наблюдения не зарегистрировано. Переносимость препарата большинством пациентов характеризовалась как хорошая и очень хорошая (средняя оценка 8,67 балла). Анализ субъективного статуса пациентов в конце периода наблюдения проводился исходя из критерия «устранение имевшегося на момент включения в исследование симптома — положительный эффект терапии» и продемонстрировал достоверные различия по абсолютному большинству параметров через 4 мес терапии (рис. 1).
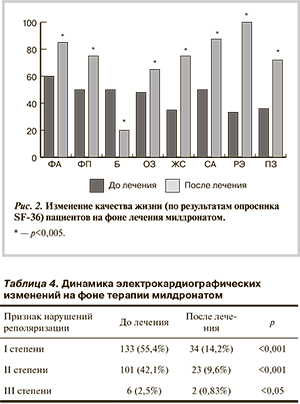
Положительная динамика отмечалась и при повторной оценке КЖ пациентов. Согласно опроснику SF-36, показатели, отражающие ролевое функционирование, имевшие у абсолютного большинства пациентов крайне низкие значения, на момент включения в исследование достигли максимальных значений. На фоне положительных сдвигов в физическом и психическом состоянии возросли показатель социального функционирования, самооценка пациентами своего здоровья (рис. 2).
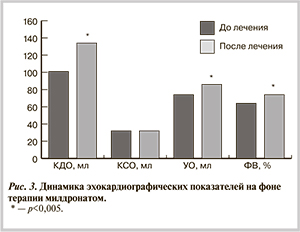
Полученные данные при оценке субъективного статуса пациентов подтверждались достоверным улучшением и объективных данных в ходе проведения повторных инструментальных исследований. Так, при повторном ЭхоКГ отмечалось статистически достоверное увеличение морфофункциональных показателей КДО и УО при сохранении КСО на прежнем уровне. Об уменьшении метаболической дисфункции в миокарде с повышением его энергетического потенциала можно судить по достоверному увеличению сократительной функции миокарда с повышением ФВ (рис. 3).
Таким образом, после длительного приема милдроната по сравнению с исходными данными отмечается улучшение насосной функции ЛЖ и повышение сократительной способности миокарда. Линейные показатели ЛЖ и их производные достоверно не отличались от исходных.
Положительное влияние милдроната на метаболизм миокарда зарегистрировано при повторной оценке изменений ЭКГ, которое проявилось в снижении частоты нарушений процессов реполяризации I степени (р<0,05) и II степени (р<0,05) (табл. 4).

С учетом полученных объективных и субъективных данных на заключительном этапе мы провели повторно ВЭМ для оценки ТФН, изучению реакции на нагрузку на фоне значительного улучшения функционального состояния миокарда, улучшения гемодинамики и общего самочувствия пациентов. Динамика показателей представлена в табл. 5.
Таким образом, применение препарата милдронат у пациентов с ДСТ эффективно корректирует метаболические изменения в миокарде, улучшает электрофизиологические показатели деятельности сердца (устраняет нарушения процессов реполяризации миокарда). Милдронат создает оптимальные условия для возникновения положительных гемодинамических сдвигов, которые способствуют увеличению функциональных резервов миокарда, повышения адаптационных возможностей сердечно-сосудистой системы. Данные положительные изменения позволяют купировать проявления астении (повышенная утомляемость, снижение работоспособности, снижение настроения, кардиалгии и т.д.), повысить ТФН. Все это имеет огромное значение для пациентов с ДСТ, так как позволяет им вести более активный образ жизни с возможностью изменения социальной занятости, повышением личной самооценки, что в итоге приводит к значительному улучшению КЖ. Позитивное клиническое и фармакологическое влияние милдроната позволяет рекомендовать его в виде курсовой терапии для восстановительного лечения у пациентов с ДСТ.



