История изучения атеросклероза и его клинических проявлений основана на исследованиях преимущественно мужского контингента больных. Ранее считалось, что инфаркт миокарда (ИМ) — удел мужчин, однако в пожилом возрасте половые различия по заболеваемости ИМ сглаживаются, а в более старшем возрасте наблюдается численное преобладание женщин [1], что связано с менопаузой и снижением у них защитной роли эстрогенов [2, 3]. Кроме того, неспецифичная симптоматика ишемической болезни сердца (ИБС) приводит к трудностям в диагностике сердечно-сосудистых заболеваний у женщин [4]. Вместе с тем женщинам в 2 раза реже, чем мужчинам, проводят катетеризацию сердца при остром коронарном синдроме (ОКС) [5], реже выполняют коронарную ангиопластику и аортокоронарное шунтирование, при ИМ реже назначают β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы кальциевых каналов [6—10]. Однако до сих пор отсутствуют убедительные данные о причинах такой «дискриминации». Окончательно не решен вопрос об эффективности тромболитической терапии (ТЛТ) у пожилых больных ИМ, среди которых преобладают женщины. Хотя в течение последних 20 лет ТЛТ является стандартом лечения острого ИМ со стойким подъемом сегмента ST, польза ТЛТ у пожилых пациентов продолжает оставаться темой дискуссий. С одной стороны, рандомизированные плацебо-контролируемые исследования, результаты которых являются основой существующих рекомендаций, демонстрируют снижение летальности при использовании ТЛТ у пожилых пациентов [11, 12]. С другой стороны, данные национальных наблюдательных регистров свидетельствуют или об отсутствии положительного эффекта ТЛТ [13, 14], или даже о его неблагоприятном влиянии на краткосрочную (30-дневную) выживаемость пациентов в возрасте 75 лет и старше [15].
Несмотря на существенное улучшение выживаемости пациентов с ИМ за последние десятилетия, более высокая летальность у женщин по сравнению с мужчинами независимо от выбранной тактики лечения является известным фактом [16]; в литературе имеются данные о том, что у женщин прогноз после перенесенного ИМ хуже, чем у мужчин [17]. В то же время проведены исследования, доказывающие, что пол не является независимым предиктором смертности после ИМ [18], а повышенная смертность женщин обусловлена бóльшим распространением у них факторов риска [19, 20].
Таким образом, до сих пор отсутствуют убедительные данные о клинической и прогностической значимости ОКС у женщин, недостаточно определены факторы неблагоприятных исходов у женщин и мужчин, отсутствует рациональная схема прогнозирования течения ОКС и алгоритма ведения пациентов с ОКС с позиций половых различий.
Цель настоящего исследования: оценка фармакоэпидемиологии ИМ, эффективность ТЛТ, определение факторов смерти в госпитальный и отдаленный периоды у женщин с ИМ.
Материал и методы
Сплошным методом выбраны истории болезни пациентов, проживающих в районе обслуживания городской поликлиники №3 г. Сыктывкара, которые были пролечены в ГУ РК «Кардиологический диспансер» с 2003 по 2009 г. с установленным диагнозом ИМ. Всего проанализировано 778 историй болезни, в том числе больных ИМ с подъемом ST — 446, ОКС без подъема ST с исходом в ИМ — 332. Доля мужчин составила 53,7%, средний возраст больных — 63,7±12,8 года. В регистр включены данные клинического осмотра при поступлении, результаты лабораторных и функциональных исследований, сведения о сопутствующих заболеваниях, осложнениях и исходах ИМ. Для оценки выживаемости больных в течение 8 лет после перенесенного ИМ использовали информацию кабинета статистики городской поликлиники №3 о дате и причине смерти пациента. Скорость клубочковой фильтрации (СКФ) вычисляли по формуле MDRD [21], стадию хронической болезни почек (ХБП) определяли в соответствии с классификацией 2002 г. [22].
Статистическую обработку данных проводили с использованием пакетов программ SPSS 13.0 и XLSTAT 2012. Применяли стандартные параметры описательной статистики. Проверку статистической гипотезы о нормальности распределения осуществляли с использованием критерия Шапиро—Уилка. Использованы методы статистического анализа: t-критерий Стьюдента, U-критерий Манна—Уитни или метод Колмогорова—Смирнова — с целью сравнения двух независимых групп по количественному признаку; z-критерий, критерий Фишера с двусторонней доверительной вероятностью и критерий Пирсона χ² с поправкой Йетса для анализа различия частот в двух независимых группах. Для выявления независимых факторов, связанных с развитием неблагоприятных событий в стационаре у мужчин и женщин, выполняли бинарный логистический регрессионный пошаговый анализ. Изучаемые факторы включали в многофакторный анализ в случае, если их связь с исходом имела уровень значимости р<0,05. Для оценки выживаемости пациентов с перенесенным ИМ использовали метод Каплана—Мейера и регрессионную модель пропорциональных рисков Кокса.
Результаты и обсуждение
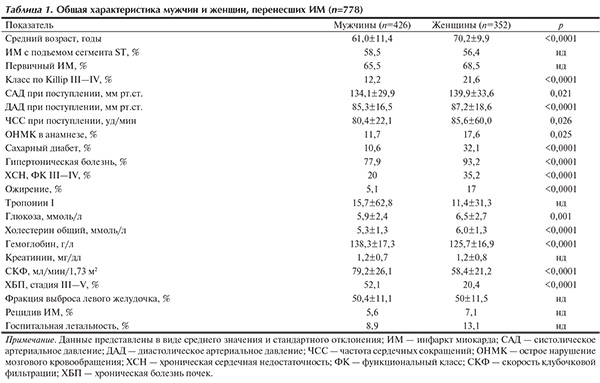
Общая характеристика пациентов по половому принципу представлена в табл. 1.

Женщины, перенесшие ИМ, были в среднем на 9 лет старше мужчин. По сравнению с мужчинами у них чаще встречались цереброваскулярные заболевания, сахарный диабет (СД), гипертоническая болезнь (ГБ), тяжелая хроническая сердечная недостаточность (ХСН), ХБП, ожирение. У женщин были более высокие уровни глюкозы и холестерина крови, сниженная СКФ. При поступлении у женщин отмечались более высокие уровни артериального давления (АД) и частота сердечных сокращений. Аналогичные результаты получены и в ряде других исследований.
ИМ с подъемом сегмента ST, а также первичный ИМ одинаково часто встречались в обеих группах. В то же время у женщин ИМ протекал более тяжело, чаще развивались острая левожелудочковая недостаточность и рецидив ИМ; уровень госпитальной летальности у женщин также был выше (р=0,078), чем у мужчин.
Вероятной причиной более высокой летальности у женщин по сравнению с мужчинами являются исходные различия в физиологии и патофизиологии развития острого ИМ, а также то, что в сравниваемых группах женщины обычно бывают старше мужчин по возрасту [16, 23]. Это отмечалось и в нашем исследовании; у женщин чаще развиваются осложнения в виде разрывов миокарда и геморрагических инсультов [24, 25].
Лечение мужчин и женщин с острым ИМ представлено в табл. 2.
Стандартную медикаментозную терапию получали обе группы больных ИМ, в то же время женщины реже получали ингибиторы АПФ, но чаще нуждались в диуретиках и антиаритмических препаратах, что обусловлено более частым наличием у них ХСН. Мужчинам чаще проводилась ТЛТ, однако различия не были статистически значимыми (p=0,091), чрескожное коронарное вмешательство с установкой коронарного стента в 3,3 раза чаще проводилось мужчинам, чем женщинам.
Для оценки связи различных факторов, определяемых при поступлении больных в стационар, со смертельным исходом во время пребывания в стационаре был проведен регрессионный анализ. Проанализировано значение каждого фактора, представленного в табл. 1. Неожиданно низкой оказалась прогностическая значимость тропонина (ОР=1,006 при 95% доверительном интервале — ДИ, р=0,26), фракции МВ-креатинфосфокиназы (ОР=1,0 при 95% ДИ, р=0,77), наличия зубца Q, ИМ, острого нарушения мозгового кровообращения и сахарного диабета в анамнезе, время начала лечения от появления симптомов и ряда других. Эти и другие показатели с низкой прогностической значимостью в отношении риска смерти в стационаре были исключены из дальнейшего анализа. Принадлежность к женскому полу с учетом других наиболее значимых параметров также показала низкую связь со смертельным исходом (ОШ=1,2 при 95% ДИ от 0,427 до 3,864; р=0,562). По результатам анализа определены независимые прогностические факторы смерти больных ИМ в стационаре (табл. 3).

Наиболее сильная связь со смертельным исходом ИМ установлена у таких показателей, как повышенный уровень креатинина, повышенный уровень глюкозы в крови, класс тяжести острой сердечной недостаточности по классификации Killip; менее выраженная связь выявлена с возрастом старше 75 лет. Старческий возраст и тяжесть течения ИМ являются классическими предикторами смерти в стационаре, что отражено в ряде прогностических шкал и клинических рекомендаций [26, 27].
Значение повышенного уровня креатинина и гипергликемии в качестве сильных независимых предикторов смерти больных ИМ также показано во многих исследованиях [28—30].
В отличие от других ранее проведенных исследований выявлено снижение риска смерти у больных с сопутствующей артериальной гипертензией (АГ), что можно объяснить несколькими причинами. В ряде исследований указывается на менее обширное поражение миокарда при развитии ИМ у пациентов с предшествующей АГ и на преимущественно концентрический тип постинфарктного ремоделирования у таких больных в отличие от пациентов с нормальным АД, у которых ремоделирование протекает преимущественно по эксцентрическому типу. У больных АГ увеличение размера постинфарктного рубца ассоциируется с возрастанием конечного диастолического объема и массы миокарда левого желудочка (ЛЖ), а у больных с нормальным АД — только с увеличением конечного диастолического объема [31]. АГ при скорригированном АД у больных острым ИМ не оказывает существенного отрицательного влияния на систолическую функцию ЛЖ, а при гипертрофии межжелудочковой перегородки даже поддерживает на высоком уровне фракцию выброса ЛЖ [32]. Можно предположить, что у пациентов с АГ миокард, «привыкший» к работе в условиях перегрузки давлением, быстрее ответит компенсаторной гипертрофией на увеличение напряжения, связанного с развитием ИМ (в основе такой «подготовленности» может быть активация систем, ответственных за синтез структурных белков), следовательно, уменьшится миокардиальный стресс и стимул для дилатации полости ЛЖ. Кроме того, предсуществующая гипертрофия миокарда является фактором, лимитирующим экспансию инфаркта и дилатацию полости ЛЖ. Возможно также, что гипертрофированные кардиомиоциты в условиях относительной недостаточности коронарного кровотока даже при интактных коронарных артериях становятся более «устойчивыми» к ишемии, и часть их не погибнет при острой коронарной катастрофе, а, возможно, перейдет в состояние оглушения, или гибернации, сохранив способность к восстановлению функции при адекватной перфузии [33]. Кроме того, при ИМ у больных АГ чаще формируется потенциально жизнеспособный миокард, а в более позднем периоде у лиц с АГ происходит частичное превращение потенциально жизнеспособного миокарда в нормально функционирующий, чего не наблюдается у пациентов без АГ.
Для оценки отдаленного прогноза после перенесенного ИМ у мужчин и женщин проведен анализ 8-летней выживаемости с использованием метода Каплана—Мейера, при этом выявлено статистически значимое снижение отдаленной выживаемости у женщин (р<0,001) (см. рисунок).
 Для более точного определения влияния различных факторов, в том числе женского пола, на развитие смертельного исхода в отдаленный период после перенесенного ИМ была построена регрессионная модель пропорциональных рисков Кокса. В модель последовательно были включены все параметры, перечисленные в табл. 1. При повторной оценке факторов, установленных ранее в качестве предикторов госпитальной летальности, выявлено, что некоторые из них не влияют на риск отсроченной смерти больных ИМ: уровень глюкозы (ОР=1,037 при 95% ДИ от 0,99 до 1,087; р=0,126) и наличие ГБ (ОР=1,071 при 95% ДИ от 0,68 до 1,68; р=0,766). В течение первого года наблюдения после перенесенного ИМ скорригированная АГ оказывает отрицательное влияние на дальнейшее течение ИБС, степень которого зависит от вида гипертрофии мышцы сердца и дилатации полости ЛЖ [32]. Принадлежность к женскому полу с поправкой на другие значимые факторы также не повышала риск смерти в отдаленный период (ОР=0,832 при 95% ДИ от 0,610 до 1,134; р=0,244). В табл. 4 представлены наиболее значимые параметры, определяющие отдаленную летальность больных ИМ.
Для более точного определения влияния различных факторов, в том числе женского пола, на развитие смертельного исхода в отдаленный период после перенесенного ИМ была построена регрессионная модель пропорциональных рисков Кокса. В модель последовательно были включены все параметры, перечисленные в табл. 1. При повторной оценке факторов, установленных ранее в качестве предикторов госпитальной летальности, выявлено, что некоторые из них не влияют на риск отсроченной смерти больных ИМ: уровень глюкозы (ОР=1,037 при 95% ДИ от 0,99 до 1,087; р=0,126) и наличие ГБ (ОР=1,071 при 95% ДИ от 0,68 до 1,68; р=0,766). В течение первого года наблюдения после перенесенного ИМ скорригированная АГ оказывает отрицательное влияние на дальнейшее течение ИБС, степень которого зависит от вида гипертрофии мышцы сердца и дилатации полости ЛЖ [32]. Принадлежность к женскому полу с поправкой на другие значимые факторы также не повышала риск смерти в отдаленный период (ОР=0,832 при 95% ДИ от 0,610 до 1,134; р=0,244). В табл. 4 представлены наиболее значимые параметры, определяющие отдаленную летальность больных ИМ.
Независимыми предикторами отдаленной смертности больных, перенесших ИМ, независимо от половых признаков, являются возраст, тяжесть течения ИМ (класс по Killip) и дисфункция почек.
Таким образом, несмотря на очевидное, на первый взгляд, ухудшение прогноза ИМ у женщин, при проведении многофакторного анализа с учетом других отягчающих факторов у больных женского пола не выявлено увеличения риска госпитальной и отсроченной смертности. Наибольшая прогностическая значимость в отношении неблагоприятного исхода ИМ, независимо от половой принадлежности пациентов, установлена для таких факторов, как возраст, тяжесть течения ИМ, выраженность дисфункции почек; в острый период ИМ, кроме перечисленных факторов, выявлено неблагоприятное влияние гипергликемии и протективная роль предшествующей ГБ.
Выводы
Женщины с инфарктом миокарда были старше мужчин; у них достоверно чаще выявлялись тяжелые сопутствующие заболевания и нарушения жирового обмена, отмечались более высокие уровни артериального давления и частота сердечных сокращений, более тяжелое течение инфаркта миокарда.
Женщины реже получали ингибиторы ангиотензинпревращающего фермента, но чаще нуждались в противоаритмической и диуретической терапии; им реже проводились чрескожные коронарные вмешательства со стентированием коронарных сосудов.
При проведении многофакторного анализа у женщин не выявлено увеличения риска смерти в стационаре и в отдаленный период после инфаркта миокарда.



