Известно, что риск смерти в результате инфаркта миокарда (ИМ) у больных сахарным диабетом (СД) значительно выше, чем у лиц без нарушения углеводного обмена [1, 2]. По данным регистра GRACE (The Global Registry of Acute Coronary Events), у больных с ранее установленным диагнозом СД госпитальная смертность от ИМ с подъемом сегмента ST, ИМ без подъема сегмента ST и нестабильной стенокардии составляет соответственно 11,7, 6,3 и 3,9%. Эти показатели значительно выше, чем у больных без СД — 6,4, 5,1 и 2,9% [3]. Повышенный риск смерти, отмеченный у больных СД в остром периоде ИМ, сохраняется на протяжении последующих нескольких лет. Смертность в течение первого года после ИМ у больных СД составляет 12—30% и достигает 45% в течение последующих 5 лет [1, 4, 5]. В странах, достигших значительных успехов в лечении острого коронарного синдрома, больные СД являются в настоящее время единственной группой населения, в которой смертность от этой болезни снижается незначительно среди мужчин и увеличивается среди женщин [2, 4]. Неблагоприятный прогноз у этих больных связывают с рецидивирующей ишемией миокарда, дисфункцией левого желудочка, развитием тяжелой сердечной недостаточности, электрической нестабильностью миокарда, повторными ИМ, инсультами.
Данные литературы последних лет указывают на высокий риск развития сердечно-сосудистых заболеваний и смерти от них не только при СД, но и при латентно протекающих расстройствах углеводного обмена, включая нарушение толерантности к глюкозе (НаТГ) [6—8]. Ряд клинических исследований свидетельствует о высокой частоте диагностики ранних расстройств углеводного обмена у пациентов с острым коронарным синдромом. Так, исследование GAMI (Glucose Tolerance in Patients with Acute Myocardial Infarction) первым указало на высокий процент лиц с ранее неизвестной аномальной толерантностью к глюкозе — АТГ (включая НаТГ и впервые выявленный по результатам теста на толерантность к глюкозе СД) среди больных острым инфарктом миокарда (ОИМ) и показало, что эти метаболические расстройства коррелируют с повышенным риском развития сердечно-сосудистых осложнений (ССО) в постинфарктном периоде [9].
Воздействие вновь выявленных нарушений углеводного обмена на долгосрочный прогноз у больных с ОИМ мало освещено в литературе. Цель данной работы состояла в изучении клинических исходов ОИМ и ССО при длительном наблюдении у лиц с впервые выявленным НаТГ.
Материал и методы
В исследование включили 391 больного с ОИМ, последовательно поступивших в Клинику кардиологии за период с января 2007 г. по декабрь 2008 г. и переживших период госпитализации. Протокол исследования одобрен этическим комитетом Клиники кардиологии Кишинева. Всеми пациентами подписана форма информированного согласия на участие в исследовании.
Диагноз ОИМ выставляли согласно критериям Европейского общества кардиологов (2008 г.) с учетом клинических, электрокардиографических признаков, а также уровня в крови маркеров некроза миокарда. Пациента считали больным СД при наличии установленного ранее диагноза, при приеме им сахароснижающих средств, а также при повторном определении уровня базальной гликемии >7,0 ммоль/л за время госпитализации. Лечение ОИМ проводили в соответствии с Национальными клиническими рекомендациями (ангиопластика, тромболитическая и антиагрегантная терапия, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, статины). Всем пациентам без СД перед выпиской из больницы (в среднем на 12-й день) провели пероральный тест на толерантность к глюкозе (ПТТГ, или нагрузочный тест с 75 г глюкозы). Результат ПТТГ оценивали по критериям ВОЗ (2006 г.), согласно которым, нормальная толерантность к глюкозе (НТГ) соответствует уровню глюкозы натощак <6,1 ммоль/л и через 2 ч после нагрузки <7,8 ммоль/л, НаТГ диагностируется при показателях тощаковой глюкозы <7,0 ммоль/л и после нагрузки — в пределах 7,8 ммоль/л и 11,0 ммоль/л, в то время как постнагрузочная (2 ч) гипергликемия ≥11,1 ммоль/л указывает на впервые выявленный СД (ВВСД). НаТГ и ВВСД объединили общим термином АТГ. В зависимости от гликемического статуса больных разделили на 3 группы: 1-я — НТГ, 2-я — АТГ, 3-я — лица с ранее известным СД.
При выписке всем больным были даны рекомендации относительно режима физической активности, диеты, коррекции факторов риска и в отсутствие противопоказаний назначены антиагреганты (ацетилсалициловая кислота, клопидогрел или их комбинация), β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, статины. Больным СД назначали также сахароснижающую терапию и контроль уровня глюкозы крови. Пациентам с АТГ рекомендовали изменение образа жизни, коррекцию факторов риска, снижение избыточной массы тела, регулярные физические нагрузки. Продолжительность наблюдения составила 26,8±6 мес, на протяжении которых регистрировали общую и сердечно-сосудистую смертность, а также повторный нефатальный ИМ, острое нарушение мозгового кровообращения, сердечную недостаточность > II класса по NYHA, случаи коронарной реваскуляризации, повторные госпитализации по поводу ССО.
Статистическую обработку полученных данных проводили с использованием t-критерия Стьюдента, критерия χ2 по Пирсону, точного критерия Фишера. При множественном сравнении использовали однофакторный дисперсионный анализ ANOVA. Результаты представлены в виде средних значений и стандартной ошибки среднего (M±m). Качественные признаки представлены в виде абсолютных (n) и относительных (%) чисел. Оценку выживаемости осуществляли с помощью метода Каплана—Мейера; при сравнении равенства выживаемости использовали логарифмический ранговый критерий. Различия считали статистически значимыми при p<0,05.
Результаты
Из общего числа больных ОИМ, включенных в исследование, у 95 (24,3%) имелся СД. Лицам без СД (n=296) перед выпиской из больницы провели ПТТГ, с помощью которого определили НТГ у 201 (67,9%) и выявили АТГ — у 95 (32,1%) пациентов (в том числе у 28,7% лиц — НаТГ и у 3,4% — ВВСД). Таким образом, у каждого третьего пациента с ОИМ без СД выявили клинически скрытое нарушение углеводного обмена.

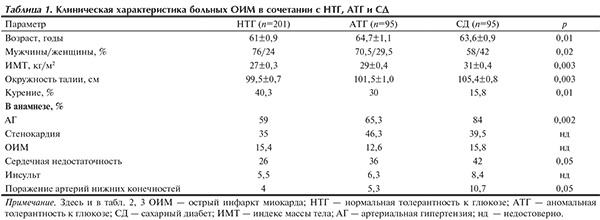
Больные с нарушениями углеводного метаболизма были старше лиц с НТГ (p=0,01), в то время как пациенты с АТГ и с СД не различались по возрасту. В группе больных СД женщин было достоверно больше, чем в остальных двух группах (p=0,02). У пациентов с нарушениями углеводного обмена чаще определялся абдоминальный тип ожирения, их показатели индекса массы тела и окружности талии были значимо выше, чем у лиц с НТГ. У пациентов с СД достоверно чаще наблюдали артериальную гипертонию, поражение периферических артерий, сердечную недостаточность (СН) в анамнезе, у больных с НТГ и АТГ распространенность факторов риска и сопутствующих заболеваний существенно не различалась (табл. 1).
Процентное соотношение ИМ с зубцом Q и без такового, а также распределение локализации очага некроза и его размер (по уровню маркеров некроза миокарда в крови) не различались значимо в 3 изученных группах. По клинической характеристике и особенностям течения ОИМ лица с АТГ занимали промежуточное положение между больными с НТГ и с СД; все же, по целому ряду параметров они больше напоминали последних. Так, у пациентов с нарушениями углеводного обмена чаще диагностировали СН >II класса по классификации Killip при поступлении, наблюдали прогрессирование хронической СН в период пребывания в стационаре и констатировали более высокий процент лиц с СН >II класса по NYHA при выписке по сравнению с больными с НТГ. По данным эхокардиографии, СД и АТГ ассоциировались с достоверно более низкой фракцией выброса, расширением левого предсердия и более частым развитием аневризмы левого желудочка.
У пациентов с АТГ и у лиц с СД отмечена сходная тенденция отклонений лабораторных показателей. По сравнению с больными с НТГ у субъектов с АТГ констатировали более высокие уровни глюкозы в крови при поступлении, натощак перед выпиской и посленагрузочной гликемии по данным ПТТГ (p=0,001), а также определяли повышенные уровни триглицеридов крови (p=0,04).
Лечение ОИМ было сопоставимо в изученных 3 группах, за исключением фуросемида, который назначали достоверно чаще у больных с нарушениями углеводного обмена в связи с более частым развитием у них СН (табл. 2).

Анализ ССО за период постинфарктного наблюдения не выявил различий между изученными группами по частоте развития нефатального ИМ и инсульта. Число лиц с признаками СН >II класса по NYHA, а также случаев госпитализации в связи с ССО было достоверно больше среди больных с нарушениями углеводного обмена. Последние несколько чаще нуждались в реваскуляризации миокарда (табл. 3). У 15,6% субъектов с АТГ за время наблюдения был установлен клинический диагноз явного СД.
Показатели общей и сердечно-сосудистой смертности при длительном наблюдении у лиц с СД и АТГ были значительно выше, чем у пациентов с НТГ (27,4, 22,1 и 11,4% соответственно; p=0,002 и 23,2, 20,2 и 10,1% соответственно; p<0,05) (см. табл. 3).
Кумулятивный анализ выживаемости больных с НТГ, АТГ и СД после перенесенного ОИМ установил достоверные различия между группами. Ход кривых выживаемости статистически значимо различался у больных с нарушениями углеводного обмена и без таковых (см. рисунок). Так, в течение первого года после ОИМ выживаемость у больных с НТГ составила 94% против 87,4 и 86,3% у лиц с АТГ и с СД соответственно (p=0,01).
К концу исследования выживаемость больных с нарушениями углеводного обмена была статистически значимо ниже, чем у пациентов без таковых (72,6, 78 и 88,6% соответственно; p=0,003). Влияние латентных нарушений углеводного обмена на отдаленный прогноз у больных ОИМ сопоставимо с влиянием на него СД.
Обсуждение
Представленные в настоящем исследовании данные свидетельствуют о том, что у пациентов с ОИМ даже в отсутствие в анамнезе СД высока частота выявления нарушений углеводного обмена. Использование в госпитальном периоде ПТТГ позволило выявить латентные нарушения метаболизма углеводов у 32,1% больных. Таким образом, в обследованной нами популяции последовательно поступивших в клинику больных с ОИМ у каждого второго выявили нарушения углеводного обмена (в том числе у 24,7% — СД и у 21% — АТГ), а у каждого третьего пациента без СД установили наличие предиабета.
У 85% субъектов с АТГ уровень базальной гликемии находился в пределах нормы и только у 15% из них определили нарушение уровня глюкозы в крови натощак. Следовательно, без использования ПТТГ большинство больных с АТГ остались бы невыявленными. Этот факт еще раз доказывает целесообразность и клиническое значение ПТТГ в ранней диагностике нарушений углеводного обмена по уровню постнагрузочной гликемии у больных ОИМ. Данные литературы свидетельствуют о том, что постнагрузочная гипергликемия имеет большую прогностическую значимость в отношении общей и сердечно-сосудистой смертности, чем уровень базальной гликемии [8]. Высокая вероятность ССО в постинфарктном периоде у больных с НаТГ, а также повышенный риск развития у них СД подчеркивают значение и важность раннего выявления этих лиц в целях проведения адекватных агрессивных профилактических вмешательств.
Ряд исследований последних лет, начиная с GAMI в Швеции, за которым последовали другие в разных регионах мира, продемонстрировали высокую частоту (до 70—75%) впервые выявленных нарушений углеводного обмена среди больных ОИМ [9]. Европейское многоцентровое исследование Euro Heart Survey on Diabetes and the Heart показало, что среди пациентов с острой коронарной патологией у 36% имелось НаТГ и у 22% — вновь выявленный СД [10]. В обследованной нами группе последовательно госпитализированных больных с ОИМ процент лиц с впервые выявленными латентными нарушениями углеводного обмена несколько ниже, чем по данным, представленным одними авторами [9, 11—14], но сопоставимы с показателями других исследователей [15, 16]. Одним из объяснений могли бы быть некоторые различия в клинических характеристиках обследованных групп больных (включение последовательно госпитализированных больных или отбор пациентов по определенным четким критериям и показаниям) и протоколов исследования (сроки проведения ПНТГ). В то же время нельзя исключить возможные регионарные и этнические особенности распространения нарушений углеводного обмена.

Прогноз у пациентов с ОИМ и нарушениями углеводного обмена. Полученные в настоящем исследовании результаты позволяют утверждать, что выявленное на 12-е сутки ОИМ НаТГ оказывает столь же важное влияние на прогноз, как и ранее известный СД. Самую высокую смертность после ОИМ за время наблюдения определили среди больных с нарушениями углеводного обмена и, что особенно важно, этот показатель у пациентов с АТГ не отличался значимо от такового у лиц с ранее известным СД (22,1 и 27,4% соответственно). Таким образом, влияние латентных нарушений углеводного обмена на отдаленный прогноз у больных ИМ сопоставимо с влиянием на него СД. Летальность пациентов с гликемическими нарушениями была достоверно выше, чем у лиц с НТГ. При длительном наблюдении после перенесенного ИМ в изученной группе больных констатирована более высокая частота развития ССО у лиц с нарушениями углеводного обмена в сравнении с пациентами без таковых. Если частота развития повторного ИМ и инсульта не различалась в изучаемых группах, то наличие застойной СН и случаи повторных госпитализаций по сердечно-сосудистой причине наблюдали статистически значимо чаще у больных с СД и АТГ.
Данные литературы, включая результаты крупных исследований, указывают на высокий риск развития ССО у больных СД после перенесенного ОИМ [2—5]. Незначительное количество публикаций посвящено долгосрочному постинфарктному прогнозу субъектов с НаТГ, но в большинстве из них авторы указывают на неблагоприятный прогноз у пациентов этой категории. Исследователи из Швеции сообщили, что за 34 мес наблюдения все случаи смерти по сердечно-сосудистой причине были зарегистрированы у больных с НаТГ и ВВСД [9]. К. Таmitа и соавт. указывают на высокий риск развития тяжелых ССО на протяжении 5 лет наблюдения у пациентов с АТГ и СД. Они установили, что за указанный период времени число лиц без ССО среди пациентов с НаТГ было достоверно меньше, чем среди с НТГ (70 и 87% соответственно; p=0,0085) и не отличался от такового у больных с ранее установленным СД (p=0,09) [11].
Наши данные сопоставимы с результатами других исследований и достоверно указывают на то, что у лиц без СД с посленагрузочной гипергликемией имеется повышенный риск развития сердечно-сосудистых заболеваний и смерти от них после перенесенного ОИМ. Кумулятивный анализ выживаемости установил значимо более низкую долю выживших за время наблюдения среди больных с АТГ и СД в сравнении с пациентами с НТГ, что наглядно представлено характером кривых Каплана—Мейера.
НаТГ, характеризующееся посленагрузочной гипергликемией, сочетается, как правило, с инсулинорезистентностью, ожирением, дислипидемией, артериальной гипертонией и, по-видимому, у пациентов с ОИМ оказывает многофакторное влияние, связанное с воспалительным ответом, оксидантным стрессом и снижением прокоагулянтной защиты, обусловливая тем самым высокий риск развития ССО.
Заключение
Таким образом, латентные расстройства углеводного обмена имеют достаточно высокую распространенность у больных острым инфарктом миокарда. Нарушение толерантности к глюкозе и впервые выявленный сахарный диабет являются прогностически значимыми факторами риска развития сердечно-сосудистых осложнений и неблагоприятного клинического исхода в постинфарктном периоде. Ранняя диагностика латентных форм нарушений углеводного обмена предоставляет дополнительную информацию относительно прогноза больного острым инфарктом миокарда и может способствовать оптимизации мероприятий вторичной профилактики.



