Артериальная гипертония (АГ) является доминантным фактором риска развития сердечно-сосудистых заболеваний (ССЗ), которые служат причиной почти 50% всей смертности населения в Российской Федерации и большинстве западных стран. В современном обществе наблюдается значительная распространенность АГ, составляющая, по данным зарубежных исследований, 30—45% среди взрослого населения. В российской популяции распространенность АГ среди мужчин несколько выше, в некоторых регионах она достигает 47%, составляя среди женщин около 40% [1]. Число пациентов с повышенным артериальным давлением (АД) увеличивается с возрастом. Согласно статистическому отчету Американской ассоциации сердца (American Heart Association) от 2015 г., более 75% населения в возрасте старше 40 лет имеют повышенный уровень АД (65% в возрасте 40—59 лет и 84% в возрасте 60 лет и старше). Более того, только 60% американцев достигают хорошего контроля АД [2]. По данным голландского исследования, включившего 22 165 пациентов (средний возраст 54 года) с ССЗ, только у 69% из них систолическое АД (САД) было менее 140 мм рт.ст. [3]. Все это делает актуальным поиск путей увеличения охвата антигипертензивной терапией пациентов, страдающих АГ, и повышения эффективности этой терапии. Кроме того, в последние годы широко обсуждается перспектива уменьшения целевых уровней АД. Данные исследования SPRINT продемонстрировали преимущества снижения САД менее 120 мм рт.ст. у пациентов без предшествующего инсульта и сахарного диабета [4]. Несмотря на то что большинство экспертов сходится во мнении, что более обоснованной для САД является цель менее 130 мм рт.ст. [5, 6], даже ее достижение потребует переосмысления тактики ведения пациентов этой категории. В комментариях к результатам исследования SPRINT его руководитель G. Thomas утверждает, что для более интенсивного контроля САД потребуется большее количество лекарственных препаратов и, как следствие, увеличивается вероятность побочных эффектов, проблем с непереносимостью препаратов, полипрагмазии и потенциального несоблюдения режима лечения из-за возрастающей сложности схем [7]. В этом контексте особое значение приобретает использование в широкой клинической практике фиксированных комбинаций антигипертензивных препаратов (ФКАП). Очевидными преимуществами начала терапии с комбинации является высокая вероятность быстрого достижения целевого АД без потери приверженности при многочисленных сменах препаратов [8, 9]. Опросы показывают, что пациенты, получающие комбинированную терапию, реже отказываются от лечения, чем больные, которым была назначена любая монотерапия [10]. По данным мета-анализа S. Bangalore и соавт., ФКАП уменьшает риск несоблюдения режима приема терапии на 26% в сравнении со свободной комбинацией лекарственных средств [11]. Кроме того, наличие ФКАП уменьшает вероятность назначения нерациональных сочетаний. Рекомендация по предпочтительному использованию лекарственных форм, содержащих фиксированные дозы двух антигипертензивных препаратов, получила достаточно высокий класс доказанности — IIb B [12].
В Европейском руководстве по профилактике ССЗ в клинической практике 2016 г. говорится о приоритетном влиянии на прогноз снижения АД как такового, над специфическим эффектом тех или иных классов препаратов и необходимости использования комбинированной терапии у большинства пациентов с АГ как о «ключевых» позициях современной профилактической стратегии [13].
Наиболее часто применяемой комбинацией в нашей стране является сочетание блокатора ренин-ангиотензин-альдостероновой системы (РААС) и диуретика, в основном гидрохлоротиазида [14, 15]. Однако относительно недавно на отечественном фармацевтическом рынке появилась комбинированная форма блокатора рецепторов к ангиотензину II и тиазидоподобного диуретика хлорталидона (ХТ). Азилсартана медоксомил, входящий в эту комбинацию, продемонстрировал выраженный антигипертензивный эффект по сравнению как с плацебо, так и с другими препаратами этого класса. G. Bakris и соавт. [16] опубликовали первое исследование по оценке антигипертензивной эффективности и безопасности этого сартана в 2011 г. В плацебо-контролируемое исследование включили 1275 пациентов, которые были рандомизированы в группу приема плацебо, 20, 40 или 80 мг азилсартана медоксомила в день или 40 мг олмесартана в день в течение 6 нед. Среднесуточное САД, измерявшееся с помощью амбулаторного суточного мониторирования АД (СМАД), значительно снижалось во всех группах азилсартана (на 12,2, 13,5 и 14,6 мм рт.ст. соответственно) и в группе олмесартана 40 мг (на 12,6 мм рт.ст.). Снижение было статистически значимо большим при приеме 80 мг азилсартана, чем при приеме 40 мг олмесартана (p=0,038), в то время как эффект 40 мг азилсартана не уступал эффекту 40 мг олмесартана. Статистическое сравнение профилей безопасности в этом исследовании не проводилось.
В еще одном двойном слепом рандомизированном плацебо-контролируемом исследовании [17] азилсартана медоксомил сравнивался с олмесартаном и валсартаном. Были рандомизированы 1285 пациентов к приему плацебо, 40—80 мг азилсартана, 40 мг олмесартана или 320 мг валсартана в день в течение 6 нед. Значимость этому исследованию придает то, что в качестве первичной конечной точки в нем было выбрано среднесуточное САД, скорректированное по плацебо. Оно снижалось при приеме азилсартана на 14,3 мм рт.ст. Валсартан и олмесартан продемонстрировали меньшее снижение среднесуточного САД: на 10,0 мм рт.ст. (p<0,001) и 11,7 мм рт.ст. (p=0,009) соответственно. Важно, что в другом исследовании статистически значимое преимущество в снижении САД при лечении азилсартана медоксомилом 40 и 80 мг по сравнению с валсартаном 320 мг было достигнуто уже ко 2-й неделе терапии [18].
Безопасность и эффективность азилсартана (20—40 мг) также сравнивались с кандесартаном (8—12 мг) в 16-недельном рандомизированном контролируемом исследовании (РКИ), включавшем 622 пациента [19]. Результаты показали статистически значимо большее снижение АД у пациентов, принимавших азилсартан (на 12,4 мм рт.ст. диастолического АД — ДАД и 21,8 мм рт.ст. САД), по сравнению с пациентами, получавшими кандесартан (на 9,8 мм рт.ст. ДАД и 17,5 мм рт.ст. САД). Эти исследования АД в положении пациентов сидя были в дальнейшем подтверждены данными СМАД. Самым частым побочным эффектом в обеих группах являлся назофарингит (18 и 16% пациентов). Профили безопасности были сопоставимы в обеих группах лечения.
Вопрос о применении азилсартана медоксомила у пациентов с хронической болезнью почек (ХБП) изучался в специальном исследовании [20]. R. Preston и соавт. показали, что не требуется коррекции дозы у пациентов с легкой, умеренной и даже тяжелой ХБП при назначении азилсартана медоксомила в дозе 40 мг. Было обнаружено, что у этих пациентов происходит накопление главного метаболита азилсартана (M-II), который фармакологически неактивен; и его повышение не было сочтено основанием для снижения дозы пациентам с ХБП. Отсутствие необходимости коррекции дозы упрощает назначение этого сартана в клинической практике.
Азилсартана медоксомил показал себя мощным антигипертензивным препаратом при сравнении не только с препаратами своего класса, но и с ингибиторами ангиотензинпревращающего фермента (АПФ). Монотерапия азилсартана медоксомилом сравнивалась с рамиприлом в эквивалентных дозах в двойном слепом РКИ [21]. Азилсартан после 24 нед лечения снижал САД (на 21,2 мм рт.ст.) значительно сильнее, чем рамиприл (на 12,2 мм рт.ст.; p<0,001). Нежелательные явления, приводившие к прекращению лечения, с большей вероятностью возникали у пациентов, принимавших рамиприл (4,8%), чем у тех, кто принимал азилсартан (3,1%), но это различие не достигало статистической значимости.
Вторым компонентом новой комбинации является ХТ. Этот тиазидоподобный диуретик с наибольшим периодом действия был зарегистрирован в конце 60-х годов прошлого века. Его период полувыведения составляет около 50—60 ч, что обусловлено большим объемом распределения [22]. Около 99% ХТ связывается с карбоангидразой эритроцитов, формируется тканевое депо, из которого препарат постепенно поступает в плазму крови и проявляет свой терапевтический эффект [23, 24]. Антигипертензивный эффект ХТ развивается постепенно, достигая максимума через 2—4 нед после начала лечения.
ХТ считается эталонным диуретиком для лечения АГ. Так в РКИ, продемонстрировавших наиболее убедительные данные о положительном влиянии этого класса препаратов на заболеваемость и смертность больных с АГ, применялся именно он (см. таблицу).
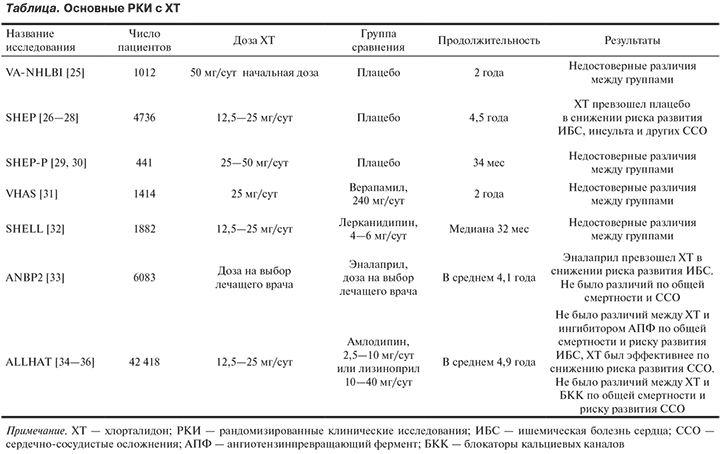
Влияние терапии на основе ХТ на частоту развития инсульта и других сердечно-сосудистых осложнений (ССО) у 4736 пациентов с изолированной систолической АГ изучали в исследовании SHEP (см. таблицу). ХТ по сравнению с плацебо снижал частоту развития инсульта на 36%, инфаркта миокарда на 27%, хронической сердечной недостаточности на 54%, а общее число ССО примерно на 32% [37].
Эффективность ХТ в целом ряде проведенных испытаний и его широкое использование в клинической практике определили выбор организаторов одного из крупнейших РКИ ALLHAT, посвященного изучению влияния различных типов антигипертензивного лечения на заболеваемость и смертность пациентов с АГ [38, 39]. В это исследование было рандомизировано более 42 тыс. пациентов с АГ и либо с известными ССЗ, либо с факторами риска их развития. Срок наблюдения составил 4,8 года (см. таблицу). ХТ в дозе 12,5—25 мг/сут не уступил таким мощным конкурирующим препаратам, как ингибитор АПФ лизиноприл и антагонист кальция амлодипин, по влиянию на комбинированную первичную конечную точку (коронарная смертность и нефатальные инфаркты миокарда). При оценке вторичных конечных точек (частота возникновения инсульта, госпитализации в связи с хронической сердечной недостаточностью, частота достижения целевого АД) были выявлены преимущества ХТ над этими препаратами.
Положительные результаты исследования ALLHAT в свою очередь стали основанием для применения ХТ в качестве препарата первой линии в упоминавшемся исследовании SPRINT [40]. Некоторые авторы даже связывали эффективность стратегии интенсивного снижения АД в этом исследовании в сравнении с исследованием ACCORD, с использованием в последнем в качестве базового мочегонного препарата гидро-хлоротиазида, а не ХТ [41].
Несмотря на то что во многих исследованиях были продемонстрированы минимальные метаболические последствия монотерапии малыми дозами диуретиков, эта проблема обсуждается и по настоящее время [42]. Полностью отражает суть проблемы эмоциональный заголовок опубликованной в 2013 г. статьи — «Метаболическая цена снижения артериального давления гидрохлоротиазидом» [43]. Попытки предотвратить снижение уровня калия на фоне лечения тиазидными диуретиками были предприняты уже в начале 90-х годов прошлого века. Тогда их сочетали с калийсберегающими диуретиками [44]. В настоящее время очевидно, что в гораздо большей степени компенсируют «метаболические недостатки» диуретиков блокаторы РААС. Препараты этой группы не только способствуют сохранению уровня электролитов в крови, но и уменьшают их негативное влияние на обмен углеводов, липидов и пуринов [45—47]. Кроме того, известно, что диуретики вызывают компенсаторную активацию РААС и симпатико-адреналовой системы, которая может быть минимизирована совместным использованием мочегонных с ингибитором АПФ или сартанами.
Однако основным аргументом в пользу применения диуретиков в составе комбинированной терапии АГ является их способность увеличивать антигипертензивную эффективность других препаратов. Первым исследованием, продемонстрировавшим эффективность комбинированной терапии азилсартаном медоксомилом и ХТ, было двойное слепое рандомизированное плацебо-контролируемое исследование М. Kipnes и соавт. [48]. У 418 пациентов, рандомизированных для применения различных терапевтических стратегий, среднее снижение САД/ДАД от исходных значений составило 23/16 мм рт.ст. Наиболее частыми нежелательными явлениями, независимо от вида лечения, были головокружение (8,9%) и головная боль (7,2%), в то время как клинически значимые нежелательные явления были зарегистрированы только у 8 (1,9%) пациентов. В двойном слепом факторном исследовании сравнивались эффективность и безопасность терапии комбинацией фиксированных доз азилсартана медоксомил/ХТ и их монотерапии [49]. Исследование включало всего 1714 пациентов со II стадией АГ. Основная конечная точка эффективности (снижение среднесуточного САД к 8-й неделе терапии) составила 28,9 мм рт.ст. для фиксированной комбинации азилсартана медоксомил/ХТ, статистически значимо превысив таковую для монотерапии азилсартан медоксомилом 80 мг и ХТ 25 мг (p<0,001 для обоих сравнений). Частота прекращения лечения и повышения креатинина в сыворотке крови были зависимыми и возникали чаще в группах комбинированной терапии — 0,6—5% по сравнению с 0,1% в группах монотерапии.
Особый интерес представляют результаты рандомизированного плацебо-контролируемого двойного слепого исследования, в котором сравнивалась эффективность комбинаций азилсартана медоксомила с ХТ и азилсартана медоксомила с более широко используемым в Российской Федерации гидрохлоротиазидом [50]. Пациенты (n=609) со II степенью АГ были рандомизированы для приема 12,5 мг ХТ или гидрохлоротиазида дополнительно к 40 мг азилсартана в течение 4 нед. Дозы диуретиков повышали до 25 мг для приема в последующие 4 нед, если не удавалось достичь контроля АД. Целевой уровень АД в этом исследовании был менее 130/80 мм рт.ст. для участников с сахарным диабетом и/или ХБП, для остальных пациентов менее 140/90 мм рт.ст. Результаты показали, что сочетание азилсартана медоксомил/ХТ обеспечивает большее снижение САД, чем комбинация азилсартана медоксомила с гидрохлоротиазидом (на 31,5 мм рт.ст. против 29,5 мм рт.ст., p<0,001). Доля пациентов, достигающих целевого АД после 6 нед лечения, была выше в группе комбинации с ХТ, чем с гидрохлоротиазидом (64,1% против 45,9%; p<0,001). Прекращение лечения вследствие нежелательных явлений не имело статистически значимых различий между группами (9,3% против 7,3%; p=0,38).
Заключение
Рандомизированные клинические исследования показали, что азилсартана медоксомил превосходит по антигипертензивному эффекту такие широко используемые антагонисты рецепторов к ангиотензину II, как валсартан и олмесартан, в отсутствие отличий в профиле безопасности. Кроме того, сочетание азилсартана медоксомила и хлорталидона имело преимущества перед другими комбинированными препаратами, включая комбинации сартанов с гидрохлоротиазидом, по степени снижения артериального давления. Эти обстоятельства дают возможность предполагать, что назначение фиксированной комбинации азилсартана медоксомила и хлорталидона пациентам с артериальной гипертонией II—III стадии обеспечит высокую приверженность к лечению в реальной практике и позволит достичь целевых уровней артериального давления, избегая увеличения количества лекарственных средств и сложных схем приема.



