По данным ВОЗ, артериальная гипертония (АГ) является одной из наиболее частых причин инвалидности и смертности среди взрослого населения во всем мире, в том числе в Российской Федерации [1—3]. АГ служит основным фактором риска развития инфаркта миокарда (ИМ), инсульта, хронической сердечной и почечной недостаточности [2, 3]. На величину риска развития тех или иных фатальных и нефатальных осложнений у пациентов с АГ влияет не только уровень артериального давления (АД) по данным обычного измерения, но и ряд параметров суточного мониторирования АД (СМАД) [2—4].
Несколько исследований показали, что амбулаторное АД более тесно, чем офисное АД, коррелирует с гипертрофией левого желудочка, увеличением толщины интимы—медии сонной артерии и другими маркерами поражения органов-мишеней у больных АГ [5, 6]. Кроме того, выявлено, что среднесуточное АД более тесно, чем офисное АД, коррелирует с заболеваемостью и смертностью [7, 8]. Данные мета-анализов, обсервационных наблюдений и обобщенные результаты отдельных исследований [9, 10] показали также, что амбулаторное АД в целом является более чувствительным, чем офисное АД, предиктором риска развития клинических сердечно-сосудистых исходов. Преимущество амбулаторного измерения АД было показано в общей популяции, у лиц молодого и пожилого возраста, у женщин и мужчин, у леченных и нелеченных больных АГ, у пациентов из группы высокого риска и у больных, страдающих сердечно-сосудистыми заболеваниями и болезнями почек [9—13].
В настоящее время для лечения больных АГ рекомендованы 5 основных классов антигипертензивных препаратов (АГП), в том числе ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов к ангиотензину II (БРА) [2, 3]. Несмотря на определенное сходство в механизмах действия (блокада ренин-ангиотензин-альдостероновой системы — РААС), эти 2 класса АГП имеют ряд отличий по эффективности и способности влиять на риск развития осложнений у определенных групп пациентов с АГ [3]. Возможно, это обусловлено различиями в их влиянии на параметры СМАД [3].
Ввиду того что у пациентов с АГ высокого риска рекомендовано сразу на старте лечения назначать комбинированную антигипертензивную терапию (АГТ) — преимущественно фиксированные комбинации (ФК) антигипертензивных препаратов (АГП) [3], целью нашего исследования было сравнение эффективности влияния ФК АГП, блокирующих РААС, с тиазидным диуретиком на параметры СМАД.
Материал и методы
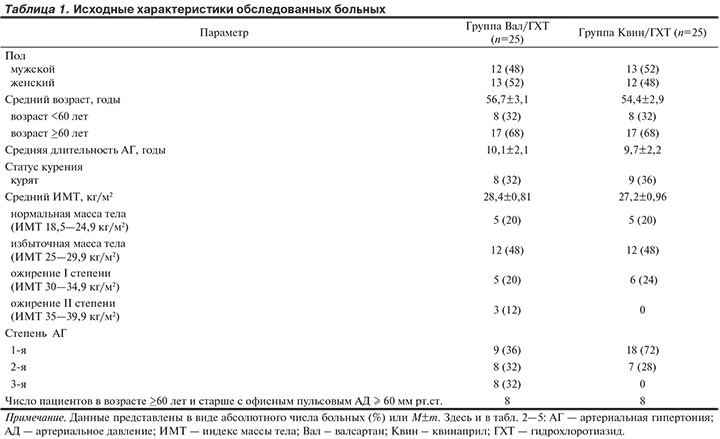
Обследованы 50 больных (25 женщин, 25 мужчин) в возрасте от 40 до 75 лет с гипертонической болезнью II стадии с систолическим АД (САД) 140—219 мм рт.ст. или диастолическим АД (ДАД) 90—129 мм рт.ст., которые не получали регулярной АГТ как минимум 12 нед до включения в исследование. Пациенты были рандомизированы на 2 группы, которые были сопоставимы по полу, возрасту, средней длительности АГ, статусу курения и индексу массы тела (табл. 1). В качестве стартовой терапии больным 1-й группы была назначена ФК БРА валсартана (Вал) 80 мг и диуретика гидрохлоротиазида (ГХТ) 12,5 мг (препарат валз Н, Actavis Group, Исландия), по 1 таблетке 1 раз в сутки утром. В отсутствие достижения целевого АД (менее 140 и 90 мм рт.ст.) [2, 3] через 2 нед дозу данной ФК увеличивали до 160 мг + 12,5 мг соответственно по одной таблетке 1 раз в сутки утром. Пациенты 2-й группы получали комбинацию ингибитора АПФ квинаприла (Квин) 10 мг и ГХТ 12,5 мг (препарат аккузид, Pfizer, США), по 1 таблетке 1 раз в сутки утром. В отсутствие достижения целевого АД (менее 140 и 90 мм рт.ст.) [2, 3] через 2 нед дозу увеличивали до 20 мг + 12,5 мг соответственно 1 раз в сутки утром. Если еще через 2 нед на увеличенной дозе обеих фиксированных комбинаций не было достигнуто целевое АД, пациентов исключали из исследования. Срок наблюдения — 12 нед с момента достижения целевого АД. Таким образом, исследование состояло из 2 периодов: 1) период подбора дозы АГТ с целью достижения целевого АД <140/90 мм рт.ст. (14 или 28 дней); 2) период 12-недельной фармакотерапии в подобранной дозе после достижения целевого АД.
В связи с этим общая длительность исследования варьировала в зависимости от продолжительности периода подбора дозы антигипертензивной фармакотерапии, которая составляла от 14 до 28 дней.
У всех пациентов исходно и в конце периода наблюдения помимо общеклинического обследования выполняли СМАД cогласно европейским рекомендациям 2013 г. [4].
Основные критерии отказа от включения в исследование: наличие деменции, уровень образования ниже среднего, САД ≥220 и/или ДАД >130 мм рт.ст. на момент включения в исследование, клинически значимое заболевание сердца, печени, почек, органов дыхания, желудочно-кишечного тракта, иммунологическое заболевание, клинически значимое эндокринное заболевание (включая сахарный диабет), психические заболевания и расстройства, клинически значимые неврологические заболевания (в том числе инсульт или транзиторная ишемическая атака любой давности), хирургическая операция в течение предыдущих 6 мес, злоупотребление какими-либо лекарственными средствами или алкоголем, индивидуальная непереносимость компонентов изучаемых препаратов, одновременный прием препаратов, которые могут повлиять на изучаемые параметры, в течение 12 нед до включения в исследование, на момент включения в исследование и до окончания исследования, беременность, лактация.
Критерии исключения: приверженность лечению пациента ниже 80%, отсутствие достижения целевого АД (менее 140/90 мм рт.ст.), нарушение пациентом процедур протокола исследования.
Статистическую обработку данных выполняли в программном пакете SPSS Statistics 20. Нормальность распределения полученных параметров оценивали с помощью критерия Колмогорова—Смирнова. Достоверность различий определяли на основании однофакторного дисперсионного анализа (ANOVA) и с помощью таблиц сопряженности (критерий χ2) для категориальных переменных. Для ненормально распределенных показателей применяли непараметрический критерий U Манна—Уитни и критерий знаковых рангов Вилкоксона. Силу взаимосвязи между переменными оценивали с помощью линейной корреляции Пирсона. Показатели приведены в виде средних величин (М) с соответствующими им стандартными ошибками среднего (m). Статистически значимыми считали результаты при p<0,05.
Результаты
По данным обычного измерения обе ФК достоверно снижали уровни САД, ДАД и пульсового АД в конце периода наблюдения (табл. 2). Исходные уровни САД, ДАД и пульсового АД в группе Вал/ГХТ в связи с особенностями протокола настоящего исследования (в отсутствие достижения целевого АД пациентов исключали из исследования) оказались достоверно выше, чем в группе Квин/ГХТ, тем не менее степень снижения АД оказалась достоверно больше в группе ФК Вал/ГХТ. Целевых значений АД, по данным обычного измерения, достигли 100% больных в обеих группах, хотя в группе Вал/ГХТ исходно у 8 (32%) больных имелась 3-я степень АГ, все они получали Вал/ГХТ в дозе 160 мг/12,5 мг, а в группе Квин/ГХТ таких пациентов не оказалось (все были исключены из исследования на этапе подбора дозы в связи с отсутствием достижения целевого АД). В группе Вал/ГХТ исходно у 8 (32%) больных имелась 2-я степень АГ, из них Вал/ГХТ в дозе 80 мг/12,5 мг получали 2, а в дозе 160 мг/12,5 мг — 6. Из 9 пациентов с исходно 1-й степенью АГ в группе Вал/ГХТ 8 получали дозу 80 мг/12,5 мг, один — 160 мг/12,5 мг. В группе Квин/ГХТ с исходно 2-й степенью АГ все получали препарат в дозе 20 мг/12,5 мг. У большинства (n=18) этой группы пациентов имелась 1-я степень АГ, из них только у 4 удалось добиться целевого АД на фоне дозы 10 мг/12,5 мг, остальным 24 больным пришлось увеличивать дозу до 20 мг/12,5 мг.
Анализ результатов СМАД позволил выявить, что обе ФК достоверно снижали уровень САД и ДАД в дневные и ночные часы (табл. 3), однако степень снижения всех 4 анализируемых параметров была достоверно больше в группе Вал/ГХТ, несмотря на то что исходный уровень АД в этой группе был достоверно выше (табл. 3).
В обеих группах достижение целевого среднесуточного АД (менее 130/80 мм рт.ст.) наблюдалось примерно с одинаковой частотой (в 64 и 68% случаев соответственно в группах Вал/ГХТ и Квин/ГХТ), несмотря на то что в группе Вал/ГХТ изначальный уровень АД по СМАД (САД и ДАД в дневные и ночные часы; см. табл. 3) был достоверно выше.
В группе Вал/ГХТ при исходном СМАД выявлено 15 (60%) больных с нарушением циркадного ритма АД: 8 (32%) — тип суточного профиля АД нон-диппер, 7 (28%) — овер-диппер. В конце периода наблюдения у 9 из них отмечена нормализация циркадного ритма АД (тип суточного профиля АД диппер). В группе Квин/ГХТ исходно нарушение циркадного ритма АД зарегистрировано у 12 (48%) больных — у 8 нон-диппер и у 4 овер-диппер. На заключительном визите нормализация суточного профиля АД обнаружена у 8 пациентов.

Анализ показателей вариабельности АД позволил выявить, что обе исследуемые ФК обеспечили ее достоверное снижение как в отношении САД, так и в отношении ДАД в дневные и в ночные часы (табл. 4). При этом в группе Вал/ГХТ вариабельность средненочного ДАД снижалась в достоверно большей степени, чем в группе Квин/ГХТ (табл. 4).
Установлено также, что на фоне терапии обеими ФК АГП достоверно снизились величина и скорость утреннего подъема САД и ДАД (табл. 5). В группе Вал/ГХТ выявлено достоверно большее снижение величины и скорости ДАД по сравнению с группой Квин/ГХТ (см. табл. 5).
В группе Вал/ГХТ исходно у 13 (52%) больных величина утреннего подъема САД составила >55 мм рт.ст., а в группе Квин/ГХТ — у 23 (92%). В конце периода наблюдения в группе Вал/ГХТ у всех больных данный показатель стал ниже 55 мм рт.ст., тогда как в группе Квин/ГХТ у 6 (24%) пациентов он по-прежнему превышал 54 мм рт.ст.
Следовательно, учитывая комплекс параметров офисного и амбулаторного АД, по антигипертензивной эффективности ФК БРА с диуретиком (Вал/ГХТ) превосходит ФК ингибитора АПФ с диуретиком (Квин/ГХТ).
В группе Вал/ГХТ побочных эффектов не отмечено. В группе Квин/ГХТ зафиксированы сухой кашель у одного пациента (мужчина, не курящий), еще у одного пациента отмечена эпизодически сухость слизистой оболочки полости рта, в связи со слабой выраженностью побочных эффектов прием препарата продолжен в прежней дозировке 20 мг/12,5 мг.
Обсуждение
В последние годы оценка эффективности, в том числе сравнительная, проводимой АГТ стала практически неинформативной без проведения СМАД, поскольку результаты ряда крупных исследований, мета-анализов и обсервационных наблюдений показали, что амбулаторное АД теснее, чем офисное АД, коррелирует с поражением органов-мишеней, риском развития сердечно-сосудистых осложнений (ССО) и смертностью [5—13].
Полученные нами результаты свидетельствуют, что, хотя обе исследуемые ФК достоверно снижали САД и ДАД по данным как офисного измерения, так и СМАД, однако ФК Вал/ГХТ достоверно превзошла по антигипертензивной эффективности ФК ингибитора АПФ с ГХТ, несмотря даже на исходно более высокие уровни АД. Особого внимания заслуживает выявленное нами достоверно большее снижение средненочного АД – как систолического, так диастолического, на фоне терапии Вал/ГХТ по сравнению с Квин/ГХТ. В исследованиях, в которых в одной и той же статистической модели учитывали и дневное, и ночное АД, было установлено, что ночное АД — более сильный предиктор ССО, чем дневное [10, 14].
Необходимо подчеркнуть, что выявляемые различия между разными режимами АГТ в снижении смертности и риска развития ССО часто обусловлены различиями во влиянии АГП на уровень АД по СМАД (среднесуточного, среднедневного и особенно средненочного) [15]. В частности, был проведен групповой анализ упомянутого выше исследования ASCOT (ASCOT ABPM substudy) [15], который показал, что более точные показатели выживаемости среди пациентов, получавших комбинацию амлодипин/периндоприл, в исследовании ASCOT связаны с более эффективным контролем ночного АД при применении данной комбинации. Те же закономерности выявлены для риска развития ССО, ИМ, особенно инсульта [15]. В ASCOT ABPM substudy обнаружено, что подъем средненочного САД на 14 мм рт.ст. увеличивает риск развития ССО на 26% [15]. Кроме того, в этом групповом анализе было выявлено, что повышенное средненочное САД (≥122 мм рт.ст.), даже при нормальном уровне АД по данным обычного измерения, является самостоятельным прогностически неблагоприятным фактором ССО, в том числе инсульта [15]. Следовательно, в клинической практике после констатации целевых уровней АД по данным обычного измерения целесообразно проведение СМАД для оценки уровня ночного САД. В случае, если оно остается повышенным (122 мм рт.ст. и более), целесообразна коррекция АГТ.
В свете изложенного становится понятной и важность нормализации типа суточного профиля АД. Доказано, что у пациентов с меньшим снижением ночного АД частота развития всех ССО выше, чем у больных с его более выраженным снижением [16, 17]. У лиц с типом суточного профиля АД овер-диппер повышена частота развития инсульта [18].
Так, в крупный мета-анализ, проведенный по Международной базе данных амбулаторного мониторирования АД в отношении к сердечно-сосудистым исходам — IDACO, вошло 11 проспективных популяционных исследований, включивших 7458 участников (средний возраст 56,8 года) [16]. По результатам этого мета-анализа, степень ночного снижения САД коррелировала с риском общей, не сердечно-сосудистой и сердечно-сосудистой смерти (соответственно относительный риск — ОР 1,12; 1,14; 1,10; р<0,001; р<0,01; р<0,05). Т. Ohkubo и соавт. [19] выявили, что уменьшение ночного снижения АД на 5% повышает риск развития ССО, смерти — на 20%. Cреди больных с типом суточного профиля АД нон-диппер выше распространенность эпизодов ишемии миокарда [20], утолщения интимы—медии [21], когнитивных нарушений [22] и др.
Высокая распространенность типа суточного профиля АД нон-диппер, его большая прогностическая значимость (увеличивается риск смерти от ССО, коронарных, церебральных и почечных осложнений) в клинической практике диктуют необходимость использовать, в частности, АГП, которые не только хорошо снижают уровень АД в дневные и ночные часы, но и нормализуют суточный профиль АД.
Поэтому полученные нами данные о нормализации суточного профиля АД у пациентов с его изначальными нарушениями, чаще зафиксированные в группе Вал/ГХТ, имеют большое значение для клинической практики.
В ряде крупных исследований выявлена значимость повышенной вариабельности АД как в дневные, так и в ночные часы, на риск развития инсульта и ИМ у пациентов с АГ [23—26]. Обнаружено, что вариабельность (стандартное отклонение, SD) среднедневного САД и ДАД, средненочного САД является независимым предиктором развития как цереброваскулярных, так и коронарных осложнений [23]. Вариабельность (SD) средненочного ДАД была независимым предиктором развития коронарных осложнений [23]. Большое значение вариабельности АД по СМАД как предиктора коронарных и цереброваскулярных осложнений выявлено и в исследовании ASCOT [24].
В нашем исследовании на фоне АГТ достоверное снижение всех анализируемых параметров суточной вариабельности АД отмечено в обеих группах, однако ФК Вал/ГХТ в достоверно большей степени снижала вариабельность диастолического АД в ночные часы, что в свете изложенного позволяет сделать вывод о потенциально большем влиянии на риск развития ССО.
Нами выявлено, что обе изучаемые ФК достоверно снижали величину и скорость утреннего подъема АД. Однако вновь обнаружены достоверные различия между группами в пользу ФК Вал/ГХТ: как величина, так и скорость утреннего подъема ДАД в этой группе снизились достоверно в большей степени по сравнению с ФК ингибитором АПФ с ГХТ.
Как известно, ранние утренние часы ассоциируются с повышенным риском развития ССО, цереброваскулярных осложнений, а также внезапной смерти [27—30]. Так, данные Фрамингемского эпидемиологического исследования показали, что время максимального риска внезапной смерти приходится на утренние часы (с 7:00 до 9:00): риск внезапной смерти в утренние часы в среднем на 70% выше, чем в остальное время суток [27]. Именно с утренним повышением АД во многом связывается более чем трехкратный риск возникновения ИМ, нарушения ритма сердца и внезапной смерти больных с сердечно-сосудистыми заболеваниями в первые часы после пробуждения и подъема с постели [28, 29]. Выявлено, что пик развития мозговых инсультов, как ишемических, так и геморрагических, также приходится на утро (между 8:00 и 12:00) [30].
Заключение
Таким образом, проведенное нами исследование позволяет сделать вывод о том, что комбинации блокаторов РААС с диуретиком ГХТ обеспечивают достоверное снижение уровня АД, в том числе по данным СМАД, высокий процент достижения целевого АД, снижение вариабельности АД, величины и скорости утреннего подъема АД, способствуют нормализации суточного профиля АД. Однако, несмотря на определенные сходства в механизмах действия, комбинация БРА с ГХТ (Вал/ГХТ) оказалась более эффективной в плане снижения уровня САД, ДАД и пульсового АД по результатам обычного измерения, среднедневного и средненочного САД и ДАД, вариабельности средненочного ДАД, величине и скорости утреннего подъема ДАД по результатам СМАД.
Учитывая прогностическую значимость перечисленных параметров как факторов риска развития ССО, цереброваскулярных осложнений и смертности, выявленные преимущества ФК Вал/ГХТ позволяют рассматривать ее в качестве терапии первой линии в лечении больных АГ высокого риска.



