Ожирение значительно осложняет течение многих заболеваний, в том числе ишемической болезни сердца (ИБС). Широкомасштабные генетические исследования, проводимые в последнее время, позволили высказать предположение о генетической предрасположенности к развитию ожирения.
Адипонектин является цитокином, продуцируемым жировой тканью. Этот белок представляет собой адипоцитарный гормон, который регулирует обмен липидов и глюкозы.
Его уровень заметно снижается в плазме крови у пациентов с метаболическим синдромом, ожирением, сахарным диабетом 2-го типа и атеросклерозом [1, 2]. В ряде исследований установлена корреляция между низкой концентрацией адипонектина в сыворотке крови и развитием ИБС и артериальной гипертензии [3, 4].
Известны два мембранных рецептора адипонектина (AdipoRl и AdipoR2) с отдаленной гомологией к 7-доменным рецепторам, сопряженным с G-белками [5]. Помимо этих рецепторов было обнаружено, что специфические для сосудистой стенки и сердца высокомолекулярные изоформы адипонектина могут связываться еще с одним рецептором — Т-кадгерином [5]. Именно взаимодействие адипонектина с Т-кадгерином опосредует кардиопротективные эффекты адипонектина, продемонстрированные в работах на мышах [6] и выражающиеся в уменьшении гипертрофии миокарда при экспериментальной индукции трансаортальной констрикции и инфаркта миокарда на модели ишемии-реперфузии. Однако адипонектин является не единственным лигандом Т-кадгерина. В нашей лаборатории было показано участие Т-кадгерина в рецепции липопротеидов низкой плотности (ЛНП) [7], а также в их гормоноподобном действии на сосудистую стенку [8, 9].
В ряде полногеномных исследований было выявлено несколько однонуклеотидных полиморфных маркеров гена Т-кадгерина (CDH13), ассоциированных с концентрацией общего и высокомолекулярного адипонектина: rs11646213, rs4783244 и rs12444338 [10, 11]. Показана также связь этих полиморфизмов с концентрацией липопротеидов высокой плотности (ЛВП) и триглицеридов (ТГ) в плазме крови [12].
С учетом данных о снижении уровня адипонектина при увеличении индекса массы тела (ИМТ) [13, 14] возникает вопрос о взаимосвязи ожирения с полиморфными маркерами CDH13, однако данные по этому вопросу противоречивы. Так, для полиморфизма rs4783244 в одном исследовании была показана статистически значимая связь носительства аллеля Т с более низким ИМТ [15], а в другом — связь носительства аллеля G с более низким ИМТ и высоким уровнем адипонектина в крови [16].
Целью настоящей работы являлся поиск ассоциации полиморфизма гена Т-кадгерина (CDH13) c развитием ожирения у пациентов с ИБС.
Материал и методы
В исследуемую группу последовательно были включены 118 мужчин моложе 65 лет с клинически и инструментально подтвержденным диагнозом ИБС. Медиана возраста составила 57 (49; 62) лет. Диагноз ИБС устанавливали на основании следующих критериев:
- Снижение сегмента ST на электрокардиограмме (ЭКГ) горизонтального или косонисходящего типа не менее чем на 1 мм ниже изолинии во время проведения нагрузочного теста хотя бы в одном отведении.
- Перенесенный инфаркт миокарда, подтвержденный отклонением от нормы биохимических маркеров (повышение уровня фракции МВ креатинфосфокиназы более чем в 2 раза выше нормы, повышение концентрации кардиоспецифичных тропонинов Т и I выше 99-го перцентиля для контрольной группы), типичными изменениями на ЭКГ (смещение сегмента ST на 0,1 мВ или инверсия зубца Т в двух или более смежных отведениях, подъем сегмента ST, патологический зубец Q или комплекс QS).
- Коронарная реваскуляризация в анамнезе.
От всех лиц исследуемой группы получено добровольное информированное согласие на участие в исследовании.
Лабораторная диагностика и генотипирование. Пациентам были проведены клинико-анамнестическое обследование и стандартная лабораторно-инструментальная диагностика при ИБС (в том числе расчет ИМТ, измерение концентрации общего и высокомолекулярного адипонектина в крови, общего холестерина – ОХС, ТГ, ЛНП, ЛВП в крови).
Генотипирование производили по трем полиморфным маркерам CDH13 rs11646213, rs12444338, rs4783244 c использованием наборов для генотипирования TaqMan probe assay (Applied Biosystems Co., Ltd., FosterCity, CA).
Статистический анализ результатов исследования был проведен с помощью программного обеспечения Statistica 10,0.Для оценки распределения изучаемых переменных применяли критерий Колмогорова—Смирнова. Для анализа нормально распределенных количественных признаков использовали метод χ2 Пирсона. В случае распределения, отличного от нормального, использовали критерий Крускала—Уоллиса. Для определения различий между тремя генотипами использовали дисперсионный анализ. Для выявления различий между группами был проведен расчет отношения шансов (ОШ) и _ 95% доверительного интервала (ДИ). Различия при p<0,05 рассматривались как статистически значимые.
 Результаты
Результаты
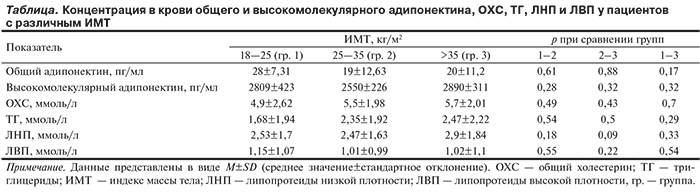
Для проведения анализа пациенты были условно разделены на 3 группы в соответствии с ИМТ: 18—25 кг/м2 (19 пациентов), 25—35 кг/м2 (86 пациентов), ИМТ>35 кг/м2 (13 пациентов). Такое разделение было проведено с учетом так называемого парадокса ожирения, связанного с тем, что для пациентов с ИМТ в диапазоне от 25 до 35 кг/м2 характерна более низкая смертность от различных причин (в том числе от сердечно-сосудистых заболеваний) по сравнению с пациентами, имеющими нормальную массу тела (ИМТ<25 кг/м2) и выраженное ожирение (ИМТ>35 кг/м2) [17].
Указанные группы по ИМТ не различались по концентрации общего и высокомолекулярного адипонектина в крови, ОХС, ТГ, ЛНП, ЛВП в крови (см. таблицу).
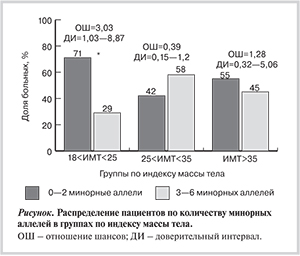
Для оценки кумулятивного влияния однонуклеотидных полиморфных маркеров на ИМТ был проведен многофакторный анализ, в ходе которого оценивалась взаимосвязь общего числа минорных аллелей. У 61 пациента имелись минорные аллели всех изучаемых маркеров, таким образом, в совокупности эти лица имели от 3 до 6 минорных аллелей; у 57 человек имелось не более двух минорных аллелей. Рисунок демонстрирует взаимосвязь числа минорных аллелей с ИМТ в исследованной выборке.
Установлено, что существует статистически значимая ассоциация числа минорных аллелей Т в полиморфных маркерах Т-кадгерина rs11646213, rs4783244, rs12444338 с ИМТ: у пациентов с меньшим числом минорных аллелей Т чаще наблюдается нормальная масса тела (ОШ 3,03 при 95% ДИ от 1,03 до 8,87).
Обсуждение
К настоящему времени существует лишь небольшое число исследований, в которых показано кумулятивное действие полиморфных маркеров на метаболические параметры (ИМТ, концентрация адипонектина в крови, развитие сахарного диабета) [18, 19].
Ранее исследователями были предприняты попытки обнаружить ассоциации полиморфных маркеров гена Т-кадгерина с ИМТ в полногеномных исследованиях, но статистически значимых результатов получено не было [16].
Недавно A.E. Locke и соавт. и D. Shungin и соавт. представили результаты полногеномных исследований однонуклеотидных полиморфизмов и результаты мета-анализа данных, полученных от генотипирования образцов на Metabochip [20, 21].
Было обнаружено 97 локусов, ассоциированных с ИМТ пациентов, из них 33 представлены впервые. Среди данных полиморфных маркеров нет rs11646213, rs4783244, rs12444338, что, возможно, связано с методикой генотипирования, предполагающей исследование индексных однонуклеотидных полиморфных маркеров (index SNPs) без оценки кумулятивного действия конкретных полиморфных маркеров.
В настоящей работе проведен многофакторный анализ, показывающий, что влияние на ИМТ может проявляться именно при кумулятивном действии нескольких полиморфных маркеров гена CDH13, причем генетические факторы более важны для поддержания нормальной массы тела. У пациентов с ожирением (ИМТ>25 кг/м2) мы не обнаружили статистически значимой корреляции ИМТ с количеством минорных аллелей в исследуемых полиморфных маркерах.
Следует отметить, что в нашем исследовании корреляции уровней общего и высокомолекулярного адипонектина с ИМТ обнаружено не было. Вероятно, это связано с особенностями исследуемой выборки, поскольку известно, что при ИБС происходят существенные изменения уровня адипонектина [4]. Однако отсутствие корреляции уровня адипонектина с ИМТ может также свидетельствовать о том, что генетический полиморфизм Т-кадгерина может быть связан с ожирением посредством других биохимических механизмов.
Заключение
В данной работе показано кумулятивное влияние полиморфных маркеров гена Т-кадгерина (CDH13) rs11646213, rs4783244, rs12444338 на индекс массы тела у пациентов с ишемической болезнь сердца: среди больных с двумя и менее минорными аллелями в указанных локусах чаще встречаются лица с нормальной массой тела.
Авторы выражают благодарность профессору Е.В. Парфеновой за участие в обсуждении результатов исследования.
Исследование выполнено за счет грантов Российского научного фонда: формирование выборки осуществлялось в рамках проекта№14-50-00029, генотипирование и анализ данных были выполнены в рамках проекта № 14-24-00086.



