По данным Всемирной организации здравоохранения (ВОЗ), около 1,7 млрд человек на планете имеют избыточную массу тела или ожирение. К 2025 г., по прогнозам экспертов, число лиц с ожирением увеличится практически в 2 раза [1]. В связи с этим ожирение было признано ВОЗ новой неинфекционной эпидемией. Ожирение, являясь наиболее важной междисциплинарной медицинской
проблемой, служит одной из основных причин развития сахарного диабета (СД) 2-го типа, повышения артериального давления и гиперлипидемии. Каждое из этих состояний и, тем более, их сочетание значительно повышают риск развития сердечно-сосудистых осложнений (ССО). Причем, чаще всего эти нарушения встречаются при избыточном отложении жира в абдоминальной области. Поэтому абдоминальный, или висцеральный, тип ожирения был признан независимым фактором риска развития
сердечно-сосудистых заболеваний (ССЗ) и СД 2-го типа [2]. У больных с абдоминальным типом ожирения часто имеется сочетание нескольких факторов риска развития ишемической болезни сердца (ИБС) и основными причинами инвалидности и смертности таких больных являются ССЗ — инфаркт миокарда (ИМ), инсульт, сердечная недостаточность. Несколько крупных многоцентровых исследований продемонстрировали увеличение смертности в соответствии с ростом индексом массы тела (ИМТ). По данным американского проспективного исследования с участием более 1 млн мужчин и женщин, увеличение риска смерти от ССЗ у лиц с избыточной массой тела и ожирением начинается при ИМТ 25 кг/м2, тогда как при ИМТ между 23,5 и 24,9 кг/м2 показан наименьший риск смерти от ССЗ и этот диапазон был рекомендован как эталон показателя ИМТ [3].
Ожирение также приводит к развитию инсулинорезистентности периферических тканей, что играет пусковую роль в развитии СД 2-го типа. У 85—90% больных СД 2-го типа имеется ожирение. При ИМТ более 25 кг/м2 частота развития СД 2-го типа увеличивается в 8 раз, а при ИМТ более 30 кг/м2 — в 40 раз по сравнению с таковой при ИМТ 22 кг/м2 [4]. Благодаря таким стремительным темпам увеличения числа тучных людей распространенность СД во всем мире достигла уровней эпидемии, продолжая
неуклонно возрастать.
В последние десятилетия ученые стали рассматривать различные метаболические нарушения или заболевания, ассоциированные с избыточной массой тела, в комплексе и высказывать предположения об общности этих процессов. В 60-е годы прошлого столетия делались попытки объединения взаимосвязанных метаболических нарушений, ускоряющих развитие макрососудистых атеросклеротических заболеваний и СД 2-го типа. В 1988 г. американский ученый G. Reaven, объединив нарушения углеводного обмена, артериальную гипертензию (АГ) и дислипидемию понятием «синдром Х», впервые высказал предположение о том, что объединяющей основой этих нарушений могут быть инсулинорезистентность и компенсаторная гиперинсулинемия [5]. В конце прошлого века метаболические нарушения и заболевания, развивающиеся у лиц с ожирением, объединили в понятие «метаболический синдром». Метаболический синдром (МС) — это сочетание метаболических нарушений, в патогенезе которых важную роль играет инсулинорезистентность, и которые являются факторами риска раннего развития атеросклероза и его ССО. В настоящий момент существует 5 групп диагностических критериев МС. Отечественными учеными, экспертами Всероссийского научного общества кардиологов также были разработаны и опубликованы критерии МС. Наличие у пациента висцерального ожирения и двух дополнительных критериев является основанием для диагностирования у него МС.
Клиническая значимость нарушений и заболеваний, объединенных в рамки МС, заключается в том,
что их сочетание в значительной степени ускоряет развитие и прогрессирование заболеваний, свя-
занных с атеросклерозом, которые имеют не только медицинское, но и социальное значение в современном обществе.
Параметры гемостаза у пациентов с ожирением и метаболическим синдромом. Тромбоэмболические осложнения составляют одну из серьезных медицинских проблем. Причины, вызвавшие эти осложнения, многообразны. Это и большая группа пациентов с нарушениями ритма сердца — фибрилляцией предсердий (ФП), которая может носить характер пароксизмальной, персистирующей или постоянной, а также пациенты, у которых тромбоэмболические осложнения вызваны лечебными
антиаритмическими мероприятиями. Однако существуют и другие причины, не зависящие от наличия аритмии, — это соматическое и висцеральное ожирение, малоподвижный образ жизни или длительный постельный режим, развитие тромбоза глубоких вен нижних конечностей, а также генетически детерминированные изменения в системе гемостаза. Частой клинической ситуацией является сочетание нескольких факторов риска сразу у одного пациента: ожирение, гиподинамия и ФП, тогда риск развития тромбоэмболических осложнений у них наиболее высокий.
Первичная профилактика разработана не для всех категорий риска. Дальше всех «продвинулась» первичная и вторичная профилактика тромбоэмболических осложнений у пациентов с ФП.
Принятие обновленных европейских рекомендаций в августе 2010 г., а в октябре 2011 г. и отечественных новых рекомендаций по лечению и профилактике ФП было продиктовано принципиальными изменениями не только в лечении аритмии, но и в профилактике таких грозных
осложнений, как тромботические. Согласно рекомендациям, как только ФП впервые установлена, сразу следует стратифицировать риск развития тромбоэмболических осложнений и принять решение о назначении антитромботической терапии.
Появились и новые антикоагулянты. Один из первых — дабигатрана эксилат (прадакса) — по данным
исследования RE-LY в дозе 150 мг 2 раза в сутки по своей эффективности для профилактики ишемических инсультов превзошел варфарин при том же риске развития геморрагических осложнений, а в дозе 110 мг 2 раза в сутки оказался эквивалентным варфарину по эффективности при значительно меньшем риске развития кровотечений [6]. Дополнительным преимуществом нового
препарата является отсутствие необходимости постоянного контроля параметров гемостаза (МНО) и титрации дозы в зависимости от них.
Однако при других состояниях, связанных с повышенным риском развития тромбоэмболических осложнений, в том числе при ожирении и МС, изменения в состоянии системы гемостаза находятся лишь на стадии активного изучения.
Система гемостаза представляет собой совокупность механизмов, обеспечивающих сохранение жидкого состояния крови, предупреждение и остановку кровотечений, а также целости кровеносных сосудов.
В системе гемостаза принимают участие факторы свертывающей (коагуляционной), противосвертывающей (антикоагулянтной) и фибринолитической систем крови. Изменение функционального состояния одной из систем сопровождается компенсаторными сдвигами в деятельности другой. Нарушение функциональных взаимосвязей может привести к тяжелым патологическим состояниям организма, заключающимся или в повышенной кровоточивости, или во внутрисосудистом тромбообразовании; последнее наиболее часто сопутствует развитию и прогрессированию ССЗ.
Согласно современным представлениям ожирение, особенно при увеличении количества висцерального жира, характеризуется протромбогенными изменениями гемостаза и фибринолиза, что в сочетании с инсулинорезистентностью, компенсаторной гиперинсулинемией, нарушениями углеводного обмена, атерогенной дислипидемией и АГ, которые обсуждались ранее, значительно
увеличивает риск развития и прогрессирования ССЗ.
Среди протромбогенных изменений наиболее изучена ассоциация инсулинорезистентности и висцерального ожирения с увеличением концентрации ингибитора активации плазминогена 1-го типа, приводящая к нарушению фибринолиза и к увеличению риска атеротромбоза. Однако повышение данного показателя — не единственный механизм развития протромбогенных нарушений
у пациентов с инсулинорезистентностью и висцеральным ожирением, но в настоящее время данных о наличии взаимосвязи других звеньев гемостаза и фибринолиза с вис церальным или соматическим ожирением недостаточно для точного воспроизведения картины формирования нарушений гемостаза у таких пациентов. Для оценки распространенности и выраженности нарушений свертывающей и противосвертывающей систем крови у пациентов с ожирением и МС, а также для определения взаимосвязи этих нарушений с основными антропометрическими показателями, параметрами углеводного и липидного обмена было проведено настоящее исследование.
Материал и методы
С целью изучения распространенности нарушений в свертывающей и противосвертывающей системе при висцеральном ожирении и МС в группе лиц, проходящих обучение в «Школе больного ожирением», выполнено скрининговое обследование 216 пациентов с ожирением в возрасте 35—69 лет, включающее выявление основных характеристик МС и оценку параметров гемостаза.
Критерии включения в исследование (определение МС согласно критериям ВНОК, 2007 [7]):
• абдоминальное ожирение: окружность талии (ОТ) >102 см у мужчин и >88 см у женщин;
• уровень глюкозы в крови натощак ≥6,1 ммоль/л, но <7 ммоль/л (НГН); и/или уровень глюкозы в крови
через 2 ч после нагрузки 75 г глюкозы (пероральный тест на толерантность к глюкозе) от 7,8 до 11,0 ммоль/л (нарушение толерантности к глюкозе);
• триглицериды (ТГ) ≥1,7 ммоль/л;
• уровень холестерина (ХС) липопротеидов высокой плотности (ЛВП) < 1,0 ммоль/л у мужчин и <1,2 ммоль/л у женщин;
• уровень ХС липопротеидов низкой плотности (ЛНП) > 3,0 ммоль/л;
• АГ или уровень артериального давления (АД) ≥130/85 мм рт.ст.
Критерии исключения: СД 1-го типа, ИБС, стенокардия напряжения I— IV функционального класса (по классификации канадской ассоциации кардиологов, 2001), нестабильная стенокардия, острый ИМ, хроническая сердечная недостаточность, в том числе обусловленная перенесенным Q-ИМ, НК I—III, ранее диагностированные генетические или приобретенные коагулопатии, бронхиальная астма и дыхательная недостаточность, нарушение мозгового кровообращения, хроническая почечная недостаточность, тяжелые нарушения функции печени (увеличение активности трансаминаз в крови в 2 раза выше нормы), заболевания желудочно-кишечного тракта в стадии обострения, хронический алкоголизм; онкологические заболевания; прием пероральных контрацептивов, вторичные АГ; беременность и лактация; участие пациента в любом другом исследовании в течение последних
30 дней перед отбором в данное исследование.
Состояние свертывающей системы оценивали на основании определения параметров плазменного гемостаза (протромбиновое время — ПВ, протромбиновое отношение — ПО, международное нормализованное отношение — МНО, тромбиновое время — ТВ, активированное частичное тромбопластиновое время — АЧТВ, концентрации фибриногена), а также активности факторов коагуляции VII, VII, XI в плазме крови. В качестве показателя противосвертывающей системы оценивали активность антитромбина III, изучались также и показатели фибринолитической системы плазминоген и D-димер. Параметры гемостаза определяли на автоматическом анализаторе ACL-9000.
Все пациенты, включенные в исследование, прошли обследование: опрос, включающий вопросы по наследственности, статусу курения, потреблению алкоголя, диетологический опрос, опрос по течению АГ и сопутствующих заболеваний; измерение роста, массы тела, ОТ, окружность бедер (ОБ); расчет ИМТ и ОТ/ОБ; измерение систолического АД, диастолического АД, частоты сердечных сокращений в покое; электрокардиограмма в 12 отведениях в покое в положении лежа; количественное определение липидного состава крови: общий ХС, ТГ и ХС ЛВП; расчет ХС ЛНП; количественное определение в крови глюкозы натощак и через 2 ч после нагрузки; количественное определение аланинаминотрансферазы, аспартатаминотрансферазы в крови. Все параметры определяли в сыворотке крови на биохимическом анализаторе I Lab 650.
Статистическую обработку данных проводили с помощью пакета прикладных программ Statistica 6.0, разработанных для Microsoft Windows. Для представления количественных данных приведены медиана и интерквартильный размах. Для оценки взаимосвязи изучаемых признаков проводили корреляционный анализ Спирмена. Данные представлены в виде медианы (25-й перцентиль; 75-й перцентиль). За достоверный уровень значимости принимался p<0,05.
Результаты
В результате первичного скринингового обследования пациентов с ожирением в исследование были включены 56 мужчин и женщин (отношение муж/жен — 1:2) в возрасте от 35 до 69 лет (медиана 54,0 года (46,0; 59,0)).
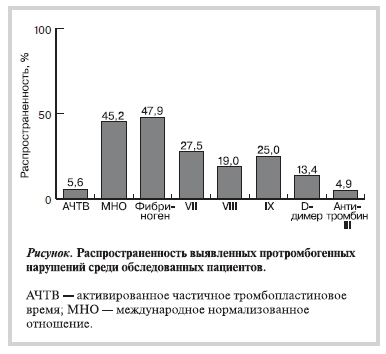
Показатели плазменного гемостаза среди обследованных пациентов представлены в таблице. ПВ и ТВ у всех пациентов были в пределах референсных значений. ПО и МНО составили 0,90 (0,85; 0,94), при этом у 45,2% пациентов отмечалось его уменьшение менее 0,88, свидетельствующее о наличии прокоагулянтного состояния. АЧТВ составило 28,70 (26,50; 30,90) с, при этом у 5,6% обследованных оно было менее 24 с, что также свидетельствует о прокоагулянтном статусе данных пациентов.
Концентрация фибриногена в плазме крови достигала 3,99 (3,34; 4,43) г/л; у 47,9% пациентов выявлена гиперфибриногенемия (повышение уровня фибриногена выше 4,0 г/л). При исследовании активности внутренних плазменных факторов коагуляции, VII, VIII и IX у 27,5% пациентов отмечалось повышение активности VII фактора, у 19% — VIII фактора и у 25% — IX фактора, однако значений ниже референсного интервала не было ни у одного пациента.
Таблица. Показатели свертывающей и противосвертывающей системы крови у обследованных пациентов (n=56).
В качестве показателя активности фибринолитической системы изучали концентрацию D-димера, которая составила 161,0 (126,0; 206,0) нг/мл, при этом у 13,5% обследованных выявлялся его повышенный уровень (более 255 нг/мл), что также свидетельствует о повышенном сочетанном риске развития тромбообразования и ССО. Активность противосвертывающей системы оценивали путем определения активности антитромбина III, которая составила 112,0 (103,0; 120,0), при этом у 5%
обследованных выявлено уменьшение ее ниже референсных значений.
В целом те или иные протромбогенные нарушения в системе гемостаза (снижение МНО, укорочение АЧТВ, гиперфибриногенемия, повышение активности VII, VIII и IX факторов свертываемости, увеличение концентрации D-димера, снижение активности антитромбина III) были выявлены у 87% обследованных (см. рисунок). У 55% из них отмечалось наличие одновременно несколько патологических сдвигов в системе свертываемости и снижение факторов защиты, что также свидетельствует о потенциально высоком риске тромботических осложнений.
При анализе взаимосвязей исследуемых показателей гемостаза с антропометрическими и биохимическими показателями выявлена значимая отрицательная корреляция АЧТВ с ОТ (r= –0,34; p<0,05), уровнем глюкозы натощак (r= –0,38; p<0,05), САД (r= –0,35; p<0,05), активностью фактора VIII (r= –0,42; p<0,05) и фактора IX (r= –0,62; p<0,05). Отмечалась также положительная корреляция активности фактора VIII и увеличения ОТ (r= 0,35; p<0,05). Активность фактора VII была отмечена значимой положительной взаимосвязью активности фактора VII с уровнем ТГ (r= 0,45; p<0,05), отрицательной — с величиной ПВ и ПО (r= –0,92; p<0,05). Активность фактора IX была отрицательно связана с уровнем ЛВП (r= –0,35; p<0,05), с величиной ПВ и ПО (r= –0,37; p<0,05), тромбиновым временем (r= –0,45; p<0,05). Уровень D-димера был достоверно прямо взаимосвязан с уровнем ЛНП (r=0,35; p<0,05), фибриногена (r=0,32; p<0,05), активностью факторов VIII (r= 0,32; p<0,05)
и IX (r= 0,32; p<0,05). Между показателем фибринолитической системы плазминогеном и ОТ и ОБ была
выявлена достоверная отрицательная взаимосвязь (r= –0,39; p<0,05), кроме того, уровень плазминогена был отрицательно связан с уровнем креатинина (r= – 0,39; p<0,05) и положительно — с антитромбином III (r= 0,39; p<0,05). Отмечалась положительная корреляция между концентрацией фибриногена и ЛНП (r=0,34; p<0,05), С-реактивного белка (r=0,50; p<0,05), индексом атероген-
ности (r=0,36; p<0,05) и отрицательная — с уровнем АроА1 (r= –0,32; p<0,05) и ТВ (r= –0,68; p<0,05). Взаимосвязи параметров гемостаза с возрастом не выявлено.
Обсуждение
Выявленные в ходе данного исследования протромбогенные изменения у пациентов с висцеральным ожирением и МС на фоне инсулинорезистентности подтверждают наличие высокого риска развития тромбоэмболических осложнений у пациентов такой категории.
Полученные результаты согласуются с имеющимися в литературе данными о различных нарушениях гемостаза у пациентов с висцеральным ожирением, которое является фактором риска развития МС и, соответственно, тромбофилии, независимо от возраста пациента [8, 9]. Действительно, включенные в исследование пациенты различались по возрасту (от 35 до 69 лет). При этом взаимосвязи между возрастом и выявленными нарушениями в системе гемостаза, а также между возрастом и антропометрическими и биохимическими показателями у пациентов с висцеральным ожирением и МС выявлено не было.
Известно, что висцеральное ожирение и МС характеризуются состоянием хронического подострого воспаления и протромбогенными нарушениями в системах гемостаза и фибринолиза. В целом те или иные протромбогенные нарушения в системе гемостаза (снижение МНО, укорочение АЧТВ, гиперфибриногенемия, повышение активности VII, VIII и IX факторов свертываемости, увеличение концентрации D-димера, снижение активности антитромбина III) были выявлены в настоящем исследовании у 87% обследованных пациентов с МС (см. рисунок). Эти результаты соотносятся с данными литературы, подтверждающими, что МС характеризуется протромбогенными нарушениями. Нами выявлены следующие нарушения: укорочение АЧТВ (5,6%), снижение МНО (45%), гиперфибриногенемия (47,9%), увеличение активности факторов коагуляции VII (27,5%), VIII (19%) и IX (25%), увеличение количества D-димера (13,4%), снижение активности антикоагулянтной системы — активности антитромбина III (5%).
Определение АЧТВ используется в качестве скринингового теста для оценки внутреннего каскада свертывания крови и отражает активность высокомолекулярного кининогена, прекалликреина, факторов коагуляции XII, XI, IX, VIII, X, V, протромбина и в некоторой степени фибриногена [10]. Укорочение АЧТВ, выявленное у 5,6% обследованных пациентов, отражает наличие у них тромбофилии и может быть связано с резистентностью фактора V к активированному белку С, повышением уровня фактора VIII или активности внутренних факторов свертываемости. Действительно, показаны выраженная обратная зависимость АЧТВ от активности фактора VIII (r= –0,47; p<0,05) и повышение активности самого фактора VIII. Кроме того, продемонстрирована значимая отрицательная корреляция АЧТВ с ОТ (r= –0,34; p<0,05), что может отражать усиление тромбофилии при увеличении количества висцерального жира в организме.
Наиболее частым прокоагулянтным нарушением в нашем исследовании являлось повышение активности фактора VII, которое выявлено у 27,5% пациентов с висцеральным ожирением и МС. По мнению ряда авторов, повышение активности фактора VII является важным фактором риска развития ССО и может служить независимым прогностическим фактором развития ИБС. Повышение уровня фактора VII при висцеральном ожирении и МС показано в целом ряде исследований [11—14]. Имеются данные о тесной связи фактора VII с уровнями общего ХС, ТГ, а также с возрастом, а у женщин — с менопаузой [14—16]. В проведенном нами исследовании отмечена значимая положительная взаимосвязь активности фактора VII с уровнем ТГ (r= 0,45; p<0,05).
В ряде исследований продемонстрированы повышение активности факторов VIII и IX при МС, а также
их взаимосвязь с показателями инсулинорезистентности [17—19]. В нашем исследовании также у отдельных пациентов отмечалась повышенная активность данных факторов, выявлена значимая прямая корреляция активности фактора VIII с ОТ (r= 0,35; p<0,05), что может служить одним из подтверждений протромбогенного потенциала висцерального ожирения и инсулинорезистентности при МС. Активность фактора IX была отрицательно связана с уровнем ЛВП (r= –0,35; p<0,05), что также может быть связано с сочетанным влиянием висцерального ожирения на развитие протромбогенных и атерогенных нарушений.
У 47% пациентов, принявших участие в нашем исследовании, выявлена гиперфибриногенемия. По мнению большинства исследователей, фибриноген является одновременно маркером сосудистого воспаления и прокоагулянтного состояния, во многих исследованиях показана связь повышения уровня фибриногена и висцерального ожирения, инсулинорезистентности при МС [16, 20—22]. По данным ряда исследований, концентрация фибриногена положительно коррелирует с уровнем глюкозы
и отрицательно — с уровнем ЛВП [16, 22]. В нашем исследовании выявлена положительная корреляция между концентрацией фибриногена и ЛНП (r=0,34; p<0,05), С-реактивного белка (r=0,50; p<0,05), индексом атерогенности (r=0,36; p<0,05) и отрицательная — с уровнем АроА1 (r= –0,32; p<0,05), что свидетельствует о связи ранних нарушений в коагуляционной системе с прогрессированием ССЗ.
В качестве показателя активности фибринолитической системы изучалась концентрация D-димера, при этом у 13,5% обследованных пациентов выявлялся его повышенный уровень (более 255 нг/мл), уровень D-димера имел достоверную положительную взаимосвязь с уровнем ЛНП (r=0,35; p<0,05), фибриногена (r=0,32; p<0,05), активностью факторов VIII (r=0,32; p<0,05) и IX (r=0,32; p<0,05), что также свидетельствует о повышенном сочетанном риске развития тромбогенных нарушений и ССО.
Примечательно, что у обследованных нами пациентов были выявлены не только протромбогенные сдвиги факторов плазменного гемостаза, но и нарушения в противосвертывающей системе крови: снижение активности антикоагулянтной системы антитромбина III отмечалось у 5% пациентов; в 10,9% случаев оно сочеталось с одновременным повышением активности факторе VII и/или гиперфибриногенемией. Научные данные относительно взаимосвязи антикоагулянтной системы с висцеральным ожирением, МС крайне ограничены и противоречивы. Так, в одном из исследований авторы продемонстрировали отрицательную корреляцию между чувствительностью к инсулину
и активностью антикоагулянтной системы. Активность антикоагулянтной системы также была ассоциирована с активностью ИАП-1. Авторы объясняют полученные данные как возможный механизм компенсации гипофибринолиза, имеющегося при МС [23]. В ряде других исследований значимых взаимосвязей активности антикоагулянтной системы с ожирением и МС не выявлено [24, 25].
Заключение
Результаты проведенного исследования свидетельствуют о высокой распространенности различных протромбогенных нарушений в свертывающей и противосвертывающей системах у пациентов с висцеральным ожирением и метаболическим синдромом. При этом нарушения гемостаза выявлены уже при проведении таких скрининговых тестов, как определение активированного частичного тромбопластинового времени, международного нормализованного отношения и концентрации фибриногена в плазме крови. Получены данные о положительной ассоциации выраженности отдельных выявленных нарушений гемостаза с антропометрическими и биохимическими показателями при висцеральном ожирении и метаболическом синдроме, параметрами липидного и углеводного обмена. Напротив, взаимосвязи указанных изменений коагуляции с возрастом обследованных пациентов не выявлено, следовательно, метаболический синдром и висцеральное ожирение оказывают свое протромбогенное влияние независимо от возраста. Выявленные нарушения гемостаза создают предпосылки для возникновения тромбофилии и привносят дополнительный вклад в повышение риска развития сердечно-сосудистых осложнений у пациентов данной категории. Это диктует необходимость более тщательного и углубленного обследования пациентов с висцеральным ожирением и метаболическим синдромом с целью выявления и коррекции патологических изменений липидного, углеводного обмена, систем гемостаза и фибринолиза на максимально ранних стадиях.



