Сердечная недостаточность (СН) — глобальная проблема мирового здравоохранения. По данным Американской ассоциации сердца, в настоящее время в США насчитывается 5,7 млн больных с СН, причем ежегодно регистрируется 670 000 новых случаев развития этого тяжелого заболевания [1, 2]. Согласно данным Европейского общества кардиологов, в странах Европы 15 млн человек страдают СН [3]. Результаты Российских эпидемиологических исследований (ЭПОХА-ХСН) свидетельствуют о высокой распространенности хронической СН (ХСН) I—IV функционального класса (ФК) в российской популяции, составляющей 7% (7,9 млн человек) [4].
ХСН — основная причина госпитализаций в Европе и США. Ежегодно в клиники США и европейских стран госпитализируется более 1 млн пациентов с основным диагнозом СН, что составляет от 1 до 2% от всех госпитализаций в стационары различного профиля [1, 5]. В зависимости от исходной тяжести состояния частота госпитализаций больных с ХСН в течение года составляет от 31,9 до 43,9%, что в большинстве случаев связано с развитием острой декомпенсации СН (ОДСН) [6]. Несмотря на современные технологии лечения, частота повторных госпитализаций больных с ХСН в течение первых 30 дней после выписки из стационара остается крайне высокой, доходя до 25% [7]. В результате в США только в 2010 г. на лечение больных с СН потрачено 39,2 млрд долларов, а с учетом сохраняющейся тенденции к увеличению числа заболевших к 2030 г. эта цифра может достичь астрономических 70 млрд долларов ежегодно [8, 9].
 Аналогично высокой сохраняется смертность больных с ХСН, несмотря на все усилия врачей, направленные на улучшение выживаемости пациентов этой категории. Около 50% больных умирают в течение 5 лет после постановки диагноза СН [10, 11], и наиболее высокому риску подвержены больные, перенесшие ОДСН. Для данной категории пациентов годичная смертность составляет 17,4—23,2%, а с учетом госпитальной летальности может доходить до 29% [6, 12, 13].
Аналогично высокой сохраняется смертность больных с ХСН, несмотря на все усилия врачей, направленные на улучшение выживаемости пациентов этой категории. Около 50% больных умирают в течение 5 лет после постановки диагноза СН [10, 11], и наиболее высокому риску подвержены больные, перенесшие ОДСН. Для данной категории пациентов годичная смертность составляет 17,4—23,2%, а с учетом госпитальной летальности может доходить до 29% [6, 12, 13].
В этой связи крайне актуальным является умение врача правильно оценить у пациента, особенно перенесшего ОДСН, риск повторной госпитализации или летального исхода после выписки из стационара. Верно оцененный риск развития неблагоприятного исхода позволяет вовремя провести необходимые лечебные мероприятия и не допустить развития худшего исхода у конкретного больного.
Хорошо известно, что такие проверенные временем клинико-инструментальные факторы риска, как ФК ХСН, данные обычного лабораторного обследования, варианты медикаментозного лечения, фракция выброса левого желудочка (ФВ ЛЖ), не способны дать адекватную информацию о прогнозе и риске смерти больного с ХСН [14—16]. В то же время введение в клиническую модель биомаркеров, отражающих различные звенья патогенеза СН, значительно расширяет возможности в стратификации риска.
В настоящее время определение уровня мозгового натрийуретического пептида (BNP) и его N-концевого фрагмента прогормона BNP (NT-proBNP) является общепринятым рекомендованным методом для постановки диагноза и стратификации риска у больного с ХСН [17—20]. Однако натрийуретические пептиды не «идеальны», не отражают все звенья патогенеза СН, и интерпретация результатов их определения часто затруднена в связи с известными ограничениями. Наиболее важными из них являются зависимость концентрации BNP и NT-proBNP от функции почек, индекса массы тела, возраста и пола, наличие так называемой серой зоны, а также выраженной интра- и межиндивидуальной вариации [21—25].
Поэтому появление в нашем арсенале новых биомаркеров, позволяющих расширить возможности в оценке риска у больных с СН, представляется крайне актуальным. В этой связи особенно многообещающим при ХСН выглядит «растворимый» ST2- рецептор (sST2).
Рецептор ST2 (Supression of tumorigenicity 2 — подавление туморогенности 2) является представителем семейства рецепторов интерлейкина-1 (ИЛ-1) [6, 27]. ST2 существует в двух изоформах: трансмембранной (ST2L) и «растворимой» (sST2), которая не связана с клеткой или мембраной и свободно циркулирует в системе кровообращения. В 2005 г. было показано, что лигандом рецептора ST2 является интерлейкин-33 (ИЛ-33) [28]. Биомеханический стресс (растяжение, повреждение кардиомиоцитов и фибробластов, избыточное давление) служит основным стимулом активации системы ИЛ-33/ST2 в сердце [29]. Свое кардиопротективное действие ИЛ-33 осуществляет при взаимодействии с рецептором ST2L [30]. В то же время sST2 является рецептором-«ловушкой», соединившись с которым, ИЛ-33 оказывается отсоединенным от путей проведения сигнала и оказывается неспособным реализовать свой кардиопротективный эффект [31]. В этой связи повышение концентрации sST2 у больных с ХСН имеет негативное клиническое и прогностическое значение [32—35].
Активное изучение возможности использовать этот маркер для стратификации риска у больных с ХСН происходило на протяжении последних 5—7 лет. Полученные данные позволяют предположить, что использование этого маркера расширяет наши возможности в стратификации риска у больных с ХСН дополнительно к натрий-уретическим пептидам [36—38].
Тем не менее следует отметить, что многие публикации строились на анализе баз данных соответствующих регистров или ранее проведенных завершенных клинических испытаний, что накладывает на них определенные ограничения [35, 39, 40]. Более того, для определения концентрации sST2 не всегда использовались наиболее чувствительные методики, что делает невозможным сопоставление ранее полученных данных с результатами последних клинических испытаний [41—43].
Целью нашего исследования явилось изучение возможности использования sST2 в стратификации риска у больных со сниженной ФВ ЛЖ при длительном наблюдении после перенесенной декомпенсации СН.
Материал и методы
Общая характеристика обследованных больных. В исследование были включены 159 пациентов старше 18 лет с тяжелой декомпенсированной ХСН III—IV ФК и сниженной ФВ ЛЖ (<40%), находившиеся на обследовании и лечении в Отделе заболеваний миокарда и сердечной недостаточности (ОЗМСН) с января 2012 по февраль 2015 г. Диагностика декомпенсации СН и лечение больных проводились в соответствии с существующими стандартами и рекомендациями [17—20]. Исследование было одобрено Комитетом по вопросам этики Института клинической кардиологии им. А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ. Обязательным требованием протокола являлось подписание пациентом информированного согласия на проведение исследования. Характеристика включенных в исследование пациентов представлена в табл. 1.
Дизайн исследования. Обследование больных с определением концентрации sST2 и NT-proBNP проводилось исходно при поступлении, после компенсации симптомов ОДСН при выписке из стационара, через 3, 6 мес и 1 год амбулаторного наблюдения.
Основная конечная точка исследования: в исследовании была выбрана комбинированная конечная точка (ККТ), которая включала смертность больных от сердечно-сосудистой патологии, первую повторную госпитализацию по причине декомпенсации СН, декомпенсацию СН с необходимостью введения внутривенных диуретиков и клиническую смерть больных с успешной реанимацией.
Методы исследования. Общеклиническое обследование заключалось в оценке общего состояния, выраженности одышки, застойных явлений, наличия и выраженности отечного синдрома, частоты сердечных сокращений (ЧСС) и артериального давления (АД), проведении лабораторного и биохимического анализа крови, регистрации электрокардиограммы (ЭКГ) в 12 стандартных отведениях, рентгенографии органов грудной клетки.
Оценка функционального класса СН. Для определения функционального состояния пациентов использовали классификацию ХСН Общества специалистов по сердечной недостаточности (2002 г.). Для более объективной оценки ФК ХСН применяли тест с 6-минутной ходьбой.
Трансторакальная эхокардиография с тканевой миокардиальной допплерографией. Данное исследование выполняли на ультразвуковом сканере Philips iE-33, кардиологическим датчиком с диапазоном частот от 1 до 5 МГц. Систолическую функцию ЛЖ оценивали в двухмерном режиме по методу дисков. Конечный систолический объем (КСО) и конечный диастолический объем (КДО) ЛЖ, объем левого предсердия определяли в апикальной четырехкамерной позиции. ФВ ЛЖ определяли по методу Симпсона. С целью оценки диастолической функции ЛЖ в режиме импульсной допплерографии измеряли параметры трансмитрального диастолического потока (Е/А, A—Ar, а также времени замедления кровотока раннего диастолического наполнения ЛЖ — DT и времени изоволюмического расслабления — IVRT). Скорость движения фиброзного кольца измеряли в режиме тканевой миокардиальной допплерографии и использовали для оценки давления наполнения ЛЖ по показателю E/E'.
Исследование активности нейрогормональных систем. Кровь из локтевой вены брали в пробирку, содержащую раствор ЭДТА (из расчета 2 мг/мл крови), и обычную пробирку с осадочными гранулами в зависимости от характера определяемого биомаркера. Пробирки центрифугировали в течение 15 мин со скоростью 2500 об/мин при температуре +4 ºС. Надосадочную жидкость в объеме 500 мкл разливали в отдельные микропробирки типа Eppendorf, пробы замораживали и хранили при температуре –70 ºС. Оценку биомаркеров [NT-proBNP, sST2, высокочувствительного тропонина Т (hs-TnT)] выполняли в отделе нейрогуморальных и иммунологических исследований Института клинической кардиологии им. А.Л. Мясникова.
Концентрации NT-proBNP и hs-TnT в сыворотке крови определяли электрохемилюминесцентным способом (принцип «сэндвича») на анализаторе Elecsys 2010 с использованием соответствующих коммерческих наборов proBNPII и TroponinThs. Диапазон измерений NT-proBNP: 5—35000 пг/мл, для тропонина Т: 3—10000 пг/мл.
Определение концентрации sST2 проводили с использованием иммуноферментного набора для количественного определения ST2, который также работает по принципу иммуноферментного анализа («сэндвич») аналогично определению описанных выше биомаркеров. Метод является высокочувствительным, диапазон измерений sST2 2—200 нг/мл.
Статистическую обработку полученных данных проводили с использованием пакета программ SPSS Statistic 18. В работе использовали следующие методы статистического анализа: проверка нормальности распределения количественных признаков с помощью критерия Колмогорова—Смирнова. Корреляционный анализ, в котором для параметрических показателей применяли коэффициент корреляции Пирсона, для непараметрических данных — коэффициент Спирмена. Для оценки различия параметрических переменных использовали парный и непарный критерий t Стьюдента. Сравнительный анализ групп проведен с использованием χ2 теста. Непараметрические данные анализировали по методу Манна—Уитни. Отрезные значения концентрации маркеров, а также определение их чувствительности и специфичности получены в ходе ROC-анализа.
Оценку прогноза осуществляли с использованием регрессионного анализа. Многомерная статистика и определение выживаемости выполнены с использованием регрессионного анализа Кокса и метода Каплана—Мейера. Для оценки достоверности изменения показателей на фоне лечения использовали непараметрический знаковый и ранговый критерий Вилкоксона. Исследуемые параметры представлены в зависимости от типа распределения непрерывных признаков в виде M±sd, где М — среднее, sd — стандартное отклонение, или Ме (LQ; UQ), где Ме — медиана значения, межквартильный интервал (LQ; UQ) с указанием 25-го и 75-го перцентилей их распределения. Критические значения уровня значимости принимали равными 5%.
Результаты
Общая характеристика обследованных больных. В исследование были включены 159 пациентов (114 мужчин — 71,6% и 45 женщин — 28,4%) с тяжелой декомпенсированной ХСН III—IV ФК и сниженной ФВ ЛЖ (средняя ФВ ЛЖ 28,0±6,2%). Развитие ХСН было обусловлено ишемической болезнью сердца (n=94, 59,1%), дилатационной кардиомиопатией (n=24, 15,1%) и длительно существующей артериальной гипертонией (n=41, 25,8%) с формированием декомпенсированного «гипертонического сердца». Средний возраст больных составил 63,1±11,4 года. Характеристика включенных в исследование пациентов представлена в табл. 1.
Изменение концентрации биомаркеров за время госпитализации. Средняя длительность пребывания в стационаре больных с декомпенсацией СН составила 13,4±2,12 дня. За время пребывания в стационаре у больных с декомпенсацией СН наблюдалось достоверное снижение концентрации sST2 c 60,5 (41,95; 92,87) нг/мл при поступлении до 38,43 (24,67; 63,72) нг/мл (∆%= –30,13 (–42,07; –17,64)%) при выписке из стационара (p<0,0001). Кроме того, статистически значимо снижалась и концентрация NT-proBNP: с исходных 3615,0 (1578,0; 6289,3) пг/мл до 2165,5 (982,7; 4221,3) пг/мл (∆%= –38,27 (–49,7; –24,34) %) при выписке из клиники (p<0,0001). В то же время концентрация hs-TnT за период пребывания в стационаре изменялась незначительно: при поступлении 29,95 (21,85; 49,63) пг/мл, при выписке 28,37 (21,29; 46,6) пг/мл (∆% = –11,23 (–5,67; –21,12) %). При поступлении концентрация sST2 коррелировала с уровнем NT-proBNP и hs-TnT (r=0,494 и r=0,363 соответственно; p<0,0001), а также с ФВ ЛЖ (r=–0,316; р=0,001).
Значения биомаркеров за время пребывания в стационаре и долго-срочный прогноз. Долгосрочный прогноз оценивали за 1 год наблюдения больных в протоколе. Средний период наблюдения составил 295,3±113,2 дня. За этот период было зафиксировано 78 (49,1%) различных сердечно-сосудистых исходов. ККТ исследования достигли 56 (35,2%) больных (табл. 2). От сердечно-сосудистой патологии умерли 26 (16,4%) больных, всего было зарегистрировано 47 (29,6%) повторных госпитализаций из-за СН, и у 10 (6,2%) пациентов произошло развитие декомпенсации, требовавшее амбулаторного внутривенного введения диуретиков.
При анализе больных в зависимости от достижения ими ККТ исследования оказалось, что развитие повторной декомпенсации или госпитализации из-за СН или смерти от сердечно-сосудистой патологии чаще наблюдалось у больных с исходным более тяжелым состоянием (ФК ХСН, оценка по шкале ШОКС), имевших более выраженное нарушение систолической функции ЛЖ и увеличение объемов ЛЖ, более низкий уровень систолического АД и гемоглобина в крови. Закономерно эти больные имели значительно более высокие исходные концентрации sST2 и NT-proBNP, более высокий процент проведения сердечной ресинхронизирующей терапии и имплантации различных устройств (электрокардиостимулятор; имплантируемый кардиовертер-дефибриллятор), и более чем в 3 раза чаще пациенты находились на терапии дигоксином (табл. 3).

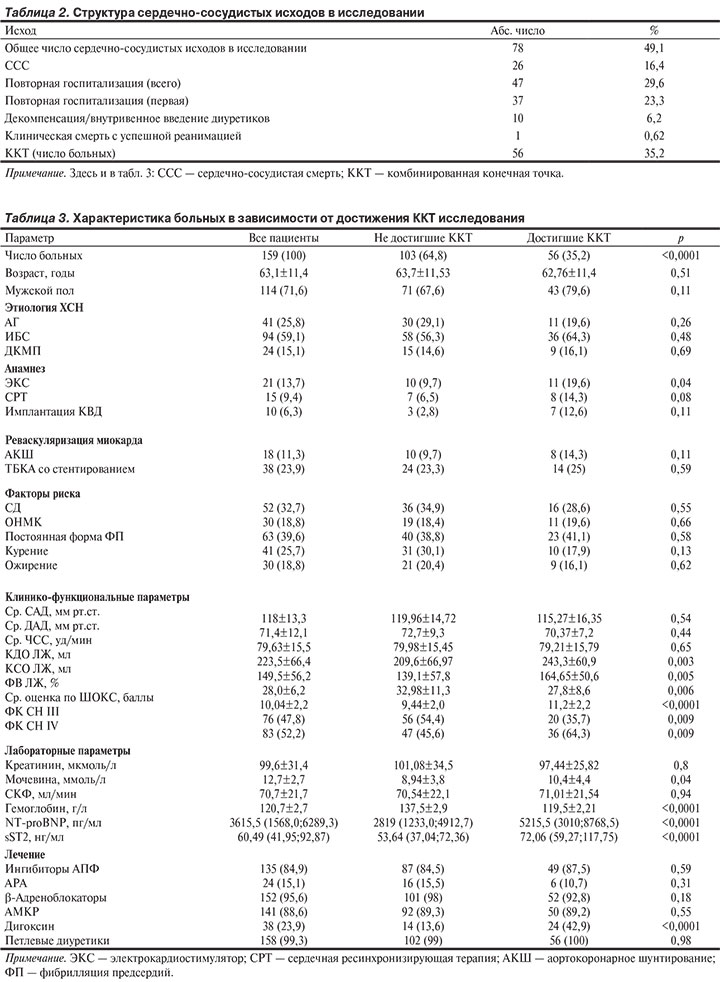
Для выяснения прогностической значимости sST2 в сравнении с NT-proBNP и hs-TnT в отношении развития ККТ за 365 дней наблюдения были построены ROC-кривые. Площадь под кривой для концентрации sST2 и NT-proBNP, определенных при поступлении, была практически одинаковая: соответственно 0,695 (при 95% доверительном интервале — ДИ от 0,604 до 0,785; p<0,0001) и 0,700 (при 95% ДИ от 0,613 до 0,788; р<0,0001) и недостоверно уступала по своей силе стандартной клинико-биохимической модели (КБМ: пол, возраст, ишемическая природа СН, уровень систолического АД, сахарный диабет 2-го типа, ФВ ЛЖ, ФК СН, креатинин крови — 0,718 при 95% ДИ от 0,624 до 0,839; р<0,0001). Однако при выписке из стационара площадь под кривой (AUC) для sST2 была значимо больше площади для NT-proBNP (соответственно 0,772 при 95% ДИ от 0,688 до 0,856; p<0,0001 и 0,727 при 95% ДИ от 0,639 до 0,816; p<0,0001; рис. 1). В то же время максимальной прогностической значимостью для долгосрочного прогноза больных после декомпенсации СН обладала комбинация sST2 и NT-proBNP c площадью под кривой при поступлении 0,750 (при 95% ДИ от 0,663 до 0,837; p<0,0001) и соответственно 0,802 (при 95% ДИ от 0,714 до 0,881; p<0,0001) при выписке из стационара.
Прогностическая ценность значений hs-TnT для развития у больных ККТ при длительном наблюдении была минимальной: соответственно 0,642 (при 95% ДИ от 0,532 до 0,753; p=0,016) и 0,665 (при 95% ДИ от 0,557 до 0,774; p=0,005) при поступлении и выписке из стационара.
Тем не менее последовательное введение в КБМ каждого отдельного маркера (hs-TnT + NT-proBNP + sST2) достоверно увеличивало площадь под кривой, и максимальной она становилась при добавлении в модель значений sST2 при выписке больных из стационара — 0,843 (при 95% ДИ от 0,761 до 0,925; p<0,0001). При последующем проведении многофакторного анализа оказалось, что значения sST2 у больных при выписке из стационара являлись самым мощным предиктором развития ККТ при длительном наблюдении, способным повысить прогностическую ценность любой из создаваемых моделей, в отличие от NT-proBNP (табл. 4).
Как показал проведенный ROC-анализ и регрессионный анализ Кокса, риск развития ККТ при длительном наблюдении больного после перенесенной декомпенсации СН был значительно выше при наличии у пациента отрезных значений концентрации NT-proBNP ≥3249,5 пг/мл (относительный риск – ОР 3,15 при 95% ДИ от 1,53 до 6,48 (p=0,001)) и ≥1696 пг/мл (ОР 4,41 при 95% ДИ от 1,41 до 9,624 (p<0,0001)); sST2 ≥60,2 нг/мл (ОР 3,97 при 95% ДИ от 1,65 до 9,55 (р=0,002)) и ≥37,8 нг/мл (ОР 6,755 при 95% ДИ от 3,026 до 15,082 (p<0,0001)) соответственно при поступлении и выписке (рис. 2). В то же время максимальный риск смерти и развития повторных декомпенсаций имели пациенты, у которых концентрации и sST2, и NT-proBNP были выше найденных нами пороговых значений при выписке из стационара (ОР = 11,8 при 95% ДИ от 3,16 до 43,77; р<0,0001).
Изменение концентрации sST2 за время пребывания в стационаре также оказалось важным, и площадь под ROC-кривой составила 0,696 при 95% ДИ от 0,596 до 0,796 (p<0,0001) для риска развития ККТ. При этом статистически значимо более высокий шанс развития эпизода ККТ (ОР 3,68 при 95% ДИ от 2,05 до 6,64; p<0,0001) как в кратковременном, так и долгосрочном периоде, имели больные с недостаточной степенью снижения концентрации маркера, составлявшей менее –28,3% (∆%) за период пребывания в стационаре (см. рис. 2). Тем не менее добавление ∆% sST2 за период пребывания в стационаре в модель значений sST2 при выписке не усиливало прогностическую ценность исходной модели, и площадь под ROC-кривой оставалась практически неизменной: AUC=0,767 (при 95% ДИ от 0,681 до 0,853; p<0,0001).

Исходя из полученных данных ROC-анализа о максимальной прогностической значимости для долгосрочного прогноза у больных после декомпенсации СН комбинации sST2 и NT-proBNP, мы провели анализ развития ККТ в зависимости от имевшихся у пациентов значений этих биомаркеров при выписке из стационара (соответственно больше или меньше 37,8 нг/мл и больше или меньше 1696 пг/мл). Построение кривых Каплана—Мейера на основании описанных выше отрезных значений концентраций sST2 и NT-proBNP демонстрирует четкое разделение выделенных групп больных уже в ранние сроки после выписки из стационара (p<0,001). Причем статистическая значимость в достижении ККТ в исследовании отсутствовала (р=0,7) только между больными с концентрацией NT-proBNP ≥1696 пг/мл, но sST2 <37,8 нг/мл или sST2 ≥37,8 нг/мл, но NT-proBNP <1696 3="" sst2="" nt-probnp="" 4="" p="">
Максимальная частота наступления ККТ за 1 год наблюдения (20,1%) выявлена у пациентов со значениями двух маркеров выше обозначенных отрезных уровней при выписке из клиники, минимальное (3,1%) — ниже отрезных концентраций и для sST2, и для NT-proBNP.
Важно отметить, что у 13 (36,1%) пациентов в группе промежуточного риска концентрация NT-proBNP при выписке из клиники была низкой (ниже найденного нами порогового уровня) и составляла 1297,5 (821,1; 1475,0) пг/мл, и эти больные были переведены нами в группу более высокого риска только на основании значений sST2 (≥37,8 нг/мл). В итоге определение концентрации sST2 дополнительно к NT-proBNP позволило нам реклассифицировать риск у больных после ОДСН дополнительно в 10,6% случаев.
В дальнейшем мы проанализировали динамику концентраций sST2 и NT-proBNP у больных в зависимости от наличия или отсутствия ККТ за 1 год наблюдения. Оказалось, что при длительном наблюдении у 91,2% больных без эпизодов ККТ концентрации sST2 и NT-proBNP оставались ниже определенных отрезных значений этих маркеров при выписке из стационара: соответственно <37,8 нг/мл и <1696 5="" p="">
Обсуждение
Наше исследование было посвящено поиску новых возможностей в стратификации риска и оценке длительного прогноза у больных после перенесенной декомпенсации СН. С этих позиций нами был изучен sST2 — один из наиболее интересных «новых» маркеров СН. В качестве «золотого стандарта» сравнения были выбраны NT-proBNP — биомаркер, рекомендованный в настоящее время для диагностики и оценки прогноза у больных с ХСН, а также высокочувствительный тропонин Т, введенный в Рекомендации Американской ассоциации сердца для стратификации риска у больных с СН в 2013 г. [19]. В начале обсуждения следует подчеркнуть основные принципиальные моменты и положения нашего клинического испытания. Во-первых, в исследование были включены больные с декомпенсированной СН и сниженной ФВ ЛЖ, находящиеся в наиболее тяжелом состоянии, имеющие самый высокий риск развития различных сердечно-сосудистых осложнений в течение 1-го года после выписки из стационара, что соответствовало выбранному нами периоду наблюдения пациентов в нашем протоколе. Во-вторых, определение концентрации биомаркеров, включая sST2, проводилось многократно и не только во время госпитализации, но и на протяжении всего периода наблюдения. В-третьих, результаты нашего исследования меняют традиционные представления о NT-proBNP как наиболее на-дежном маркере, используемом для оценки прогноза у больных с ХСН в настоящее время. Как свидетельствуют результаты нашего исследования, sST2 не только не уступает, но и в значительной мере расширяет возможности применения значений концентрации NT-proBNP в стратификации риска у больных после декомпенсации СН. С чем это может быть связано?

Вероятнее всего, это обусловлено интегративными свойствами данного биомаркера, отражающего изменения в трех основных звеньях патогенеза СН: воспаление, фиброз и миокардиальный стресс [29—31]. Как известно, ST2 существует в двух формах: трансмембранной (ST2L) и растворимой (sST2), лигандом ST2-рецептора служит ИЛ-33 [28]. Причем основным стимулом активации системы ИЛ-33/ST2 в сердце является биомеханический стресс (растяжение, повреждение кардиомиоцитов и фибробластов, избыточное давление), выраженность которого напрямую зависит от тяжести состояния больного с СН [29]. Взаимодействуя с ST2L, ИЛ-33 реализует свое кардиопротективное действие за счет блокады процессов фиброза, гипертрофии и воспаления в сердце. В то же время sST2 является рецептором-ловушкой, соединившись с которым, ИЛ-33 оказывается отсоединенным от путей проведения сигнала и неспособным реализовать свой кардиопротективный эффект [31]. В этой связи степень повышения концентрации sST2 у больных с ХСН является отражением выраженности фиброза, ремоделирования, воспаления и нагрузки объемом на сердце, имеет негативное клиническое и прогностическое значение [32—35] и объясняет его широкие возможности для применения в качестве чувствительного маркера для стратификации риска у больных с СН.
Согласно результатам нашего исследования, sST2 оказался более прогностически надежным предиктором развития ККТ у больных после ОДСН при длительном наблюдении по сравнению и со стандартной КБМ, и с такими «классическими» биомаркерами СН, как NT-proBNP и hs-TnT. Причем в многофакторном анализе sST2 достоверно улучшал любую из тестируемых моделей с анализом параметров и при поступлении больных в состоянии выраженной декомпенсации, и при выписке из стационара после лечения. Наибольшей прогностической значимостью в отношении долго-срочного прогноза обладали концентрации маркера при выписке больных из ОЗМСН. Найденное нами при ROC-анализе отрезное значение концентрации sST2 ≥37,8 нг/мл четко делило больных на группы высокого и низкого риска развития сердечно-сосудистых осложнений при длительном наблюдении. Причем концентрации sST2 у больных без развития ККТ оставались ниже этого отрезного значения не только при выписке из стационара, но и на протяжении практически всего периода наблюдения в исследовании. Безусловно, это важный факт, на который мы можем опираться в стратификации риска у больных с тяжелой СН. Согласно результатам других ранее проведенных исследований, это значение находилось в более низких пределах: равных 33,2, 35 и 36,3 нг/мл [32, 40, 44], однако применительно к нашему клиническому испытанию безусловно следует делать поправку на более тяжелый контингент обследованных больных, имеющих самый высокий риск развития сердечно-сосудистых осложнений в течение года после выписки из стационара.
Достаточно ли для стратификации риска определить только концентрации sST2 у больных при выписке из стационара? Важный вопрос, на который мы также попытались дать ответ в нашем исследовании, в первом случае проанализировав значение изменения концентрации маркера за период лечения, а во-втором — дополнительно введя в анализ концентрации NT-proBNP.
Как следует из полученных нами результатов, для снижения риска сердечно-сосудистой смерти (ССС)/госпитализации из-за СН при длительном наблюдении больных после ОДСН необходимо добиваться уменьшения концентрации sST2 минимум на 28,3% за время их пребывания в стационаре. Эта цифра близка по значению к референсной биологической вариабельности маркера, составляющей 30% [43, 45], значительно превышает его индивидуальную вариабельность (10—11%) [43, 45] и несколько отличается от ранее полученных данных 2 других клинических работ, оценивавших степень снижения концентрации sST2 за время пребывания в стационаре больных ОДСН в сопоставлении с их прогнозом при последующем наблюдении [46, 47]. В исследовании S. Boisot и соавт. необходимым условием улучшения краткосрочного прогноза и снижения риска смерти за 90 дней наблюдения являлось уменьшение концентрации sST2 за период пребывания больных в стационаре на 15,5% (интервал определения 4 дня) [46]. В то же время в клиническом испытании T. Breidthardt и соавт. «ответчиками» считались больные c острой СН со снижением концентрации sST2 более чем на 25% за первые 48 ч лечения. В этом исследовании у умерших при длительном наблюдении пациентов снижение концентрации маркера составило 25% против 42% у выживших больных [47].
В нашей работе шанс развития у больных CCC/госпитализации из-за СН при длительном наблюдении был в 3,68 раза выше у пациентов с недостаточной степенью снижения концентрации sST2 за период пребывания в стационаре. Тем не менее, добавление ∆% sST2 за период пребывания в стационаре в модель значений sST2 при выписке из стационара не усиливало прогностическую ценность исходной модели, и площадь под ROC-кривой оставалась практически неизменной: соответственно 0,772 против 0,767. На первый взгляд, полученные результаты свидетельствуют об отсутствии необходимости измерения степени изменения маркера за период пребывания больных в стационаре для оценки долгосрочного прогноза — достаточно определения только концентрации sST2 при выписке. В то же время при исходно очень высоких концентрациях sST2 больные могут иметь «достаточную» степень снижения концентрации sST2, но при этом не достигать найденного нами необходимого отрезного значения маркера (37,8 нг/мл) при выписке из стационара. Значимость определения степени снижения концентрации sST2 во время пребывания больных в стационаре также продемонстрирована в исследовании С. Llibre и соавт. [48], и изменение значений sST2 за период лечения являлось независимым предиктором неблагоприятного прогноза у больных при годичном наблюдении после выписки из стационара. Медиана изменения концентрации этого маркера за период лечения в стационаре (с определенными оговорками) была сопоставима с нашим найденным значением и составила –28,4%.
Принимая во внимание, что в нашем исследовании наиболее высокое прогностическое значение имела комбинация sST2 и NT-proBNP, концентрации которых были определены при выписке больного из стационара, мы также провели анализ развития ККТ в зависимости от имевшихся у пациентов значений этих биомаркеров (соответственно больше или <37,8 нг/мл и больше или <1696 p="">
Оказалось, что максимальную частоту наступления ККТ за 1 год наблюдения (20,1%) имели пациенты со значениями двух маркеров выше обозначенных отрезных уровней при выписке из клиники, минимальное (3,1%) — ниже отрезных концентраций и для sST2, и для NT-proBNP. В этом случае третью группу промежуточного риска составили пациенты, имевшие при выписке значение только одного из маркеров (или sST2, или NT-proBNP) выше обозначенного «отрезного» уровня. Важно отметить, что аналогичные данные были также получены А. Bayes-Genis и соавт., но для несколько иных значений sST2 и NT-proBNP (соответственно 50 нг/мл и 1829 пг/мл) у больных с ХСН [36]. Таким образом, определение концентрации этих двух маркеров при выписке из стационара после стабилизации клинического состояния позволяет более точно ранжировать больных по риску развития повторной декомпенсации/госпитализации из-за СН и ССС при длительном амбулаторном наблюдении по сравнению со значениями только NT-proBNP или только sST2.
Заключение
Таким образом, по сравнению с N-концевым фрагментом прогормона мозгового натрийуретического пептида, высокочувствительным тропонином Т и стандартной клинико-биохимической моделью концентрация растворимого рецептора подавления туморогенности 2-го типа обладает большей прогностической ценностью в отношении риска развития комбинированной конечной точки у больных после декомпенсации сердечной недостаточности. Причем, как следует из результатов нашего исследования, концентрация растворимого рецептора подавления туморогенности 2-го типа у больных при выписке из стационара является самым мощным предиктором, усиливающим прогностическую ценность любой из рассматриваемых клинико-биохимических моделей в комбинации со значениями N-концевого фрагмента прогормона мозгового натрийуретического пептида и высокочувствительного тропонина Т.
В то же время комбинация растворимого рецептора подавления туморогенности 2-го типа и N-концевого фрагмента прогормона мозгового натрийуретического пептида значительно расширяет возможности в стратификации риска у больных после острой декомпенсации сердечной недостаточности. Наиболее высокий риск сердечно-сосудистой смерти/повторной декомпенсации сердечной недостаточности в течение года имеют пациенты с концентрацией растворимого рецептора подавления туморогенности 2-го типа ≥37,8 нг/мл (относительный риск 6,775; p<0,0001) и N-концевого фрагмента прогормона мозгового натрийуретического пептида ≥1696 пг/мл (относительный риск 4,41; p<0,0001) при выписке из стационара. Серийное определение концентрации растворимого рецептора подавления туморогенности 2-го типа и N-концевого фрагмента прогормона мозгового натрийуретического пептида свидетельствует о необходимости снижения уровня этих биомаркеров ниже найденных нами отрезных значений (соответственно <37,8 нг/мл и <1696 2-="" n-="" 3="" 6="" 12="" p="">



