Растущее число пациентов, страдающих ишемической болезнью сердца (ИБС), получают ацетилсалициловую кислоту (АСК) и тиенопиридины (клопидогрел, прасугрел) либо тикагрелор с целью профилактики цереброваскулярных и сердечно-сосудистых ишемических осложнений. Кроме того, количество проводимых чрескожных коронарных вмешательств (ЧКВ) с имплантацией коронарных стентов также неуклонно увеличивается. Таким образом, повышается потребность в применении двухкомпонентной антитромбоцитарной терапии (обычно АСК в сочетании с тиенопиридином). Врачи в настоящее время сталкиваются с ситуациями, когда периоперационный риск развития геморрагических осложнений необходимо сбалансировать относительно индивидуального риска тромбозов и тромбоэмболий.
Операции коронарного шунтирования (КШ) сопровождаются риском развития геморрагических осложнений — частота рестернотомий по поводу кровотечений составляет около 3% при первом и 5% при повторном вмешательстве. Послеоперационные кровотечения и повторные операции с целью их остановки ассоциированы с увеличением времени пребывания больных в отделении интенсивной терапии, увеличением числа гемотрансфузий и развитием респираторных осложнений [1, 2], что увеличивает стоимость процедуры [3], повышает после-операционную заболеваемость [4], риск развития раневых инфекций, иммунодефицита [5—7] и смертность [8, 9].
Во многих публикациях рассматривался вопрос выявления факторов риска (ФР) развития послеоперационных кровотечений. В недавнем обзоре [10] эти ФР суммированы в 3 категории: 1) связанные с пациентом (возраст старше 70 лет, предоперационная анемия, женский пол, проведение антитромбоцитарной терапии и др.); 2) связанные с процедурой (увеличение длительности искусственного кровообращения — ИК, проведение повторной операции, тип операции и др.); 3) связанные с особенностями организации периоперационного лечения пациентов (отсутствие команды специалистов разного профиля, реализующей алгоритмы снижения объема кровопотери и потребности в гемотрансфузиях, отсутствие алгоритма проведения гемотрансфузий в клинике и др.). В ряде исследований отмечено, что в группе приема клопидогрела в периоперационном периоде КШ возраст был значительно выше, чем в отсутствие терапии тиенопиридином [11], и это могло быть более важным ФР развития геморрагических осложнений, чем непосредственно прием препарата.
Клиническая значимость тиенопиридинов доказана настолько хорошо, что становится невозможно отказываться от их применения. Например, в крупном рандомизированном двойном слепом исследовании CAPRIE, включившем 19 185 пациентов, показано, что профилактическая терапия клопидогрелом ассоциировалась с 7% снижением относительного риска (ОР) развития инфаркта миокарда (ИМ), острого нарушения мозгового кровообращения (ОНМК) по ишемическому типу и смерти от сосудистых заболеваний [12]. Результаты исследования CURE, включившего 12 562 пациентов в течение 24 ч от момента развития острого коронарного синдрома (ОКС), показали, что комбинированная терапия АСК и клопидогрелом связана с 20% снижением сердечно-сосудистой смертности, частоты развития ИМ и цереброваскулярных осложнений (9,3% в группе клопидогрела, 11,4% в группе плацебо) [13]. В исследовании CREDO оценивали безопасность и эффективность клопидогрела, назначаемого в сочетании с АСК, до проведения ЧКВ. У пациентов, получивших клопидогрел за 6 ч до процедуры, отмечалось 35% снижение смертности, частоты развития ИМ и потребности в экстренной реваскуляризации симптом-связанной артерии [14].

Данные о клинической эффективности новых препаратов — тикагрелора и прасугрела — получены из ограниченного числа рандомизированных контролируемых исследований (РКИ), однако в них продемонстрированы преимущества этих препаратов по сравнению с клопидогрелом. Тикагрелор против клопидогрела при ОКС изучался в крупном проекте PLATO [15], включившем 18 624 пациентов, в котором выявлено 16% абсолютное снижение годичного риска смерти, развития ИМ и ОНМК в группе тикагрелора по сравнению с группой клопидогрела (9,8 и 11,7% соответственно). Применение прасугрела при ОКС изучалось в исследовании TRITON-TIMI-38 [16], в котором 13 608 пациентов были рандомизированы в группы прасугрела и клопидогрела. Использование первого ассоциировалось с 18% снижением частоты «первичной конечной точки» (совокупный показатель смертности от сердечно-сосудистых осложнений и частоты развития нефатальных ИМ и ОНМК): 12,1% в группе клопидогрела и 9,9% в группе прасугрела.
Указанные факторы способствуют тому, что в реальной клинической практике применение тиенопиридинов перед хирургическими вмешательствами, в частности перед КШ, становится распространенным. Например, в недавнем крупном фармакоэкономическом исследовании [17], проведенном в США, в котором изучались затраты на проведение операций КШ при ОКС, показано, что несмотря на относительно невысокую распространенность данного вида вмешательств при ОКС (9,3%, 148 96 операций у 160 168 пациентов), частота применения клопидогрела в этой популяции пациентов высока (8101 случай), и в 62,1% случаев операции КШ проводились в течение 3 сут после отмены препарата.
Показания к приему тиенопиридинов можно суммировать следующим образом:
- клопидогрел 75 мг/сут рекомендован в качестве альтернативы АСК у пациентов c непереносимостью или гиперчувствительностью к последнему, получающих антиагреганты с целью вторичной профилактики ишемических осложнений при диагностированном атеросклеротическом поражении коронарных артерий или других сосудистых бассейнов (класс рекомендаций I, уровень доказательности В [18]);
- клопидогрел является разумной альтернативой АСК у пациентов с непереносимостью или гиперчувствительностью к последнему, подвергшихся КШ (IIa, С [18]);
- комбинация АСК и клопидогрела 75 мг/сут может применяться у некоторых пациентов со стабильной ишемической болезнью сердца (IIb, С [18]);
- клопидогрел 75 мг/сут (либо АСК) должен применяться при клинически проявляющемся атеросклеротическом поражении артерий нижних конечностей (I, А [18]);
- монотерапия клопидогрелом 75 мг/сут (либо комбинацией АСК и дипиридамола) должна проводиться после перенесенных некардиоэмболических ОНМК по ишемическому типу либо транзиторных ишемических атак с целью вторичной профилактики сосудистых осложнений (I, А [19]; I, B [18]);
- добавление клопидогрела или тикагрелора к АСК рекомендовано при ОКС и в течение последующих 12 мес при выборе консервативной тактики лечения (I, В [19, 20]);
- после имплантации стентов с лекарственным покрытием и простых металлических стентов применение клопидогрела, прасугрела или тикагрелора в дополнение к АСК должно продолжаться в течение года (для всех 3 препаратов I, В [20, 21]).
Трудности, связанные с периоперационным применением тиенопиридинов, заключаются в особенностях их фармакологического действия. Известно, что активные метаболиты клопидогрела и прасугрела, взаимодействия с тиоловыми группами рецепторов P2Y12 тромбоцитов приводят к их необратимой деполимеризации (олигомеры диссоциируют до димеров) и потере способности связываться с их эндогенными лигандами. Это служит причиной нарушения чувствительности тромбоцитов к действию аденозиндифосфата (АДФ) и снижению агрегационной способности клеток. Восстановление функции тромбоцитов после отмены тиенопиридинов происходит в течение 5—7 сут — периода, необходимого для полного (или почти полного) замещения циркулирующей массы тромбоцитов «новыми» клетками [22, 23]. В то же время тикагрелор по своим фармакокинетическим свойствам отличается от указанных препаратов. Прежде всего отличия касаются взаимодействия с АДФ-рецепторами: в отличие от клопидогрела и прасугрела, тикагрелор связывается с рецепторами P2Y12 обратимо, теоретически позволяя более быстрое (менее чем период жизни) восстановление функции тромбоцитов. Тем не менее агрегационная способность последних восстанавливается после отмены препарата медленнее, чем ожидается, что, вероятно, обусловлено циркуляцией в крови активных метаболитов тикагрелора с более длительным периодом полувыведения [24].
Существующий риск развития кровотечений, связанный с применением антиагрегантов, во многом зависит от двух факторов: 1) степени ингибирования функции тромбоцитов, которая является производной исходной их функции (до начала антиагрегантной терапии) и клеточного ответа на действие препарата; 2) способности «новых» тромбоцитов восстановить агрегационную активность после отмены препарата. Это приводит к индивидуальной вариабельности активности АДФ-рецепторов тромбоцитов [25]. Известно, что антиагрегантный эффект клопидогрела может быть ничтожным почти у 30% пациентов [26], а у некоторых восстановление функции тромбоцитов может произойти быстрее рекомендованных 5 сут периода ожидания [26, 27].




К сожалению, существующие рекомендации зачастую значительно расходятся в отношении особенностей периоперационного применения антитромбоцитарных препаратов, в частности тиенопиридинов, как при вмешательствах на сердце, так и при экстракардиальных процедурах. Если в отношении периоперационного применения АСК достигнуто относительное согласие: АСК-терапия пожизненна и не должна прерываться перед проведением хирургических вмешательств, если АСК принимается с целью вторичной профилактики после перенесенных ОНМК, ОКС, ИМ или коронарной реваскуляризации, независимо от времени, прошедшего с момента назначения препарата (за исключением случаев с высоким геморрагическим риском либо вмешательств, при которых даже небольшое по объему кровотечение может сопровождаться фатальными последствиями, например, при нейрохирургических процедурах [28, 29]), то в отношении приема тиенопиридинов (в качестве монотерапии или дополнительно к АСК) согласие отсутствует. Рекомендации относительно периоперационного применения тиенопиридинов суммированы в табл. 1.
Известно, что воспаление, гиперкоагуляция и гипоксические состояния ассоциируются с нестабильностью атеросклеротических бляшек и развитием периоперационных артериальных тромбозов. Повышение напряжение сдвига в коронарных артериях, развивающееся вследствие выброса стрессовых гормонов, может привести к последующей активации тромбоцитов, еще более повышая риск развития острого тромбоза коронарной артерии [35]. В то же время ингибирование функции тромбоцитов снижает экспрессию маркеров воспаления [36], а внезапное прекращение антитромбоцитарной терапии сопровождается неблагоприятным «рикошетным» феноменом [37], когда протромботические факторы начинают преобладать над противотромботическими. Хорошо известно, что преждевременное прекращение терапии клопидогрелом после имплантации стентов является ведущим ФР развития неблагоприятных исходов. Так, в исследовании у 2229 пациентов после имплантации стентов с лекарственным покрытием досрочная отмена препарата явилась наиболее значимым ФР развития тромбоза стентов (ОР 57,1; р<0,001) и ассоциированной с этим смертности (45%) [38]. По сравнению с теми, кто продолжил лечение, у пациентов, которые прекратили прием последнего в течение 1 мес после ЧКВ, оказались больше риск смерти (в 10 раз — 0,7 и 7,5% соответственно; р<0,001) и частота повторных госпитализаций (14 и 23% соответственно; р=0,08) в течение последующих 11 мес [39]. Этот риск гораздо более выражен в периоперационном периоде: прекращение приема клопидогрела в течение первых 3 нед после ЧКВ с целью проведения «больших» операций ассоциируется со смертностью, достигающей 71% [28].
В ранних работах по изучению терапии клопидогрелом перед проведением КШ сообщалось об увеличении числа кровотечений и потребности в хирургическом гемостазе. Например, в одной из первых работ, посвященной этой тематике, отмечалось, что у пациентов, получавших препарат в предоперационном периоде, по сравнению с контрольной группой имелись почти в 6 раз больший риск подвергнуться рестернотомии и на 20% большая потребность в трансфузиях эритроцитов [4]. Аналогично в работе R.H. Hongo и соавт. сообщено, что у пациентов, получивших клопидогрел в течение 7 сут до операции, определялись повышение потребности в повторных операциях, увеличение объема отделяемого по дренажам, объема перелитых эритроцитов, тромбоцитов и свежезамороженной плазмы [40]. В одном исследовании установлено, что у пациентов, которым требовалось проведение экстренной хирургической реваскуляризации миокарда, невозможность отменить клопидогрел, по крайней мере, за 7 сут до операции сопровождалась неприемлемой частотой гемотрансфузий и повторных операций по поводу кровотечений, независимо от типа проведенной операции (с использованием ИК или без него) [41]. Тем не менее в работе S.-W. Song и соавт. [42] показано, что проведение терапии клопидогрелом вплоть до момента операции не оказывает неблагоприятного влияния на послеоперационную кровопотерю, потребность в гемотрансфузиях и повторных операциях после КШ без использования ИК у пациентов с ОКС.
В одном ретроспективном одноцентровом исследовании у 659 пациентов, подвергшихся первичному КШ [43], изучалась потребность в гемотрансфузиях в 4 группах: получавших клопидогрел и АСК, получавших монотерапию этими препаратами и не получавших антиагреганты. Выяснилось, что вероятность проведения гемотрансфузий была наиболее высокой в группе клопидогрела и АСК: отношение шансов (ОШ) 2,1 при 95% доверительном интервале (ДИ) от 1,0 до 4,5, тогда как в группах монотерапии АСК и клопидогрелом повышения риска отмечено не было. Схожие данные получены в исследовании C.R. Herman и соавт., которые продемонстрировали, что прием клопидогрела в течение 24 ч до операции явился независимым предиктором потребности в гемотрансфузиях (ОШ 2,4 при 95% ДИ от 1,8 до 3,3; р<0,001) и развития геморрагических осложнений (ОШ 2,1 при 95% ДИ от 1,3 до 3,6; р=0,004) [44]. В то же время авторы показали, что риск кровотечений не повышается при отмене препарата за 2 сут и более до операции (ОШ при отмене за 2 сут 0,7 при 95% ДИ от 0,2 до 2,2; р=0,52 и ОШ при отмене за 5 сут 0,8 при 95% ДИ от 0,3 до 2,7; р=0,76), а потребность в гемотрансфузиях — при отмене тиенопиридина за 3 сут и более до вмешательства (ОШ при отмене за 3 сут 1,1 при 95% ДИ от 0,6 до 1,8; р=0,84 и ОШ при отмене за 5 сут 1,0 при 95% ДИ от 0,6 до 1,6; р=0,93).

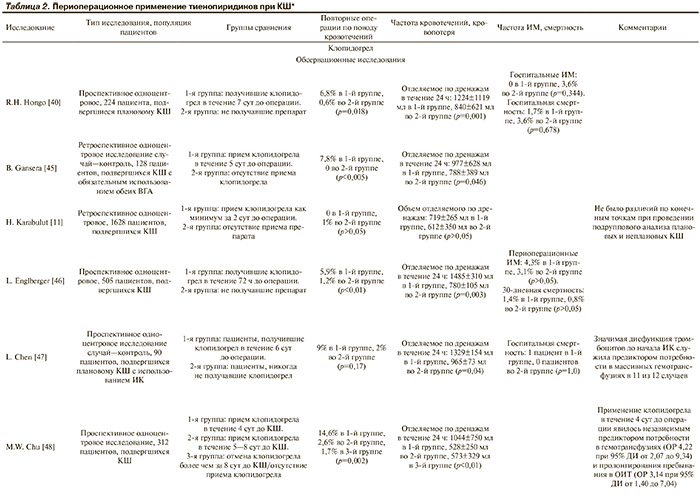
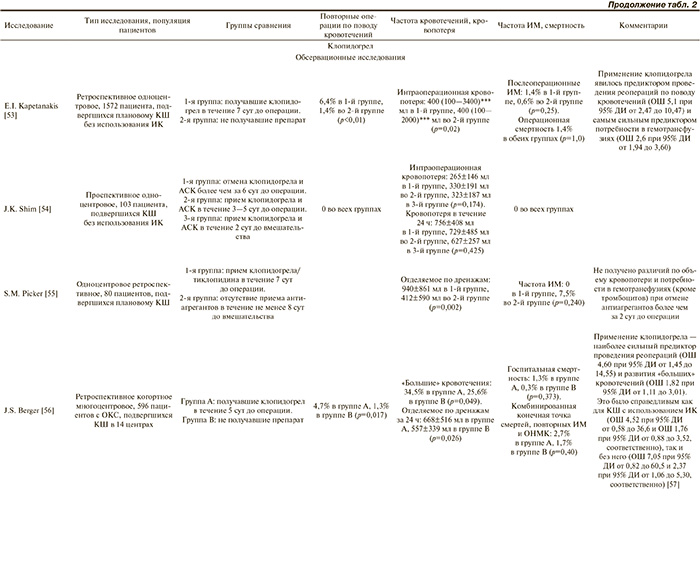
Большинство проведенных исследований применения тиенопиридинов (преимущественно клопидогрела) в периоперационном периоде КШ имеют серьезные ограничения. Они являлись одноцентровыми и ретроспективными, и во многих случаях в них не сообщались важные с клинической точки зрения факторы (лабораторные показатели, маркеры гемостаза, операционные находки); часто группами сравнения были пациенты с ОКС, нуждающиеся в проведении срочного либо экстренного КШ (группа пациентов, получавших клопидогрел перед операцией), и пациенты со стабильной ИБС, которым, соответственно, проводились плановые вмешательства, сопровождавшиеся отменой антиагрегантов. В свою очередь, существующие данные РКИ ограничены подгрупповым анализом, и очень редкие проекты спланированы непосредственно для популяции пациентов, готовящихся к КШ. Краткий обзор исследований, посвященных проблеме периоперационного применения тиенопиридинов, приведен в табл. 2.
В крупном мета-анализе 34 исследований [75], суммарно включивших 22 584 пациентов, подвергшихся КШ, показано, что, несмотря на увеличение риска смерти в группе получавших клопидогрел перед операцией по сравнению с лицами, не принимавшими препарат (группа АСК; ОШ 1,6 при 95% ДИ от 1,3 до 2,0; р<0,001), этот риск во многом обусловлен наличием ОКС и экстренностью хирургического вмешательства. При анализе исследований пациентов с ОКС не получено значимых различий по уровню смертности, частоте развития послеоперационных ИМ и ОНМК. Комбинированный показатель смерти, ИМ и ОНМК не отличался в группах сравнения. Частота повторных операций была выше при приеме клопидогрела, однако снизилась с течением времени и была сопоставимой в обеих группах у пациентов с ОКС. Не получено значимых различий в показателях конечной точки при выделении подгрупп пациентов, подвергшихся КШ с использованием ИК и без него.
Еще в одном систематическом обзоре 20 исследований (23 668 пациентов) [76] предоперационное назначение клопидогрела сопровождалось увеличением послеоперационной смертности (ОШ 1,2 при 95% ДИ от 1,0 до 1,5, p=0,03), а частота развития ИМ была сопоставима в группах клопидогрела и его отсутствия. Применение препарата сопровождалось также более высокой частотой трансфузии эритроцитов (ОШ 1,8 при 95% ДИ от 1,4 до 2,4; p<0,001) и повторных операций (ОШ 2,2, 95% ДИ 1,4 до 3,3; p<0,001). Как и в предыдущей работе, авторы отметили влияние фактора времени на результаты лечения: в подгрупповом анализе повышенный риск проведения повторных операций наблюдался лишь в работах, опубликованных до 2006 г.
В другом систематическом обзоре исследований клопидогрела перед КШ [77] показано, что назначение препарата в течение 5—7 сут перед операцией ассоциируется с увеличением объема отделяемого по дренажам на 30—100%, повышением потребности в гемотрансфузиях и 2—5-кратным увеличением риска повторных операций. В то же время отмена клопидогрела перед проведением процедур реваскуляризации сопровождалась 1% абсолютным увеличением риска развития ИМ.
В мета-анализе F. Biancari и соавт. [78] продемонстрировано, что в обсервационных исследованиях периоперационное применение клопидогрела ассоциировалось с повышением риска смерти (ОР 1,3 при 95% ДИ от 1,0 до 1,7) и проведения повторных операций по поводу кровотечений (ОР 1,9 при 95% ДИ от 1,4 до 2,6), увеличением объема кровопотери (среднее различие 158 мл при 95% ДИ от 62 до 254) и потребности в трансфузиях эритроцитов (ОР 1,2 при 95% ДИ от 1,1 до 1,4). В то же время результаты исследований CREDO и CLARITY показали отсутствие значимого влияния предоперационной терапии клопидогрелом на риск смерти, развития ИМ и «больших» кровотечений по TIMI.
В очень редких работах проводилась оценка возможности предоперационной терапии тиенопиридинами предупреждать развитие периоперационных сосудисто-мозговых и сердечно-сосудистых осложнений. Тем не менее существуют данные о наличии у клопидогрела, принимаемого в предоперационном периоде КШ, церебропротективных свойств. Так, в исследовании [79] 99 пациентов (из них 49 в группе двухкомпонентной терапии), подвергшихся КШ с применением ИК, показано, что применение клопидогрела и АСК (начатое как минимум за 48 ч до операции и продолженное до момента проведения последней) сопровождалось меньшим когнитивным дефицитом в послеоперационном периоде в сравнении с группой монотерапии АСК. При этом ни в одной из групп не зафиксировано летальных исходов либо повторных операций по поводу кровотечений.
Очевидно, что подход к предоперационной антитромбоцитарной терапии при КШ должен учитывать как вероятный геморрагический риск, так и риск развития ишемических осложнений в периоперационном периоде. В связи с этим в литературе предлагались алгоритмы предоперационной антитромбоцитарной терапии при кардиохирургических вмешательствах и при экстракардиальных процедурах [28, 80]. Один из таких алгоритмов применительно к лечению пациентов перед проведением КШ приведен на рисунке. Этот алгоритм, по-видимому, наиболее полно отражает актуальность проблемы периоперационного применения антиагрегантов перед КШ. При этом следует отметить, что единственным методом проведения «переходной» терапии авторы считают введение блокаторов гликопротеиновых рецепторов IIb/IIIa (но не гепаринов). Это находит свое подтверждение и в некоторых клинических рекомендациях [30], в которых указывается, что «нефракционированный и низкомолекулярные гепарины не способны обеспечить уровень антитромбоцитарного действия, сравнимый с таковым при приеме клопидогрела или АСК».
Мы провели краткий обзор некоторых проблем, связанных с предоперационным применением тиенопиридинов перед КШ. В целом следует отметить, что в настоящее время недостаточно данных, подтверждающих наличие у препаратов этой группы положительных свойств, перевешивающих ассоциированное с их применением увеличение операционного геморрагического риска. Поэтому мы полагаем, что наиболее безопасным подходом является отказ от применения этой группы в предоперационном периоде (отмена за 3—5 сут до вмешательства).



