Известно, что проявления дисплазии соединительной ткани (ДСТ) вследствие всеобъемлющего распространения соединительной ткани полиорганны и включают, в частности, сердечно-сосудистые синдромы — клапанный синдром (пролапсы и/или миксоматозная дегенерация клапанов), сосудистый синдром (расширение и аневризмообразование артерий различного типа — аневризма аорты, расширение конуса легочной артерии, аневризмы церебральных артерий, патологическая извитость магистральных артерий головы и висцеральных артерий; варикозное расширение вен), аритмический синдром (нарушения функции синоатриального узла, экстрасистолия, пароксизмальные нарушения ритма сердца (НРС) и др. [1—5]. Указанные проявления могут нести непосредственную угрозу жизни и здоровью пациентов вследствие прогрессирующего течения и развития осложнений, таких как разрывы аневризм или спонтанная диссекция артериальных сосудов различной локализации (развитие артериальных кровотечений, субарахноидальных кровоизлияний), отрыв хорд левого желудочка, угрожающие жизни НРС, внезапная смерть [2, 6—8]. В известной отечественной и зарубежной литературе отсутствуют способы оценки суммарного риска развитиясердечно-сосудистых осложненеий (ССО) у пациентов с недифференцированным формами ДСТ. С целью персонифицированной оценки риска развития неблагоприятных сердечно-сосудистых проявлений (НССП) ДСТ у пациентов молодого возраста проведено проспективное 7-летнее исследование.
Материал и методы
В исследование были включены 549 пациентов, имеющих признаки ДСТ, в возрасте от 18 до 45 лет, из них 330 (60,11%) мужчин. Средний возраст в группе наблюдения составил 23,51±8,67 года.
Критерии включения: наличие признаков недифференцированной ДСТ; возраст 18—45 лет; подписанное информированное согласие. Критерии исключения: наличие заболеваний, лежащих в основе патологии аорты (атеросклероз, сифилитический аортит, болезнь Такаясу, гигантоклеточный артериит, микотическая аневризма, травма грудной клетки) и/или церебральных артерий (черепно-мозговая травма, атеросклероз); употребление наркотических средств, злоупотребление алкоголем на момент включения; наследственные синдромы ДСТ у пациента и/или родственников первой линии родства.

Диагноз ДСТ устанавливали по совокупности фенотипических признаков дисморфогенеза соединительной ткани [1, 9]. Динамическое наблюдение подразумевало выполнение комплексного обследования и проведение лечебно-профилактических мероприятий в соответствии с действующими рекомендациями [1, 3, 10—12]. Случаи наступления клинически значимых НССП ДСТ расценивались как конечная точка. После анализа общей группы пациентов были сформированы подгруппа 1 (n=156; пациенты с ДСТ и НССП) и подгруппа 2 (n=156; пациенты с ДСТ без НССП).
Было проведено молекулярно-генетическое обследование пациентов с ДСТ и группы контроля (n=180) с исследованием полиморфизмов следующих генов: ангиотензинпревращающего фермента ACE (I/D 287 п.н., rs4646994), β1-адренорецептора ADRB1 (Ser49Gly, rs1801252), транскрипционного фактора Sp4 (A80807T, rs1011168), матриксной металлопротеиназы (ММР) 3-го типа (5A/6A) и 9-го типа (8202 A/G).
Статистическую обработку полученных данных осуществляли с использованием пакета программ Statistica 10,0 (StatSoft). При распределении, отличном от нормального, данные представлены в виде Ме (медиана) и LQ—UQ (нижний и верхний квартили), при нормальном распределении — в виде М (среднее значение) ± S (среднеквадратичное отклонение). Рассчитывали относительный риск (ОР), отношение шансов (OШ) и характеристики теста — чувствительность (Se), специфичность (Sp); прогностическая ценность положительного и отрицательного результата теста (Pv+ и Pv– соответственно). Для выявления группы риска применяли оценку информативности и расчет прогностического коэффициента признака с построением суммарных прогностических таблиц с использованием метода Кульбака и неоднородной последовательной статистической процедуры распознавания. За минимальную информативность для включения признака в прогностическую таблицу принимали I (xj)=0,5. Величину пороговых сумм прогностических коэффициентов рассчитывали исходя из допустимого уровня α (ошибка первого рода) 0,05 (5%), β (ошибка второго рода) — 0,05 (5%): +13 (гипотеза/заболевание А) и –13 (гипотеза/заболевание В) и допустимого уровня α (ошибка первого рода) 0,01 (1%), β (ошибка второго рода) — 0,01 (1%): +20 (гипотеза/заболевание А) и –20 (гипотеза/заболевание В). Критическое значение уровня значимости (р) принималось равным 5%.
Результаты и обсуждение
В наблюдаемой группе пациентов исходно средний диагностический коэффициент ДСТ составил 28,84±10,76 (при 95% доверительном интервале — ДИ — от 27,94 до 29,74), преобладали пациенты с «выраженной» формой ДСТ (n=339 или 61,75% при 95% ДИ от 57,52 до 65,81). При оценке признаков ДСТ в соответствии с Национальными рекомендациями [9] оценка системной вовлеченности составила 3,00 балла (2,00—4,00 балла), с наибольшей частотой регистрировались повышенная диспластическая стигматизация/повышенная преимущественно висцеральная диспластическая стигматизация (59,19%), синдром пролапса митрального клапана — ПМК (28,23%), значительно реже — доброкачественная гипермобильность (8,93%), марфаноидная внешность (1,46%), элерсоподобный фенотип (1,46%), неклассифицируемый фенотип (0,55%), MASS-фенотип (0,18%).
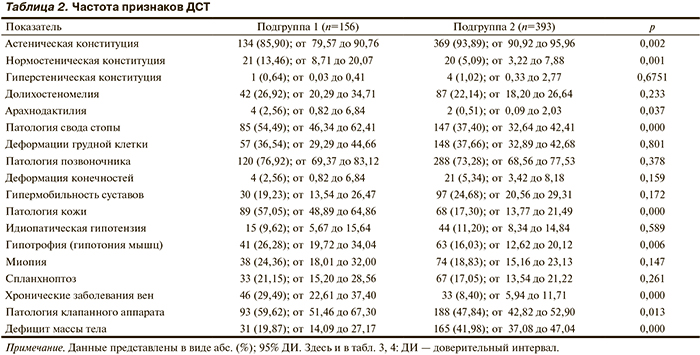
В соответствии с существующим положением о прогредиентности течения ДСТ [2, 13] и континууме «факторы риска (ФР) — клинические проявления — осложнения», с учетом данных литературы к клинически значимым НССП были отнесены следующие: формирование расширения и/или диссекцию и/или разрыв крупных сосудов артериального русла любой локализации (включая аорту, церебральные артерии); субарахноидальные кровоизлияния вследствие разрыва сосудистых мальформаций; тромбоэмболия легочной артерии; транзиторные ишемические атаки и/или нарушения мозгового кровообращения по ишемическому типу эмболического генеза; прогрессирующая клапанная недостаточность на фоне пролапса клапанов сердца; инфекционный эндокардит на фоне диспластикозависимой патологии клапана; отрыв хорд клапана сердца; выраженные нарушения процессов реполяризации миокарда (2—3-й степени) неатеросклеротического генеза; симптомные клинически значимые НРС, требующие медикаментозной и/или немедикаментозной коррекции (желудочковая экстрасистолия высоких градаций, пароксизмальная желудочковая тахикардия, первичная фибрилляция предсердий, клинически манифестирующий синдром предвозбуждения желудочков, синдром удлиненного интервала QT), внезапная смерть. В изучаемой группе пациентов с ДСТ у 156 (28,42% при 95% ДИ от 24,72 до 32,43%) было зафиксировано 217 клинически значимых НССП при средней длительности наблюдения общей группы пациентов с ДСТ 7,49±3,44 года. Средний возраст манифестации НССП составил 27,95±8,14 года. За период наблюдения не было зарегистрировано случаев ранней или внезапной смерти. Среди НССП, развившихся в 28,42% случаев, наиболее частыми были расширение/аневризма грудной аорты (10,75%), церебральный сосудистый синдром (10,56%) и НРС (9,11%) (табл. 1).
С учетом того, что зарегистрированные НССП в большинстве своем не являются строго специфичными для ДСТ и встречаются с определенной частотой в общей популяции, закономерно возникает вопрос о роли известных общепопуляционных ФР развития неинфекционной патологии. При проведении сравнительного анализа подгруппы пациентов с развившимися НССП (подгруппы 1; n=156) и подгруппы пациентов с ДСТ без НССП (подгруппы 2; n=393) были получены следующие данные: в подгруппы 1 было значимо больше мужчин: n=104 (66,67% при 95% ДИ от 58,62 до 73,88%) и n=226 (57,51% при 95% ДИ от 52,45 до 62,43%), соответственно в подгруппы 1 и подгруппы 2 (р=0,048). Общепопуляционные факторы риска (артериальная гипертензия, курение, злоупотребление алкоголем, тяжелый физический труд) регистрировались в подгруппы с одинаковой частотой: n=24 (15,38% при 95% ДИ от 10,29 до 22,22) и n=40 (10,18% при 95% ДИ от 7,46 до 13,71) в подгруппы 1 и 2 соответственно (р=0,1537).
Формирование и естественное течение НССП наиболее полно прослежено в группах пациентов с синдромными формами ДСТ — синдромом Марфана, Элерса—Данло, Лойе—Дитца и др. [7, 14—17]. В то же время отсутствие настороженности в отношении неблагоприятных исходов, основанное на распространенном представлении о более «легком» течении несиндромных форм ДСТ, приводит к неверной тактике ведения пациентов. Известно, что недифференцированные формы ДСТ проявляются развитием тех же сердечно-сосудистых синдромов с повышением в сравнении с общей популяцией частоты ранней и внезапной смерти [1—3]. Накопленные отечественные наблюдения совершенно очевидно указывают на клиническую и прогностическую гетерогенность группы пациентов с недифференцированными формами ДСТ, что находит свое отражение в попытках их классифицировать на основе фенотипических различий [1, 3], прогноза прогрессирования (появление новых признаков или усугубление выраженности имеющихся) диспластического процесса [9]. Ранее в работах отечественных исследователей [3, 9, 19] было продемонстрировано, что выраженность системной ДСТ во многом определяет клинический прогноз. Для оценки значимости качественных и количественных характеристик диспластического процесса в формировании повышенного риска развития НССП были оценены проявления ДСТ в соответствии с существующими подходами.

Так, пациенты подгруппы 1 имели достоверно больший количественный показатель вовлеченности различных органов и систем: в подгруппе 1 пациентов с вовлеченностью ≥3 систем было статистически значимо больше (n=121 или 77,56% при 95% ДИ от 70,05 до 83,68) в сравнении с подгруппой 2 (n=198 или 50,38% при 95% ДИ от 45,33 до 55,42; р=0,000). Средняя вероятность НССП среди пациентов с 3 вовлеченными системами и более составила 37,93%, при наличии менее 3 вовлеченных систем — 15,22%. Таким образом, риск развития НССП при признаке вовлеченности «≥3 систем» был в 2,5 раза выше, чем при признаке «<3 систем» (ОР 2,49 при 95% ДИ от 1,77 до 3,57; Se 0,78 при 95% ДИ от 0,71 до 0,83; Sp 0,49 при 95% ДИ от 0,47 до 0,52; Pv+ 0,38 при 95% ДИ от 0,35 до 0,41; Pv– 0,84 при 95% ДИ 0,80 до 0,88) Диагностический коэффициент (ДК) в подгруппе 1 (36,10±13,02 при 95% ДИ от 34,04 до 38,16) был значимо выше, чем в подгруппе 2 (25,96±8,09 при 95% ДИ от 25,16 до 26,76; р=0,000). При наличии признака «ДК ≥36» ОР развития НССП в 3 раза выше, чем в отсутствие признака (ОР 2,89 при 95% ДИ от 2,22 до 3,59; Se 0,42 при 95% ДИ от 0,35 до 0,48; Sp 0,88 при 95% ДИ 0,86 до 0,91; Pv+ 0,59 при 95% ДИ 0,51 до 0,67; Pv– 0,79 при 95% ДИ 0,77 до 0,81) Для признака «ДК ≥22» ОР НССП в 5 раз выше, чем в отсутствие признака (ОР,87 при 95% ДИ 2,87 до 8,61; Se 0,91 при 95% ДИ 0,86 до 0,95; Sp 0,42 при 95% ДИ 0,39 до 0,43; Pv+ 0,38 при 95% ДИ 0,36 до 0,39; Pv– 0,92 при 95% ДИ 0,88 до 0,95. В то же время различий по оценке системной вовлеченности соединительной ткани [1] не выявлено (в обеих группах медианы признака составили 3,00 балла; р=0,000). Таким образом, расчет балла системной вовлеченности в рекомендуемой трактовке (по сути, учет только признаков, характеризующих синдром Марфана) не приносит дополнительной информации. В то же время полученные результаты демонстрируют сохранение значимости расчета ДК, несмотря на то что не учитывались, в частности, нежелательные церебральные сосудистые исходы у пациентов с ДСТ [9].
Помимо приведенной общей клинической характеристики ДСТ в диагностическом плане заманчиво выглядит поиск неких отдельных внешних фенотипов ДСТ — маркеров повышенного риска. Действительно, в подгруппе 1 пациенты значимо реже имели астенический тип конституции и дефицит массы тела, чаще — нормостенический тип конституции, арахнодактилию, патологию свода стопы (сгруппированный признак: плоскостопие продольное, поперечное, полая стопа), патологию кожи (сгруппированный признак: гиперэластичная, тонкая кожа, атрофические стрии, келлоидные рубцы), мышечные проявления, хронические заболевания вен (ХЗВ), патологию клапанного аппарата (табл. 2).
Кроме того, оценено возможное влияние возраста пациентов на риск формирования НССП. За возраст сравнения в подгруппе 1 был принят возраст наступления НССП — 27,95±8,14 года (при 95% ДИ от 26,66 до 29,24 года), для подгруппы 2 — возраст на момент повторного контакта — 29,63±7,71 года (95% ДИ от 28,86 до 30,39 года; р=0,633). Для признака «возраст ≤30 лет» вероятность получить НССП в 9 раз выше, чем для признака «возраст >30лет» (ОР 8,91 при 95% ДИ от 6,62 до 12,04; Se 0,71 при 95% ДИ от 0,64 до 0,77; Sp 0,89 при 95% ДИ от 0,88 до 0,91; Pv+ 0,60 при 95% ДИ от 0,55 до 0,65; Pv– 0,93 при 95% ДИ от 0,92 до 0,95). Это наблюдение косвенное подтверждает данные о формировании риска ранней и внезапной смерти при ДСТ именно в молодом возрасте, так как наблюдаемые нами НССП при неблагоприятном развитии могут быть основой танатогенеза по результатам предшествующих исследований [18].
 Известно, что проявления ДСТ часто сопутствуют врожденным порокам и малым аномалиям развития (МАР) — это косвенно указывает на некую общность развития нарушений внутриутробного развития с неправильными закладкой и формообразованием органов, с одной стороны, и нарушениями морфогенеза и функционирования соединительнотканных структур, лежащими в основе формирования фенотипа, определяемого на современном этапе терминами «дисплазия соединительной ткани», «наследственная патология соединительной ткани», с другой. Некоторые МАР и пороки развития сердечно-сосудистой системы могут иметь самостоятельное значения в патогенезе аритмий, расширения аорты и т.д. В нашем наблюдении в подгруппе 1 МАР и пороки развития сердца и висцеральных сосудов встречались действительно значимо чаще, чем в подгруппе 2 (56,41% при 95% ДИ от 48,25 до 64,25% и 37,66% при 95% ДИ от 32,89 до 42,68% соответственно; р=0,000). Пациенты подгруппы 1 в сравнении с подгруппыой 2 значимо чаще имели полностью разомкнутый виллизиев круг (25,64% при 95% ДИ от 19,15 до 33,36% и 6,36% при 95% ДИ от 4,24 до 9,37% соответственно; р=0,000), патологию позвоночных артерий (97,44% при 95% ДИ от 93,16 до 99,18% и 62,85% при 95% ДИ от 57,84 до 68,60% соответственно; р=0,000).
Известно, что проявления ДСТ часто сопутствуют врожденным порокам и малым аномалиям развития (МАР) — это косвенно указывает на некую общность развития нарушений внутриутробного развития с неправильными закладкой и формообразованием органов, с одной стороны, и нарушениями морфогенеза и функционирования соединительнотканных структур, лежащими в основе формирования фенотипа, определяемого на современном этапе терминами «дисплазия соединительной ткани», «наследственная патология соединительной ткани», с другой. Некоторые МАР и пороки развития сердечно-сосудистой системы могут иметь самостоятельное значения в патогенезе аритмий, расширения аорты и т.д. В нашем наблюдении в подгруппе 1 МАР и пороки развития сердца и висцеральных сосудов встречались действительно значимо чаще, чем в подгруппе 2 (56,41% при 95% ДИ от 48,25 до 64,25% и 37,66% при 95% ДИ от 32,89 до 42,68% соответственно; р=0,000). Пациенты подгруппы 1 в сравнении с подгруппыой 2 значимо чаще имели полностью разомкнутый виллизиев круг (25,64% при 95% ДИ от 19,15 до 33,36% и 6,36% при 95% ДИ от 4,24 до 9,37% соответственно; р=0,000), патологию позвоночных артерий (97,44% при 95% ДИ от 93,16 до 99,18% и 62,85% при 95% ДИ от 57,84 до 68,60% соответственно; р=0,000).
Проанализировав в соответствии с рассмотренными выше принципами подгруппы пациентов с расширением/аневризмой грудной аорты (n=59), церебральным сосудистым синдромом (10,56%) и НРС (9,11%), мы выявили некоторые различия ФР.
Так, для развития указанной патологии аорты наиболее значимыми ФР оказались двустворчатый аортальный клапан (ДАК), общие ФР (артериальная гипертензия, прием алкоголя/наркотических средств; курение; тяжелый физический труд; занятие спортом), патология позвоночных артерий. ОР расширения/развития аневризмы аорты при ДАК в 11 раз выше, чем в отсутствие признака (ОР 11,36 при 95% ДИ от 7,63 до 12,34; Se 0,25 при 95% ДИ от 0,19 до 0,27; Sp 0,99 при 95% ДИ от 0,99 до 1,00; Pv+ 0,94 при 95% ДИ от 0,69 до 1,00; Pv– 0,92 при 95% ДИ 0,91—92). Генез подтвержденной в нашей группе пациентов с ДСТ известной ассоциации ДАК и расширения восходящей аорты, которая по данным литературы наблюдается даже при сохраненной гемодинамической функции клапана [19—21], связывают, в частности, с установленным при ДАК дефиците фибриллина-1, ассоциирующегося с повышением активности матриксных металлопротеиназ (ММР) [22]. Наличие общих ФР в группе пациентов с ДСТ повышало ОР в 12 раз (ОР 11,63 при 95% ДИ от 6,10 до 22,24; Se 0,58 при 95% ДИ 0,42 до 0,73; Sp 0,93 при 95% ДИ 0, 92 до 0,94; Pv+ 0,36 при 95% ДИ 0,26 до 0,44; Pv– 0,97 при 95% ДИ 0,96 до 98. Обращал внимание фактор «патология позвоночных артерий», характеризующийся высокой чувствительностью (ОР 21,81 при 95% ДИ от 3,38 до 428,17; Se 0,98 при 95% ДИ от 0,90 до 1,00; Sp 0,30 при 95% ДИ от 0,29 до 0,31). Данное наблюдение представляется интересным в свете того, что ранее не проводилась оценка состояния церебральных сосудов с точки зрения ФР. При анализе отечественной и зарубежной литературы выявлено только одно исследование в сходном направлении. Так, обсуждаемое наблюдение согласуется с данными Sh.A. Morris и соавт. (2011 г.), продемонстрировавшими связь извитости вертебральных артерий с риском развития неблагоприятных сердечно-сосудистых исходов (в частности, диссекцией аорты или сосудов шеи, необходимостью проведения кардиохирургических операций, смертью) у лиц молодого возраста с патологией соединительной ткани (синдромы Марфана, Лойеса—Дитца, Элерса—Данло, а также с неспецифическими нарушениями соединительной ткани) [23].
Для развития НССП со стороны церебральных сосудов наиболее значимыми ФР были диспластикозависимая патология кожи (ОР 2,02 при 95% ДИ 1,14 до 3,69; Se 0,72 при 95% ДИ 0,60 до 0,83; Sp 0,45 при 95% ДИ 0, 44 до 0,47; Pv+ 0,14 при 95% ДИ 0,11 до 0,16; Pv– 0,93 при 95% ДИ 0,90 до 0,96)) и позвоночника (ОР 2,16 при 95% ДИ от 1,02 до 4,86; Se 0,86 при 95% ДИ от 0,75 до 0,93; Sp 0,27 при 95% ДИ от 0,26 до 0,28; Pv+ 0,12 при 95% ДИ от 0,11 до 0,13; Pv– 0,94 при 95% ДИ от 0,90 до 0,97), «ДК ДСТ >23» (ОР 2,16 при 95% ДИ от 1,16 до 4,14; Se 0,78 при 95% ДИ от 0,65 до 0,87; Sp 0,40 при 95% ДИ от 0,39 до 0,41; Pv+ 0,13 при 95% ДИ от 0,11 до 0,15; Pv– 0,94 при 95% ДИ от 0,90 до 0,96), хронические заболевания вен (ОР 2,59 при 95% ДИ от 1,54 до 4,39; Se 0,59 при 95% ДИ от 0,46 до 0,71; Sp 0,67 при 95% ДИ от 0,66 до 0,69; Pv+ 0,18 при 95% ДИ от 0,14 до 0,21; Pv– 0,93 при 95% ДИ от 0,91 до 0,95). Кроме того, в группе пациентов с ДСТ продемонстрирована значимость таких ФР как полностью разомкнутый виллизиев круг (ОР 9,83 при 95% ДИ от 6,15 до 15,49; Se 0,57 при 95% ДИ от 0,45 до 0,68; Sp 0,94 при 95% ДИ от 0,92 до 0,95; Pv+ 0,51 при 95% ДИ от 0,40 до 0,60; Pv– 0,95 при 95% ДИ от 0,93 до 0,96) и патология позвоночных артерий (ОР 2,02 при 95% ДИ от 1,14 до 3,69; Se 0,72 при 95% ДИ от 0,60 до 0,83; Sp 0,45 при 95% ДИ от 0, 44 до 0,47; Pv+ 0,14 при 95% ДИ от 0,11 до 0,16; Pv– 0,93 при 95% ДИ от 0,90 до 0,96). Наше наблюдение согласуется с некоторыми данными, демонстрирующими, что аномалии развития виллизиева круга у больных с интракраниальными аневризмами артерий встречаются в несколько раз чаще, чем в общей популяции [24—25].
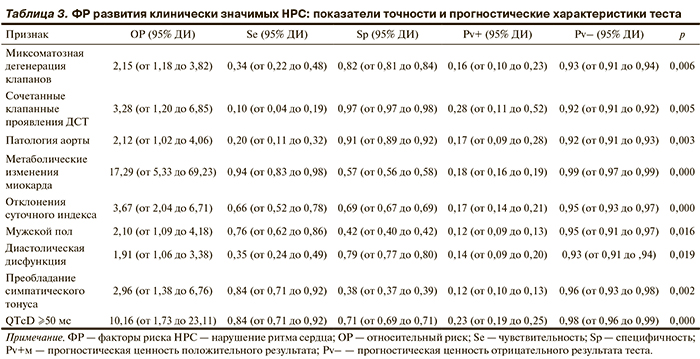
Наиболее значимыми немодифицируемыми ФР развития клинически значимых НРС были сочетанные клапанные проявления ДСТ, миксоматозная дегенерация клапанов сердца, патология аорты, мужской пол; модифицируемыми ФР были метаболические изменения миокарда, «QTcD ≥50 мс», отклонение суточного индекса, преобладание симпатического тонуса и диастолическая дисфункция левого желудочка (табл. 3).
У пациентов с недифференцированными формами ДСТ развитие НССП вследствие прогредиентного течения диспластического процесса может происходить спонтанно (в отсутствие в анамнезе явных признаков патологии, лежащей в основе развития осложнения) либо в исходе бессимптомного течения случайно диагностированной патологии, преимущественно в молодом возрасте [1—3, 9, 18]. В связи с этим чрезвычайно важно рационально планировать и осуществлять медицинское сопровождение, ориентированное на предупреждение формирования инвалидизирующих нарушений и смерти. В то же время для большинства пациентов с недифференцированной ДСТ, имеющих благоприятный прогноз жизни, чрезмерный акцент на возможности развития угрожающих жизни состояний может вести к стигматизации, психологической и, нередко, социальной дизадаптации, особенно в подростковом и молодом возрасте. Поэтому очень важен рациональный подход к формированию групп наблюдения пациентов на основе оценки риска развития НССП.
Принимая во внимание только те признаки, которые значимо различались между группами, были оценены показатели информативности (I) и рассчитаны прогностические коэффициенты для определения суммарного риска развития НССП. По результатам обращали внимание низкая информативность отдельных и сгруппированных признаков ДСТ, «маловариантность» построенной диагностической таблицы, и, следовательно, предположительно наличие клинических ситуаций с затрудненной интерпретацией риска развития НССП. Все это определяло учет прочих ФР, в частности, результатов молекулярно-генетического обследования пациентов. Основная масса исследований в этом направление посвящена одиночным нуклеотидным полиморфизмам генов ММР, которым принадлежит определяющая роль в физиологическом ремоделировании внеклеточного матрикса, ассоциированном с эмбриональным развитием и постнатальным периодом, участии в регуляции сигнальной трансдукции (моделирование активности факторов роста или их рецепторов), а также в патологическом неоангиогенезе, воспалении, опухолевой инвазии [3, 26—32]. С учетом данных литературы были выбраны следующие полиморфизмы: полиморфизм гена ММР9 (8202A/G, rs11697325; может повышать продукцию ММР-9), инсерционно-делеционный полиморфизм гена ММР3 (–1171 5А/6А, rs35068180; влияет на активность ММР-3).
Накапливаются данные о роли ренин-ангиотензин-альдостероновй системы не только как регулятора деятельности сердечно-сосудистой системы (гемодинамический фактор повреждения), но и как ключевого участника процессов фетального роста, формирования и развития органов, дифференцировки и пролиферации клеток [33, 34]. Интересно наблюдение, выявившее влияние полиморфизма гена ангиотензинпревращающего фермента (АПФ) на конечный рост у женщин: генотип II характеризуется более высоким ростом (рост на 7 см выше, чем у генотипа DD) [35]. В связи с этим мы также исследовали инсерционно-делеционный полиморфизм гена АПФ (ACE, ID, rs4646994).
В исследованиях отечественных авторов ранее продемонстрировано наличие вегетативного дисбаланса при ДСТ с преобладанием повышенного симпатического тонуса [3, 9]. В плане аритмогенного потенциала интересны данные о непосредственном значении полиморфизма Ser49Gly гена β1-адренорецептора (ADRB1, A145G, Ser49Gly, rs1801252) для клинической реализации эффектов стимуляции β1-адренорецептора, в частности, в случаях длительной гиперсимпатикотонии [36].
Наконец, с учетом значительной доли НРС и сосудистой патологии среди сердечно-сосудистых проявлений ДСТ и данных литературы об ассоциативной значимости полиморфизма транскрипционного фактора SP4 (А80807Т, rs1011168) и НРС, сосудистой патологии, внезапной смерти у человека также исследован указанный неблагоприятный генетический полиморфизм [37—41]. Анализ проведен в указанных 2 подгруппах (табл. 4).
Не получено подтверждения некоторым существующим данным о значимости полиморфизма гена АПФ в развитии НССП [42—44]. Однако отсутствие ассоциации выбранного генетического маркера с развитием НССП не может однозначно свидетельствовать об отсутствии его функциональной связи и прогностической значимости, учитывая имеющиеся данные литературы о некоторых вариантах НССП.
В подгруппе 1 в сравнении с подгруппой 2 относительно полиморфизма гена SP4 выявлено достоверное увеличение доли гомозиготного генотипа ТТ (16,67% против 4%; р=0,023); относительно полиморфизма гена β1- адренорецептора выявлена большая доля носительства гомозиготного генотипа АА (59,62% против 42%; р=0,029). По данным литературы, полиморфизм Ser49Gly гена β1-адренорецептора (N-концевой внеклеточный участок рецептора) не оказывает статистически значимого влияния на связывание лиганда с рецептором, эффективность связывания с G-белком. Тем не менее при длительном взаимодействии с агонистами в случае наличия варианта Ser49 плотность рецепторов оказывается на 25% выше, чем при варианте 49Gly. Таким образом, вариант Ser49 имеет более высокий уровень экспрессии, чем 49Gly, что может играть непосредственную роль для клинической реализации эффектов стимуляции β1-адренорецептора, в частности, в случаях длительной гиперсимпатикотонии [36]. Последний феномен считается характерным для пациентов с ДСТ. При избыточной, но относительно кратковременной стимуляции β1-адренорецепторов наблюдается их десенситизация (в клетках накапливается цАМФ в высоких концентрациях, происходит фосфорилирование рецептора и, как следствие снижение его функциональной активности), при длительной стимуляции наблюдается феномен негативной регуляции по принципу обратной связи с уменьшением количества рецепторов вследствие снижения их синтеза (down-регуляция) [45, 49]. Результаты предшествующих исследований показали, что 49Gly демонстрирует более выраженный агонистсвязанный эффект down-регуляции, чем вариант Ser49 [47]. Кроме того, при этом же варианте 49Gly клеточный уровень цАМФ и базальный и стимулированный агонистом достоверно выше, чем при варианте Ser49 [36]. Исходя из этих данных можно полагать, что по сравнению с аллелем А (Ser49) аллель G (49Gly) оказывает более выраженное протективное действие при избыточной катехоламиновой стимуляции. В контексте изложенного выявленное изменение соотношения аллелей А и G в группе пациентов с ДСТ может быть ассоциировано с развитием НССП.
Относительно полиморфизмов генов ММР выявлено повышение доли носителей гетерозиготного генотипа ММР3 (58,33% против 40%; р=0,024), установлено увеличение доли аллеля G гена ММР9 (55,77% против 42%; р=0,016). Полиморфизм 5А/6А гена ММР3 остается менее изученным, накапливаются данные о возможной роли измененной активности ММР-3 при некоторых вариантах сосудистой патологии. Так, в частности, интересно наблюдение повышенной частоты аллеля 5А гена MMР3 у лиц с семейной формой диссекции сонной артерии при наличии признаков ДСТ и в отсутствие гистологических и генетических признаков синдрома Элерса—Данло [48]. Полиморфизм –8202A/G гена ММП9 относится к некодирующему региону (5′-нетранскрибируемый регион), который, однако, может либо иметь элемент, повышающий транскрипцию и уровень ММП-9, либо характеризоваться потерей репрессора и также повышать продукцию ММП-9. Кроме того, возможно, этот вариант полиморфизма связан с функциональными вариантами других точек гена, которые могут прямо регулировать экспрессию ММП-9 [49]. Полученные данные интересны в контексте существующих наблюдений об ассоциации полиморфизма–8202A/G гена ММП9 с развитием аневризмы и диссекции грудной аорты (частота аллеля –8202G среди пациентов с аневризмой и диссекцией грудной аорты была достоверно выше, чем в группе контроля) [49], а также развитием интракраниальных артериальных аневризм [50].
Сочетание клинически значимых генотипов и аллелей в подгруппе 1 регистрировалось достоверно чаще, чем в подгруппе 2 (79,49% против 44%; р=0,000). Шанс развития НССП был выше у носителей генотипа ТТ полиморфного гена SP4 (A80807T) в 5 раз (ОШ 4,80 при 95% ДИ от 1,05 до 30,51), для носителей генотипа АА полиморфного гена ADRB1 (Ser49Gly) — в 2 раза (ОШ 2,04 при 95% ДИ от 1,02 до 4,09), для носителей аллеля G гена MMP9 (–8202 A/G) — в 1,7 раза (ОШ 1,74 при 95% от 1,08 до 2,82), для носителей гетерозиготного генотипа гена MMP3 (5A/6A) — в 2 раза (ОШ 2,10 при 95% ДИ от 1,05 до 4,23), для носителей 2 и более из представленных значимых вариантов генотипов и/или аллелей — в 5 раз (ОШ 4,93 при 95% ДИ от 2,37 до 10,33). С учетом полученных данных, показателей информативности (I) и прогностических коэффициентов по указанным молекулярно-генетическим характеристикам для определения риска развития НССП была сформирована таблица (табл. 5).
Учитывая значимость оцениваемого фактора — развитие НССП, величину пороговых сумм ДК рассчитывали исходя из допустимого уровня α (ошибка первого рода) 0,05 (5%), β (ошибка второго рода) — 0,05 (5%): +13 (гипотеза — наличие НССП) и –13 (гипотеза — отсутствие НССП). Для уменьшения вероятности ошибки до 0,01% следует использовать диагностический порог +20 и –20. По результатам оценки ФР в соответствии с приведенной таблицей при достижении порогового значения +20 пациент может быть отнесен к группе риска развития НССП.
В целом применение указанной процедуры в 181 случаях из 206 наблюдений (87,86% при 95% ДИ от 82,42 до 91,84%) продемонстрировало совпадение клинически наблюдаемого и прогнозируемого течения ДСТ: для варианта «НССП+» — 150 случаев из 156 наблюдений (96,15% при 95% ДИ от 91,44 до 98,42%); для варианта «НССП-» — 31 случай из 50 наблюдений (62% при 95% ДИ от 47,16 до 75%). Тест (процедура распознавания) показал приемлемые параметры точности (Se 96,20% при 95% ДИ от 92,89 до 98,34%, Sp 62,04% при 95% ДИ от 51,72 до 68,73%) и вероятностных характеристик (Pv+ 0,89 при 95% ДИ от 0,86 до 0,91; Pv– 0,84 при 95% ДИ от 0,69 до 0,93).
Заключение
В группе пациентов молодого возраста с дисплазией соединительной ткани в развитии ее наиболее частых неблагоприятных сердечно-сосудистых проявлений — расширение/аневризма грудной аорты, церебральный сосудистый синдром, клинически значимые нарушения ритма сердца, имеют значения различные множественные модифицируемые и немодифицируемые факторы риска. В частности, наиболее значимыми факторы риска развития патологии аорты (расширение/аневризма) были патология позвоночных артерий, общие факторы риска (артериальная гипертензия, прием алкоголя/наркотических средств, курение, тяжелый физический труд, занятие спортом), двустворчатый аортальный клапан; развития патологии церебральных сосудов — полностью разомкнутый виллизиев круг, патология позвоночных артерий, диспластикозависимые патология кожи и позвоночника, «диагностический коэффициент дисплазия соединительной ткани >23», хронические заболевания вен; развития клинически значимых нарушения ритма сердца — сочетанные клапанные проявления дисплазии соединительной ткани, миксоматозная дегенерация клапанов сердца, патология аорты, мужской пол, метаболические изменения миокарда, «QTcD ≥50 мс», отклонение суточного индекса, преобладание симпатического тонуса и диастолическая дисфункция.
Анализ параметров клинического статуса, в том числе характеристик системного дисморфогенеза соединительной ткани, и некоторых неблагоприятных генетических полиморфизмов позволяет прогнозировать развитие неблагоприятных сердечно-сосудистых проявлений в группе пациентов молодого возраста с дисплазией соединительной ткани. Это дает возможность формировать сравнительно однородные по прогнозу группы пациентов, оптимизировать алгоритм диагностических процедур, оценивать течение диспластического процесса, рационально организовывать профилактические мероприятия и долгосрочное лечение, а также анализировать эффективность лечебно-профилактических вмешательств. Индивидуальная оценка риска, основанная на клинических характеристиках и молекулярно-генетических признаках, является практическим выражением персонифицированного подхода к ведению пациентов указанной группы, что позволяет обосновать новый более эффективный подход к прогнозированию течения наследственной патологии соединительной ткани, оптимизировать подходы к предупреждению инвалидности и ранней смертности при недифференцированных формах дисплазиий соединительной ткани, основанные на принципе стратификации риска.



