Как известно, ведущей причиной развития хронической обструктивной болезни легких (ХОБЛ) является курение, и если тенденция распространения этой вредной привычки среди населения не снизится, то курение станет причиной смерти 1 млрд человек в XXI веке [1]. За период 1990—2000 гг. зафиксировано снижение смертности от сердечно-сосудистых заболеваний (ССЗ) и инсульта на 19,9 и 6,9% соответственно, однако наблюдался значительный рост смертности от ХОБЛ на 25,5%, особенно среди женщин [2, 3]. ХОБЛ занимает третье место в списке причин смертности [4].
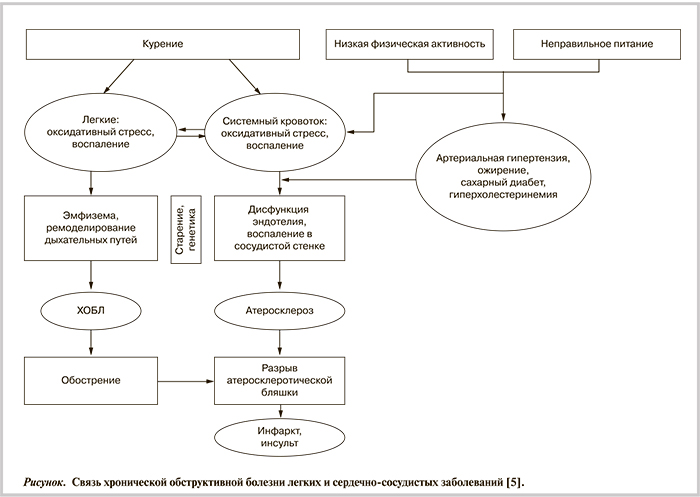
Ученые констатируют тесную связь ХОБЛ и ССЗ [5, 6] (см. рисунок).
Следует отметить, что ключевым звеном патогенеза ХОБЛ и ССЗ являются воспаление, оксидантный стресс, истощение антиоксидантной защиты, дисфункция эндотелия, которые запускаются в легких, а затем охватывают весь организм.
Больные ХОБЛ умирают преимущественно от ССЗ. Снижение объема форсированного выдоха за 1-ю секунду (ОФВ1) на 10% повышает сердечно-сосудистую смертность на 28% [5, 7, 8]. Так, в исследовании TORCH у больных ХОБЛ II стадии только 4% смертей было связано с дыхательной системой, 25% — с раком легких, а 28% — с ССЗ [9, 10].
Современная ингаляционная терапия ХОБЛ с использованием м-холинолитиков, β2-агонистов и глюкокортикостероидов уменьшает выраженность симптомов ХОБЛ, количество и тяжесть обострений, повышает толерантность к физической нагрузке, улучшает качество жизни этих пациентов, но, к сожалению, не влияет на смертность, не может в значительной мере препятствовать прогрессированию снижения функции легких [3, 11].
Поэтому идет поиск новых средств для лечения больных ХОБЛ, создаются новые молекулы, изучается влияние уже известных препаратов, обладающих антиоксидантным, противовоспалительным свойствами (ацетилцистеин, макролиды, блокаторы ренин-ангиотензин-альдостероновой системы, статины) [12—15].
Наибольший интерес представляют плейотропные (дополнительные) эффекты статинов у больных ХОБЛ [16]:
- противовоспалительный эффект — снижение уровня C-реактивного белка (СРБ), воспалительных цитокинов, циклооксигеназы-2, участвующей в воспалительной реакции;
- антиоксидантный эффект — снижение уровня оксидантов, вызывающих оксидантный стресс;
- иммуномодулирующий эффект — снижение концентрации цитокинов (α-фактора некроза опухолей — α-ФНО, интерлейкина-8 — ИЛ-8), Т-хелперов, макрофагов, количества молекул главного комплекса гистосовместимости II класса, ответственных за развитие клеточного Th1-иммунного ответа;
- эндотелийпротективный эффект — повышение уровня оксида азота в крови, снижение активности процессов перекисного окисления липидов;
- антиадгезивный эффект в кровотоке — снижение концентрации молекул межклеточной (ICAM) и сосудистой адгезии (VCAM-1).
Накапливаются данные о влиянии статинов у больных ХОБЛ. Так, исследователь E. Mortensen описывает ретроспективное исследование с участием 11 212 пациентов старше 65 лет, госпитализированных с обострением ХОБЛ, и отмечает уменьшение 90-дневной смертности у больных, принимающих статины [17].
Опубликован ряд исследований, показывающих следующие эффекты статинов у больных ХОБЛ: снижение общей смертности, смертности при обострении ХОБЛ, потребности в интубации при обострении ХОБЛ, смертности от ХОБЛ, уменьшение количества обострений ХОБЛ, числа случаев госпитализации, ослабление снижения легочной функции, повышение толерантности к физической нагрузке, уменьшение числа случаев рака легких [18—30]. Но эти данные получены в обсервационных, наблюдательных исследованиях, отражающих реальное использование статинов в клинической практике. Именно поэтому в настоящее время статины не включены в стандарты ведения пациентов с ХОБЛ.
Основные механизмы влияния статинов на течение ХОБЛ основаны на ингибировании ключевых воспалительных и ремоделирующих эффектов при ХОБЛ.
Статины снижают уровень воспаления как в бронхолегочной системе, так и в системном кровотоке. Противовоспалительный эффект статинов в легких обусловлен снижением инфильтрации легких нейтрофилами, уменьшением продукции провоспалительных цитокинов (ИЛ-8, ИЛ-6, α-ФНО). На фоне приема статинов снижается воспалительный ответ на легочную инфекцию. Противовоспалительный эффект статинов в системном кровотоке ведет к уменьшению темпов развития атеросклероза, снижению потери мышечной массы тела, что улучшает прогноз у больных ХОБЛ [18, 19].
 Единственное рандомизированное плацебо-контролируемое исследование у больных ХОБЛ по применению статинов завершилось в 2014 г. Это исследование STATCOPE (Simvastatin for the prevention of exacerbations in moderate-to-severe COPD), включавшее 885 пациентов, которым назначался симвастатин 40 мг/сут по сравнению с группой плацебо, не подтвердило ожидаемых результатов [31]. Авторы не наблюдали снижения количества обострений на фоне приема симвастатина. Однако данное исследование вызвало заслуженную критику за дизайн, создание «рафинированной» группы пациентов, без сопутствующей патологии, что в реальной практике встречается очень редко, и фиксированную дозу препарата [32].
Единственное рандомизированное плацебо-контролируемое исследование у больных ХОБЛ по применению статинов завершилось в 2014 г. Это исследование STATCOPE (Simvastatin for the prevention of exacerbations in moderate-to-severe COPD), включавшее 885 пациентов, которым назначался симвастатин 40 мг/сут по сравнению с группой плацебо, не подтвердило ожидаемых результатов [31]. Авторы не наблюдали снижения количества обострений на фоне приема симвастатина. Однако данное исследование вызвало заслуженную критику за дизайн, создание «рафинированной» группы пациентов, без сопутствующей патологии, что в реальной практике встречается очень редко, и фиксированную дозу препарата [32].
Несмотря на многочисленные данные обсервационных и ретроспективных исследований об эффектах статинов при ХОБЛ, по-прежнему остается открытым вопрос тактики назначения препаратов этой группы: показания, дозы, длительность терапии, целевые уровни холестерина (ХС) липопротеинов низкой плотности (ЛНП) и показатели эффективности терапии. Таким образом, в настоящее время применение статинов у больных ХОБЛ требует дальнейшего изучения.
Цель исследования: изучение влияния розувастатина на системное воспаление, оксидантный стресс, антиоксидантную защиту у больных ХОБЛ.
Материал и методы
В исследование вошли пациенты с ХОБЛ II—III стадии по GOLD 2011 г. (Global Initiative for Chronic Obstructive Lung Disease 2011 г.), находящиеся в ремиссии, 80 человек, все мужчины. Средний возраст составил 63,0±7,6 года. Пациенты подписали согласие на участие в данном исследовании.
Критерии невключения в исследование: перенесенный инфаркт миокарда, перенесенный инсульт, клинические проявления стенокардии, онкологические, ревматологические, эндокринные заболевания, декомпенсированное хроническое легочное сердце, патология почек и другие заболевания, которые могут помешать оценке полученных результатов, пороки сердца, прием системных глюкокортикостероидов менее 6 мес до начала исследования.
При расчете риска развития ССЗ по шкале SCORE (Systematic Coronary Risk Estimation) все пациенты с ХОБЛ вошли в группу высокого и очень высокого риска — 10,0 (7,0; 18,0). Таким образом, при анализе показаний липидного состава крови и риска развития ССЗ всем пациентам было показано назначение гиполипидемической терапии. Каждому пациенту были определены целевые уровни ХС ЛНП. Таким образом, показанием к назначению розувастатина было наличие не ХОБЛ, а наличие высокого риска развития ССЗ.
Пациенты были разделены на 2 группы. Активная группа (n=60) принимала препарат розувастатин (мертенил, «Гедеон Рихтер») в начальной дозировке 10 мг с последующей титрацией дозы до достижения целевых уровней ХС ЛНП в соответствии с рассчитанным риском развития ССЗ [33]. Длительность терапии розувастатином составила 1 год. Во 2-ю группу (контрольная группа) вошли 20 пациентов, которые отказались от липидснижающей терапии по своим личным причинам. Группы были сопоставимы по возрасту, длительности и тяжести ХОБЛ, применяемой базисной терапии. Базисная терапия ХОБЛ не менялась на всем протяжении исследования. Пациенты использовали ингаляционные антихолинергические препараты (ипратропия бромид, тиотропия бромид), β2-адреномиметик (фенотерол), ингаляционные глюкокортикостероиды согласно рекомендациям GOLD (2011).
Контроль липидного состава крови: исследование уровня ХС, триглицеридов, ХС липопротеинов высокой плотности (ЛВП), ХС ЛНП было проведено до начала терапии, через 1, 3, 6 и 12 мес от начала приема розувастатина. В процессе лечения все пациенты проходили общеклиническое обследование: клинический анализ крови, биохимический анализ крови.
Оценка системного воспаления проводилась с помощью высокочувствительного СРБ (вч-СРБ) турбодиметрическим методом исходно и через 12 мес терапии. Провоспалительные (α-ФНО, ИЛ-8) и антивоспалительные (ИЛ-2, ИЛ-4) цитокины на фоне приема розувастатина и в контрольной группе исследовали с помощью наборов реагентов для иммуноферментного определения концентрации цитокинов (ИЛ-2, ИЛ-4, ИЛ-8, α-ФНО) в соответствии с предложенной инструкцией на иммуноферментном анализаторе StatFax 3200. Интенсивность процессов перекисного окисления липидов (оксидантный стресс) изучали по концентрации конечных продуктов — ацилгидроперекисей (АГП) по методике В.Б. Гаврилова и М.И. Мишкорудной с использованием спектрофотометра SPECORD 205, исходно и через 12 мес [34]. Исследование процессов антиоксидантной защиты осуществлялось с помощью наборов для определения супероксиддисмутазы (СОД) и глутатионпероксидазы (ГПО) на биохимическом анализаторе.
Исследование вентиляционной функции легких проводилось на бодиплетизмографе волюметрического типа Master Lab.
Уровень одышки оценивали, используя шкалу одышки mMRC (modified Medical Research Council scale) до и после терапии [35]. Для оценки толерантности к физической нагрузке использовали тест с 6-минутной ходьбой (ТШХ) по стандартной методике с использованием пульсоксиметра. Регистрация уровня сатурации — насыщение крови кислородом (SpO2), и частоты сердечных сокращений (ЧСС) велась на протяжении всего исследования, включая восстановительной период с последующей фиксацией минимальных, максимальных и средних значений SpO2 и ЧСС, измерение интенсивности одышки по шкале Борга [36, 37]. С целью оценки прогноза выживаемости пациентам был рассчитан индекс BODE (Body mass index, Obstruction, Dyspnea, Exercise), включающий характеристики, которые отражены в табл. 1.
От 0 до 2 баллов индекса BODE соответствуют 80% выживаемости больных ХОБЛ в ближайшие 4 года, 3—4 балла — 70%, 5—6 баллов — 60%, 7—10 баллов — 20% [38].
Статистический анализ полученных результатов проводился с помощью статистической программы SPSS версии 22. Вид распределения данных определили, применяя критерий Колмогорова—Смирнова. В случае, если распределение отличалось от нормального, для описания выборки использовали медиану, первый и третий квартили. Учитывая, что в основном распределение анализируемых данных не соответствовало закону нормального распределения, сравнение двух независимых выборок проводили, применяя критерий Манна—Уитни, сравнение двух зависимых выборок выполняли с помощью двустороннего Т-критерия Вилкоксона. Сравнение выборок переменных, сводимых к дихотомическим, для несвязанных выборок проводили по двустороннему точному критерию Фишера, а для связанных выборок — по двустороннему точному критерию Мак-Немара. Статистически значимыми считались различия при p<0,05.
Результаты и обсуждение
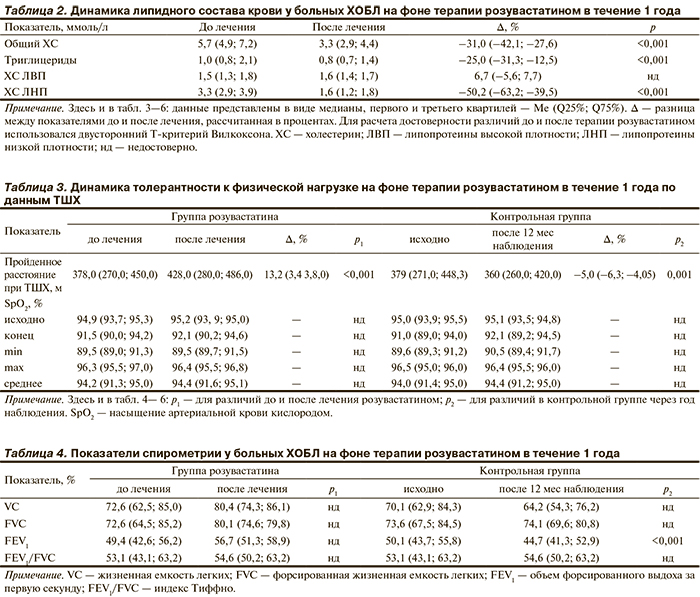
В результате титрации дозы розувастатина к 6-му мес терапии все пациенты достигли индивидуальных целевых уровней ХС ЛНП (табл. 2).
В контрольной группе статистически значимой динамики липидного состава крови не было.
На фоне терапии розувастатином выявлено статистически значимое снижение степени тяжести одышки по шкале mMRC. Увеличилось число пациентов c 1-й степенью одышки (+7%; p<0,001), снизилось число пациентов с 3-й степенью одышки (–5%; p<0,001).
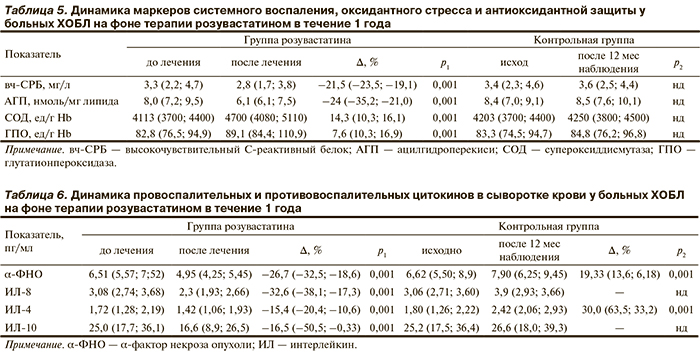
Выявлено статистически значимое повышение толерантности к физической нагрузке по данным ТШХ: увеличение пройденного расстояния в среднем на 50 м (13,2%; p<0,001), в контрольной группе наблюдалось уменьшение пройденного расстояния в среднем на 19 м, что составляет уменьшение на 5% (p=0,001). Достоверной динамики SpO2 в группе розувастатина и в контрольной группе при выполнении ТШХ не получено (табл. 3).
Контроль функции внешнего дыхания проводился на 1, 6 и 12-й месяц терапии розувастатином. Статистически значимой динамики показателей спирометрии на фоне терапии розувастатином не обнаружено, в контрольной группе наблюдалось достоверное снижение ОФВ1 (p<0,001; табл. 4).
В результате терапии розувастатином при расчете индекса BODE наблюдалась положительная динамика: достоверно увеличилось количество пациентов, имеющих 2 и 4 балла по индексу BODE, уменьшилось число пациентов с 3, 5 и 6 баллами BODE. Это обусловлено переходом пациентов в группу с меньшим значением индекса BODE, соответственно, улучшением прогноза выживаемости в ближайшие 4 года. Данные изменения связаны со снижением тяжести одышки по шкале mMRC и увеличением толерантности к физической нагрузке (ТШХ). В контрольной группе статистически значимых изменений значений индекса BODE через 12 мес не выявлено. Таким образом, получены положительные клинические эффекты применения розувастатина у больных ХОБЛ в виде уменьшения одышки, улучшения толерантности к физической нагрузке, замедления ухудшения функции легких.
На фоне терапии розувастатином наблюдались снижение уровня системного воспаления, статистически значимое уменьшение уровня вч-СРБ на 21,5% (p=0,001) и провоспалительных цитокинов (α-ФНО, ИЛ-8, p=0,001), что подтверждает противовоспалительное действие розувастатина у больных ХОБЛ. В контрольной группе динамики уровня вч-СРБ не было (табл. 5).
Как известно, больные ХОБЛ испытывают выраженный оксидантный стресс и истощение механизмов его купирования. На фоне терапии розувастатином в системе оксидант—антиоксидант наблюдалось преимущественное снижение уровня АГП — оксидантов, маркеров оксидантного стресса, продуктов перекисного окисления липидов на 24% (p=0,001) и небольшое повышение антиоксидантной защиты — увеличение уровня ферментов СОД и ГПО на 14,3 и 7,6% соответственно (p=0,001; см. табл. 5). Отсутствие статистически значимой динамики данных показателей в контрольной группе свидетельствует о еще сохраняющемся балансе в системе оксидант—антиоксидант с компенсаторной активацией антиоксидантных систем. При истощении резервов антиоксидантной защиты на фоне продолжающегося оксидантного стресса будут прогрессировать процессы сосудистого повреждения и атерогенеза.
Как было отмечено выше, в процессе терапии розувастатином снизился уровень провоспалительных цитокинов: концентрация α-ФНО уменьшилась на 26,7% (p=0,001), ИЛ-8 — на 32,6% (p=0,001) в сыворотке крови больных ХОБЛ. Кроме того, наблюдалось снижение уровня противовоспалительных цитокинов: ИЛ-4 — на 15,4% (p=0,001), ИЛ-10 — на 16,5% (p=0,001), что обусловлено снижением уровня системного воспаления и уменьшением потребности организма в цитокинах, оказывающих противовоспалительные эффекты, которые препятствуют развитию гипервоспаления через подавление активности макрофагов, продуцирующих α-ФНО и ИЛ-8.
Следовательно, данные результаты подтверждают противовоспалительные и иммуномодулирующие свойства розувастатина у больных ХОБЛ. У пациентов контрольной группы статистически значимо через год продолжало прогрессировать воспаление — увеличилась концентрация α-ФНО в сыворотке крови на 19,3% (p=0,001) и рефлекторно возросла концентрация ИЛ-4 на 30% (p=0,001), что связано с продолжением и постепенным усилением уровня системного воспаления и прогрессирования ХОБЛ (табл. 6).
Значительной динамики по показателям биохимического анализа крови, в том числе печеночных трансаминаз, глюкозы крови, не обнаружено.
Заключение
В реальной клинической практике необходим расчет риска развития сердечно-сосудистых заболеваний у всех больных хронической обструктивной болезнью легких с определением целевых уровней холестерина липопротеинов низкой плотности и назначением статинов в соответствии с общепринятыми рекомендациями. Подтверждены описанные в предыдущих исследованиях клинические эффекты розувастатина (мертенил) у больных хронической обструктивной болезнью легких (уменьшение одышки, повышение толерантности к физической нагрузке, уменьшение снижения легочной функции). Исследованы патофизиологические звенья, лежащие в основе данных клинических эффектов: противовоспалительное, антиоксидантное, иммуномодулирующее. Для разработки специфической терапевтической тактики применения статинов при хронической обструктивной болезни легких требуется проведение дальнейших исследований.



