В течение последнего года подверглись переосмыслению кардинальные аспекты ведения больных артериальной гипертонией (АГ) — целевые уровни артериального давления (АД), начало антигипертензивной терапии (АГТ), тактика назначения комбинированной терапии, стратификация риска развития сердечно-сосудистых осложнений и т.д. Эти позиции отражены в новых рекомендациях Европейского общества артериальной гипертонии (ESH) и Европейского кардиологического общества (ESC) по ведению АГ (2013) [1].
С момента выхода предыдущих клинических рекомендаций Европейского общества кардиологов по АГ прошло 6 лет [2]. За это время опубликованы результаты целого ряда клинических исследований, получены результаты вторичного анализа данных предыдущих исследований и даже разработаны принципиально новые методы лечения больных с резистентной АГ.
В клинических рекомендациях Европейского общества кардиологов (2013) выделяются 18 позиций, которые подверглись пересмотру. Наибольшее практическое значение имеют, в частности, увеличение роли домашнего мониторирования АД, акцент на важность диагностики бессимптомного поражения органов-мишеней, пересмотр факторов риска (добавление мужского пола и ожирения по индексу массы тела), изменение представлений о начале АГТ и целевых уровнях АД, выбор фармакотерапии для пациентов старческого возраста, а также новый алгоритм достижения целевого АД и схемы рациональных комбинаций антигипертензивных препаратов (АГП) [1].
Вопросы мировой гипертензиологии. Как в отечественной истории существуют вечные вопросы «кто виноват?» и «что делать?», так и мировая гипертензиология в течение нескольких десятков лет пытается ответить на свои «извечные» вопросы:
- при каком уровне АД можно ставить диагноз АГ?
- когда инициировать АГТ?
- до каких целевых уровней снижать АД?
- какова тактика назначения терапии?
- какие препараты или классы препаратов выбирать (иными словами, существуют ли препараты- и классы-лидеры)?
 Посмотрим, как новые рекомендации ответили на некоторые из этих вопросов.
Посмотрим, как новые рекомендации ответили на некоторые из этих вопросов.
Основной целью клинических рекомендаций являются унификация, алгоритмизация подходов к ведению той или иной патологии для облегчения использования рекомендаций врачами, но без примитивизации схем ведения.
Эта задача блестяще выполнена в разделе начала АГТ и определения целевых уровней АД. История гипертензиологии наглядно демонстрирует смену наших представлений и подходов к тактике АГТ, к определению целевых уровней АД у конкретного пациента.
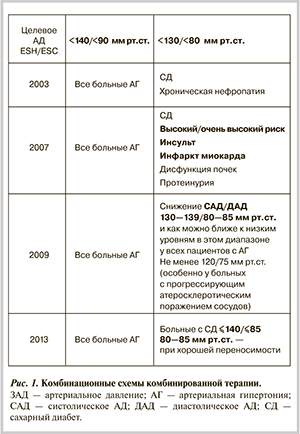
Целевые уровни АД — история вопроса. В первом докладе экспертов Научного общества по изучению АГ России (ДАГ, 2000) провозглашено снижение целевых уровней АД (менее 120/75 мм рт.ст.) по мере прогрессирования поражения почек (протеинурия, присоединение хронической почечной недостаточности). В Европейских рекомендациях по ведению АГ (2007) произошло ужесточение целевых уровней АД по сравнению с таковыми в 2003 г. (включение в группу больных с низкими целевыми уровнями пациентов с высоким и очень высоким риском развития сердечно-сосудистых осложнений — ССО) (рис. 1). Эти процессы были тесно связаны с активным продвижением комбинированной терапии. Чем жестче цель, тем более агрессивно мы должны вмешиваться с ранним использованием комбинационных схем [2].
В пересмотре Европейских рекомендаций по АГ (2009) и Российских рекомендациях по ведению АГ (2010) отражена уже более взвешенная позиция. Так, по мнению европейских экспертов, целесообразно было рекомендовать снижение АД до уровня 130—139/80—85 мм рт.ст. или как можно ближе к низким уровням в диапазоне у всех пациентов с АГ (см. рис. 1). В российских рекомендациях («Диагностика и лечение артериальной гипертензии», 4-й пересмотр, 2010) впервые обосновывается применение этапной схемы снижения АД с учетом индивидуальной переносимости, определены допустимые значения нижней границы АД при проведении АГТ (110—115/70—75 мм рт.ст.) [3, 4].
Такой отказ от предыдущей достаточно агрессивной позиции был основан на результатах целого ряда исследований и на вторичном анализе данных других исследований с участием пациентов из группы высокого риска. Получены данные, что у пациентов с высоким риском развития ССО снижение АД до 120—125/70—75 мм рт.ст. или ниже может сопровождаться увеличением частоты коронарных и церебральных осложнений, т.е. возможен феномен J-кривой [5—7].
Накопленные данные трансформировались в модификацию подходов к инициации АГТ и определению целевых уровней АД.
Позиции новых Европейских рекомендаций в отношении начала АГТ таковы:
- высоконормальное АД — назначение АГТ не рекомендовано;
- пациентам с высоким уровнем риска развития ССО при любой степени АГ — назначение АГТ немедленно;
- пациентам с АГ 1-й степени с низким и средним риском — рассмотреть начало АГТ после адекватного подтверждения АГ и изменения образа жизни в течение длительного времени;
- пациентам с АГ 2-й и 3-й степени с любой степенью риска развития ССО — назначение АГТ.
Согласованы представления по целевым уровням АД:
- целевой уровень АД менее 140/90 мм рт.ст. практически для всех групп пациентов — низкий и средний риск, хроническая болезнь почек (ХБП), после перенесенного инсульта и т.д.;
- более жесткий целевой уровень диастолического АД (ДАД) определен на уровне ≤85 мм рт.ст. для пациентов с сахарным диабетом (СД).
Европейская ассоциация СД следующим образом комментирует АГТ у больных СД:
- целевые уровни АД при СД — ≤140/≤85 мм рт.ст.;
- систолическое АД (САД) <130 мм рт.ст. может обсуждаться при наличии нефропатии с протеинурией;
- АД <130/80 мм рт.ст. может увеличивать риск побочных реакций у пожилых больных с длительным анамнезом СД [8].
Впервые в Европейских рекомендациях введены специфические для возраста критерии для начала терапии АГ и определения целей по уровню АД:
- у больных старческого возраста начало терапии при САД ≥160 мм рт.ст.;
- у больных старческого возраста начало АГТ возможно при САД 140—159 мм рт.ст. при условии ее хорошей переносимости;
- целевые уровни АД у лиц пожилого и старческого возраста — 140—150 мм рт.ст.;
- у лиц пожилого и старческого возраста моложе 80 лет может рассматриваться цель <140 мм рт.ст. при условии удовлетворительного состояния и индивидуальной переносимости;
- у лиц старше 80 лет при САД ≥160 мм рт.ст. рекомендуемая цель 140—150 мм рт.ст. при условии хорошей переносимости (физической и ментальной) [1].
 Таким образом, концепция «чем ниже, тем лучше» медленно, но верно трансформировалась в «лучше меньше, да лучше». Вывод из изложенного очевиден — необходим переход от однозначно агрессивной тактики АГТ с ранним использованием комбинированных схем и жесткими целевыми цифрами АД к взвешенному, дифференцированному подходу с максимальной индивидуализацией схем терапии.
Таким образом, концепция «чем ниже, тем лучше» медленно, но верно трансформировалась в «лучше меньше, да лучше». Вывод из изложенного очевиден — необходим переход от однозначно агрессивной тактики АГТ с ранним использованием комбинированных схем и жесткими целевыми цифрами АД к взвешенному, дифференцированному подходу с максимальной индивидуализацией схем терапии.
Практически полное исчезновение когорты пациентов с жесткими целевыми уровнями АД, как ни странно, направляет нас к более активному использованию монотерапии, принципы назначения которой можно сформулировать следующим образом:
- планируемое снижение САД/ДАД не более чем на 20/10 мм рт.ст.;
- избегать хаотичной смены препаратов в отсутствие достижения быстрого эффекта — терапия в течение 3—4 нед, особенно при использовании препаратов, блокирующих ренин-ангиотензин-альдостероновую систему (РААС);
- использовать препараты-лидеры — с хорошей антигипертензивной эффективностью, доказательной базой влияния на прогноз.
В настоящее время в клиническую практику вошли и заняли лидирующие позиции высокоэффективные АГП, уже имеющие бесспорную и солидную доказательную базу. Использование в качестве начальной и последующей монотерапии этих препаратов-лидеров (периндоприл) является однозначно эффективным и перспективным.
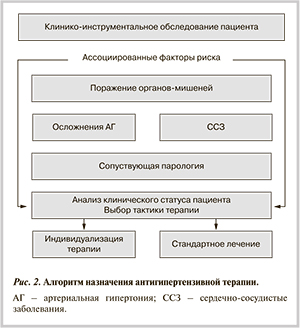
Терапевтические стратегии. К сожалению, в новых Европейских рекомендациях врачи не получили более или менее ясного алгоритма назначения АГТ, выбора класса или конкретного препарата. Европейские эксперты подтвердили позиции предыдущих рекомендаций, что основным механизмом достижения пользы АГТ является снижение АД как такового и что влияние препаратов на связанные с АГ исходы одинаково либо незначительно различается. Не подтверждено мнение о ранжировании АГП по их эффективности и влиянию на поражение органов-мишеней и прогноз. Однако европейские эксперты признают, что прогнозировать эффективность конкретного препарата у конкретного пациента невозможно, и все классы препаратов имеют свои преимущества и противопоказания. Предполагается, что при начале и продолжении АГТ врач должен учитывать «клинический портрет» пациента: наличие поражения конкретных органов-мишеней, клинические события, сопутствующие состояния (рис. 2, 3). Все это значительно усложняет выбор класса и конкретного препарата в реальной клинической практике, и начинают работать другие механизмы выбора, такие как клиническая привычка, шаблоны, принятые в конкретном лечебном учреждении, и т.д. Причина — отсутствие четкого и простого алгоритма терапии АГ. В то же время существуют примеры алгоритмированного похода к назначению АГП — Британские рекомендации по АГ (BHS — NICE. Guidelines, 2006 и 2011 гг.), которые по всем позициям критикуются в европейских рекомендациях.
 В то же время в новых Европейских рекомендациях по ведению АГ (2013) подчеркивается необходимость учитывать доказательную базу конкретного АГП, так как некоторые лекарственные средства целесообразно считать предпочтительными в конкретных клинических ситуациях (поражения определенных органов-мишеней, клинические состояния, сопутствующая патология), подтвержденных в клинических исследованиях. Целесообразно использовать препараты, эффективность которых доказана в клинических исследованиях. Таким образом, доказательная база препарата должна учитываться при выборе начальной, базисной терапии и продолжении лечения (см. рис. 3).
В то же время в новых Европейских рекомендациях по ведению АГ (2013) подчеркивается необходимость учитывать доказательную базу конкретного АГП, так как некоторые лекарственные средства целесообразно считать предпочтительными в конкретных клинических ситуациях (поражения определенных органов-мишеней, клинические состояния, сопутствующая патология), подтвержденных в клинических исследованиях. Целесообразно использовать препараты, эффективность которых доказана в клинических исследованиях. Таким образом, доказательная база препарата должна учитываться при выборе начальной, базисной терапии и продолжении лечения (см. рис. 3).
Ингибиторы ангиотензинпревращающего фермента (АПФ) относятся к лидирующему классу препаратов, рекомендованных для начальной и комбинированной терапии АГ. Однако при обсуждении эффектов ингибиторов АПФ нельзя говорить о «класс-специфических» эффектах в приложении к органопротективным воздействиям, влиянию на метаболические параметры и прогноз. Ингибиторы АПФ — разнородная группа препаратов, среди которой особняком стоит периндоприл, положительные эффекты и преимущества которого имеют сильную доказательную базу.
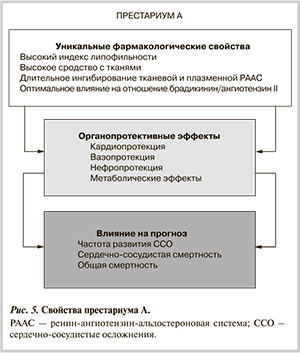
Престариум А — фармакологические свойства. Какие же фармакологические свойства ингибитора АПФ способны влиять на клинические эффекты? К таковым относятся:
- липофильные свойства препарата;
- длительность ингибирования тканевой и плазменной РААС;
- оптимальное влияние на отношение брадикинин/ангиотензин II.
Существуют различные уровни функционирования системы РААС. Острые, быстрые эффекты связаны с блокированием циркулирующей РААС (уровень АД, объем внеклеточной жидкости, электролитный гомеостаз). Способность препарата работать на тканевом и внутриклеточном уровнях тесно связана с фармакологическими свойствами, в частности, с липофильностью и индексами тканевого распределения.
Периндоприл является жирорастворимым ингибитором АПФ с высоким индексом липофильности. Показано, что препарат значительно снижает в плазме и сосудах активность АПФ, в том числе фиксированного на эндотелии и в адвентиции. Престариум А в целевой дозе (10 мг/сут) обладает наиболее высокой тканевой специфичностью среди ингибиторов АПФ. Уникальность молекулы престариума А состоит в способности эффективно блокировать АПФ тканей и сохранять данный эффект в течение оптимального для терапии АГ промежутка времени (24 ч), что позволяет принимать препарат один раз в день [9, 10]. Именно тканевые и внутриклеточные эффекты препарата обеспечивают контроль медленных процессов — ремоделирование, гипертрофию, фиброзирование и т.д. А успешная и длительная блокада тканевых и внутриклеточных систем обеспечивает органопротективные свойства препарата и, в конечном счете, влияние на прогноз.
Престариум А обладает преимуществом по влиянию на отношение брадикинин/ангиотензин II в сравнении с другими ингибиторами АПФ. И если ранее с накоплением брадикинина связывали в основном побочные эффекты ингибиторов АПФ (развитие брадикининового кашля), то в настоящее время с увеличением продукции этой молекулы ассоциируют вазопротективные, эндотелийрегулирующие, антиоксидантные, антипролиферативные, антисклеротические, кардиопротективные свойства ингибиторов АПФ, а также антиапоптотические свойства и способность модулировать функцию стволовых клеток в условиях их повреждения [11].
Плейотропные эффекты престариума А. Во многих исследованиях продемонстрирована способность престариума А корректировать липидный состав крови. Метаболические эффекты препаратов, влияющих на РААС, показаны в исследовании С.В. Недогоды. Так, на фоне терапии периндоприлом уровень холестерина (ХС) липопротеидов низкой плотности (ЛНП) снизился на 8,8%, эналаприлом — на 2,9%, лозартаном — на 4,5%, телмисартаном — на 7,4% (р<0,05 для всех препаратов при сравнении с периндоприлом) в клинической группе больных АГ и ожирением [12]. В исследовании ПРАВИЛО (ПРестариум А — Высокая эффективность в лечении пациентов с артерИальной гипертензией и дисЛипидемией в ширОкой клинической практике) на фоне терапии престариумом А в начальной дозе 10 мг в виде монотерапии или при добавлении к другим ранее принимаемым АГП наблюдалось значительное улучшением показателей липидного обмена. Так, уровень общего ХС снизился на 15%, ХС ЛНП — на 16,3%, а уровень ХС липопротеидов высокой плотности повысился на 9,5% (p<0,01) [13].
Липофильные свойства престариума А, его высокое сродство к тканям, в том числе к жировой висцеральной, обусловливают способность этого препарата регулировать выработку адипоцитокинов. Так, на фоне терапии престариумом А в дозе 10 мг уровень лептина снизился на 29,1%, что в условиях лептинорезистентности и гиперлептинемии при ожирении дает положительный эффект в виде торможения процессов фиброзирования, активизации симпатико-адреналовой системы, снижения инсулинорезистентности. Динамика лептина на фоне терапии престариумом А в полной дозе была более значимой, чем на фоне терапии эналаприлом, лозартаном и телмисартаном [12].
Способность престариума А в целевой дозе 10 мг/сут влиять на углеводный обмен подтверждена во многих исследованиях: показано улучшение чувствительности периферических тканей к инсулину, снижение уровня глюкозы в крови натощак и после приема пищи, снижение частоты развития СД [14, 15].
Органопротективные эффекты престариума А. Дозозависимый органопротективный эффект престариума А наглядно продемонстрирован в исследовании DAPHNET (Diabetes Artery Perindopril Hypertension Normalization Excess sTiffness). В него включали больных с АГ и СД 2-го типа, терапия проводилась в течение 7 мес. Престариум А достоверно улучшал параметры эластичности сонной артерии. Причем максимальная ангиопротекция наблюдалась на фоне использования полной дозы препарата. Этот эффект носил дозозависимый характер и не зависел от динамики уровня АД [16].
На фоне терапии престариумом А в дозе 10 мг также отмечено более выраженное кардиопротективное действие (уменьшение толщины стенок, индекса массы миокарда левого желудочка, коррекция диастолической дисфункции), вазопротективные эффекты (показатели жесткости сосудистой стенки, центральное давление в аорте) в сравнении с другими препаратами, блокирующими РААС [12].
Вазопротективные эффекты престариума А (коррекция функции эндотелия, торможение процессов атерогенеза) также показаны в рамках дополнительных проектов исследования EUROPA (PERSPECTIVE, PERTINENT). Так, в исследовании PERTINENT на фоне терапии у больных ишемической болезнью сердца (ИБС) выявлен значительный прирост эндотелийзависимой вазодилатации плечевой артерии по результатам ультразвукового исследования высокого разрешения [17]. В исследовании PERSPECTIVE в процессе терапии проводилось внутрисосудистое ультразвуковое исследование коронарных артерий, была показана значимая регрессия некальцинированных атеросклеротических коронарных бляшек у больных, получавших престариум 10 мг в дополнение к стандартной терапии (р<0,04) [18] (рис. 4).
 Динамика другого, не менее важного, маркера дисфункции эндотелия — апоптоза клеток эндотелия также исследовалась на фоне терапии престариумом А. Терапия препаратом в полной дозе снижала показатели апоптоза эндотелиальных клеток у больных АГ со стабильными формами ИБС в большей степени, чем терапия другими ингибиторами АПФ [19, 20].
Динамика другого, не менее важного, маркера дисфункции эндотелия — апоптоза клеток эндотелия также исследовалась на фоне терапии престариумом А. Терапия препаратом в полной дозе снижала показатели апоптоза эндотелиальных клеток у больных АГ со стабильными формами ИБС в большей степени, чем терапия другими ингибиторами АПФ [19, 20].
Престариум А — влияние на прогноз. Обсуждение уникальных фармакологических свойств престариума А и даже его органопротективных и метаболических эффектов не имело бы смысла без экстраполяции этих данных в доказательную клиническую базу с влиянием на «твердые конечные точки» (ССО, сердечно-сосудистая смерть, смерть от всех причин).
Способность препарата влиять на прогноз блестяще продемонстрирована в рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании EUROPA (European trial on Reduction Of cardiac events with Perindopril in stable coronary Artery disease), в котором приняли участие 12 218 пациентов с доказанной ИБС [21]. Результаты исследования свидетельствуют о значительном снижении суммарного риска развития нефатальных случаев инфаркта миокарда и сердечно-сосудистой смерти на 20%, фатального и нефатального инфаркта миокарда — на 24%, потребности в госпитализации из-за обострения хронической сердечной недостаточности — на 39% на фоне терапии престариумом в полной дозе. Кроме того, в других крупных клинических проектах ADVANCE, PROGRESS, HYVET терапия, основанная на престариуме, приводила к достоверному снижению сердечно-сосудистой смертности. Объединенный анализ этих исследований показал не только снижение риска развития инфаркта, инсульта и сердечно-сосудистой смертности, но и значимое снижение общей смертности, что еще раз доказывает преимущество престариума А среди препаратов своего класса и других классов АГП [22].
Заключение
Плейотропные эффекты престариума А, тесно связанные с уникальными особенностями молекулы препарата (высокий индекс липофильности, оптимальное соотношение влияния на соотношение активности брадикинин/ангиотензин II), трансформируются в разностороннее «клиническое портфолио» препарата, венцом которого является целый ряд клинических исследований, доказывающих влияние престариума А на «твердые конечные точки» (сердечно-сосудистая смертность и общая смертность), полученные в различных клинических группах (рис. 5).
Бесконечной представляется дискуссия о соотношении класс-специфичных и индивидуальных эффектов препаратов. Однако не вызывает сомнения, что каждый препарат имеет индивидуальные химические, фармакокинетические свойства, что трансформируется в процессы тканевого распределения, особенности влияния на нейрогормоны и т.д., что и приводит в конечном счете к различным клиническим эффектам. Итак, критерий выбора антигипертензивного препарата — «клинический портрет» пациента и доказательное «портфолио препарата».



