Атеросклероз и связанные с ним заболевания занимают первое место как причина заболеваемости, потери трудоспособности, инвалидности и смертности населения большинства экономически развитых стран. Морфологической основой атеросклероза является воспаление, вызванное накоплением окисленных липопротеидов и других проатерогенных веществ в интиме артерии [1]. Данные вещества индуцируют экспрессию молекул адгезии, хемокинов, цитокинов и других медиаторов воспаления макрофагами и клетками сосудистой стенки, а также обладают свойствами аутоантигенов, активирующих клетки специфического иммунитета.
Лимфоциты CD4+ — основная популяция лимфоцитов, задействованных в атерогенезе. Вклад субпопуляций клеток CD4+ в развитие и течение атеросклероза неравнозначен. В многочисленных исследованиях на моделях атеросклероза у мышей с гиперлипидемией были доказаны проатерогенные эффекты Т-хелперов (Тх) 1-го типа и Тх17 и антиатерогенные эффекты регуляторных Т-лимфоцитов (Трег) [2—5]. Показана взаимосвязь иммунного дисбаланса с преобладанием воспалительного компонента (увеличенное содержание Тх17 и интерлейкина-17 в крови) у пациентов с атеросклерозом коронарных артерий (КА) и ишемической болезнью сердца [6, 7].
Изучению прогностической значимости иммунологических маркеров в прогрессировании атеросклероза у человека посвящены единичные исследования, и их данные противоречивы. В настоящем проспективном исследовании мы изучили связь показателей клеточного иммунитета с развитием атеросклероза сонных артерий (СА).
Материал и методы
Пациенты. С октября 2014 г. по февраль 2015 г. в исследование включены 40 пациентов в возрасте от 33 до 67 лет с различной выраженностью атеросклероза СА. Выбыли из исследования 7 пациентов в связи с недоступностью для контрольного обследования, исследование завершили 33 пациента.
В исследование не включали пациентов с инфарктом миокарда, острым нарушением мозгового кровообращения, хирургическими или эндоваскулярными вмешательствами в предшествующие 6 мес, злокачественными новообразованиями, тяжелой почечной или печеночной недостаточностью, с воспалительными/инфекционными заболеваниями, сахарным диабетом в стадии декомпенсации, а также пациентов, принимающих иммунотропные препараты.
Пациенты получали терапию согласно рекомендациям по ведению больных атеросклерозом периферических артерий [8]; за период наблюдения изменений терапии не проводилось.
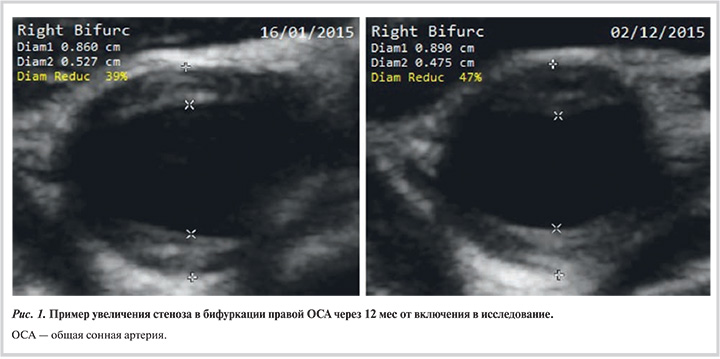
Ультразвуковое дуплексное сканирование (УЗДС) экстракраниального отдела брахиоцефальных артерий при включении в исследование и повторно (через 11—13 мес) проводили на ультразвуковой системе экспертного уровня Philips iU22 с помощью линейного датчика с частотой 9—3 МГц. Исследование выполняли в поперечном и продольном сечениях передним, латеральным и заднелатеральным доступом. Измерения проводили на всем протяжении визуализации общей сонной артерии (ОСА), внутренней сонной (ВСА) и наружной сонной артерий справа и слева. В анализ включали стенозы ОСА и ВСА. Определение толщины интимы—медии (ТИМ) и атеросклеротической бляшки (АСБ) проводили согласно данным Манхеймского консенсуса (2011) [9]. Среднюю ТИМ рассчитывали как среднее значение из максимальных значений ТИМ правой и ТИМ левой ОСА, измеренных передним и латеральным доступом. ТИМ >0,9 мм расценивали как утолщение интимы—медии. АСБ считали структуру, выступающую в просвет артерии более чем на 0,5 мм или на 50% от ТИМ соседних участков артериальной стенки, или увеличение ТИМ на 1,5 мм и более. Степень стеноза рассчитывали как отношение высоты АСБ к расстоянию между внешней границей медии противоположных стенок в зоне стеноза [10].
Критерием прогрессирования атеросклероза считали появление нового стеноза в ОСА и ВСА или увеличение степени стеноза на 5% и более.
Иммунофенотипирование лимфоцитов проводили при включении в исследование. Для выявления поверхностных антигенов использовали флуоресцентно меченные (–FITC, –PE, -PC5, –APC) моноклональные антитела к СD3, CD4, CD8, CD45, CD(16+56), CD19, CD5, CD23, CD25, CD27 (Becton Dickinson Immunocytometry Systems, eBioscience, BeckmanCoulter). Окрашивание поверхностных антигенов выполняли в цитратной крови c использованием растворов для лизиса эритроцитов и фиксации лейкоцитов (Becton Dickinson Immunocytometry Systems) и в культуре мононуклеарных лейкоцитов. Мононуклеарные клетки выделяли методом центрифугирования в градиенте плотности по методике Boyum [11]. Клетки в концентрации 5 млн/мл ресуспендировали в среде RPMI 1640, содержащей 5% пулированной и инактивированной нагреванием сыворотки человека. Для активации клеток в культуру вносили 25 нг/мл форболмиристатацетата, 1 мкг/мл иономицина и 10 мкг/мл монензина (все реактивы Sigma). Клетки инкубировали в течение 5 ч при температуре 37 °С и 5% СО2. В целях идентификации внутриклеточных белков использовали наборы для фиксации и пермеабилизации клеток (eBioscience) и флуоресцентно меченные антитела (FoxP3-Аlexa488, IL17А-РЕ, IL-4-PE, и IFNgamma-FITC, eBioscience). Окрашивание клеток антителами к цитокинам проводили после активации в культуре.
Лизис эритроцитов, окрашивание лейкоцитов, фиксацию и пермеабилизацию клеток осуществляли в соответствии с протоколами производителей. Флюоресценцию клеток измеряли методом цитофлуориметрии в потоке с помощью программного обеспечения CellQuestPro (FACS Сalibur, Becton Dickinson Immunocytometry Systems).
Лимфоциты выделяли по параметрам прямого и бокового светорассеяния и по экспрессии CD45. Определяли количество T-клеток СD3+, включая популяции СD4+ и CD8+ [12]. Активированные Т-хелперные клетки (Т-акт) типировали как СD4+CD25lowCD127high; Tрег — как Т-лимфоциты СD4+CD25highCD127low и CD4+FoxpP3+. Тх1, Тх2 и Tх17 типировали Т-лимфоциты как CD4+IFNgamma+, CD4+IL4+ и CD4+IL17+ соответственно.
Липидные показатели крови, в том числе общий холестерин (ОХС), холестерин (ХС) липопротеидов высокой плотности (ЛВП) и триглицериды (ТГ) определяли ферментативным колориметрическим методом. Уровень ХС липопротеидов низкой плотности (ЛНП) и ХС липопротеидов высокой плотности, корригированного по уровню ХС, входящего в состав липопротеида(а) — Лп(а), рассчитывали по формуле Фридвальда с использованием модификации Dahlen [13]. Концентрацию окисленных липопротеидов низкой плотности (окЛНП) определяли с использованием коммерческих наборов. Концентрацию Лп(а) определяли методом иммуноферментного анализа с использованием моноспецифических поликлональных антител к Лп(а) [14]. Все измерения проводили при включении в исследование.

Статистический анализ данных. Данные в таблицах представлены как медиана (25-й процентиль; 75-й процентиль). Для парных межгрупповых сравнений использовали критерий U Манна—Уитни. Для сопоставления групп по качественным признакам (пол, распространенность артериальной гипертензии, статус курения) использовали двусторонний критерий Фишера. Корреляционный анализ выполняли с использованием метода Спирмена. В работе применяли пакет статистических программ Statistica 7,0. ROC-анализ проводили с использованием программного обеспечения PRISM. Различия считали статистически значимыми при p<0,05.
Результаты
1. Сопоставление групп больных с прогрессированием и без прогрессирования атеросклероза СА по основным клиническим, инструментальным и лабораторным показателям. У включенных в исследование пациентов за период наблюдения не произошло тяжелых осложнений (смерть от кардиальных и других причин, случаи инфаркта миокарда, инсульта, госпитализации, необходимости реваскуляризации и других немедикаментозных вмешательств).
У 18 пациентов отмечено прогрессирование атеросклероза СА, из них у 22% — преимущественно в ОСА, у 22% — в ВСА, у 34% — в области бифуркации, у 22% — прогрессирование в нескольких локализациях (рис. 1). У 9 пациентов отмечено появление новых АСБ. У 15 пациентов не выявлено признаков прогрессирования заболевания.
Группы пациентов с различной скоростью прогрессирования атеросклероза СА были сопоставимы по основным исходным клиническим характеристикам и лабораторным показателям (табл. 1). Группы больных исходно не различались по частоте выявления АСБ в СА, степени стеноза ОСА и ВСА. Исходное значение ТИМ было больше в группе с прогрессированием атеросклероза. Группы не различались по показателям липидного состава крови, а также по частоте приема статинов и ингибиторов ангиотензинпревращающего фермента как лекарственных препаратов с доказанными иммунотропными свойствами [15—18].

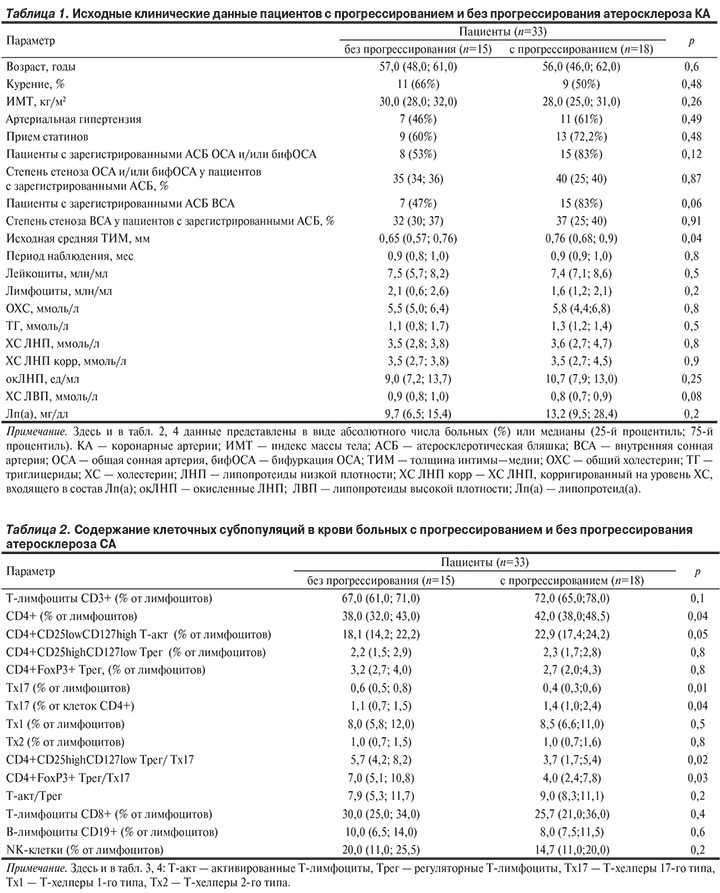
2. Анализ субпопуляционного состава лимфоцитов крови у пациентов с прогрессированием и без прогрессирования атеросклероза СА. В табл. 2 представлены исходные значения субпопуляционного состава лимфоцитов крови у пациентов с прогрессированием и без прогрессирования атеросклероза СА.
По уровню основных субпопуляций лимфоцитов крови (Т-, В- и NK-клеток) межгрупповых различий не получено. В группе больных с прогрессированием атеросклероза СА выявлено исходно более высокое содержание лимфоцитов CD4+, Тх17 (% от клеток CD4+ и в % от лимфоцитов) и низкое соотношение Трег/Тх17. По относительному содержанию Tрег (СD4+CD25highCD127low и CD4+FoxР3+), Tх1 и Tх2 группы не различались. В дальнейшем мы провели сравнение изучаемых субпопуляций клеток в группах больных, разделенных по медиане уровня ХС ЛНП. Прогрессирование атеросклероза СА было зарегистрировано у 9 из 17 пациентов с уровнем ХС ЛНП в крови менее 3,5 мМ и у 9 из 16 пациентов с повышенным уровнем ХС ЛНП (более 3,5 мМ). Выявлено, что ранее описанные взаимосвязи между субпопуляционным составом лимфоцитов и прогрессированием атеросклероза СА были характерны исключительно для больных с уровнем ХС ЛНП в крови менее 3,5 мМ (табл. 3). У этих больных с прогрессированием атеросклероза также ассоциировалось исходно повышенное содержание в крови активированных Т-лимфоцитов (Т-акт).
При сопоставлении данных пациентов с прогрессированием и без прогрессирования атеросклероза СА на фоне повышенных уровней ХС ЛНП различий не выявлено ни по одному из иммунологических показателей (данные не представлены).
Для определения чувствительности, специфичности и прогностической значимости исследованных показателей клеточного иммунитета в отношении прогрессии атеросклероза СА был проведен ROC-анализ в общей группе пациентов и в подгруппе с уровнем ХС ЛНП в крови менее 3,5 мМ. При этом выявлено, что наибольшей чувствительностью и специфичностью в отношении прогрессирования атеросклероза СА среди исследованных субпопуляций клеток обладали значения содержания Тх17, Т-акт и отношение Трег/Тх17 (рис. 2).
Указанные закономерности в большей степени имели значение для пациентов с уровнем ХС ЛНП менее 3,5 мМ. Высокие показатели площади под ROC-кривой отражали хорошее качество построенных моделей. Анализ показал, что чувствительность содержания Тх17 и отношения CD4+FoxР3+Трег/Тх17 клеток для прогнозирования прогрессирования атеросклероза СА составила 88%, а специфичность 75%. Таким образом, у 88% больных с прогрессией атеросклероза СА на фоне уровня ХС ЛНП ниже медианы содержание Тх17 превышало, а отношение Трег/Тх17 было ниже определенных в ходе анализа диагностических уровней 0,46 и 5,9, соответственно (табл. 4). Данное распределение показателей имело неблагоприятную прогностическую связь (p=0,06) с прогрессированием атеросклероза СА (см. табл. 4). Высокие чувствительность и специфичность также были отмечены для содержания Т-акт более 22,4%, что имело неблагоприятное прогностическое значение в плане прогнозирования прогрессии атеросклероза СА (относительный риск 2,8; p=0,04).
В настоящем исследовании не обнаружено взаимосвязи между увеличением средней ТИМ за период наблюдения и показателями клеточного иммунитета.
Обсуждение
Несмотря на значительные успехи в лечении пациентов с атеросклерозом, в частности, оптимизации липидснижающей терапии, не всегда удается достичь существенного замедления развития заболевания. В последние годы внимание исследователей и клиницистов направлено на изучение роли иммунных клеток в атерогенезе. В экспериментальных моделях доказана роль «провоспалительных» популяций лимфоцитов в прогрессировании атеросклероза [5]. У человека лимфоциты CD4+ являются основной популяцией лимфоцитов, представленной в АСБ СА [19], эти клетки определяются в стенке сосуда на всех этапах развития заболевания [20]. Ранее нами было показано наличие лимфоцитов CD4+, включая субпопуляции с эффекторными и регуляторными характеристиками, в АСБ КА человека [21], продемонстрировано снижение отношения Трег/Тх17 у пациентов с тяжелым и прогрессирующим атеросклерозом КА и СА ретроспективно [6, 22].
В настоящей работе была исследована прогностическая значимость ряда показателей клеточного иммунитета (содержания в крови субпопуляций Т-лимфоцитов) в отношении прогрессии каротидного атеросклероза в течение года. Выявлено, что у пациентов с зарегистрированным прогрессированием атеросклерозом СА имеются исходно более высокое содержание Tх17 в крови, а также сдвиг соотношения CD4+CD25highCD127low Трег/Tх17 и CD4+FoxР3+ Tрег/Tх17 в сторону провоспалительного компонента.
Следует отметить, что в большинстве клинических исследований, посвященных данной проблеме, проводилась оценка взаимосвязи иммунного статуса с имеющимся атеросклеротическим поражением артерий коронарного и брахиоцефального бассейнов [23—26]. В единственном пока проспективном исследовании M. Wigren и соавт. [7] показана прогностическая значимость низкого уровня Tрег в крови в отношении развития ИМ, но не острого нарушения мозгового кровообращения, в долгосрочной перспективе (15 лет). Нами также не получены доказательства взаимосвязи между уровнем Tрег в крови с развитием атеросклерозом СА (хотя средние значения данного показателя в целом были ниже в группе с прогрессированием заболевания). По-видимому, риск прогрессирования атеросклероза в СА обусловлен не собственно уровнем Трег, а соотношением регуляторных и эффекторных субпопуляций лимфоцитов.
На основании анализа чувствительности и специфичности изучаемых иммунологических показателей в отношении прогрессирования атеросклероза СА в настоящем исследовании мы выделили показатели, имеющие наибольшую прогностическую значимость, — содержание Тх17, Т-акт и отношение Трег/Тх17. При этом обнаруженные взаимосвязи проявлялись в максимальной степени у больных с прогрессированием атеросклероза на фоне уровня ХС ЛНП ниже медианы (3,5 мМ). Настоящие результаты, а также выявленные диагностические уровни могут служить основой дальнейших исследований по оценке значимости нарушений баланса иммунологических показателей в отношении прогрессирования атеросклероза у больных с достигнутыми целевыми уровнями липопротеидов в крови.
Мы не выявили взаимосвязи изучаемых иммунологических маркеров и скорости изменения ТИМ на участках СА, свободных от АСБ. Эти результаты соответствуют данным Е. Ammirati и соавт. [27], которые также не обнаружили изменений в субпопуляционном составе лимфоцитов у лиц с начальными признаками атеросклероза СА и увеличением ТИМ. Мы предполагаем, что вклад специфического иммунитета в атерогенез проявляет себя в большей степени на более поздних стадиях (стадия IV и выше по классификации Stary [28]), по мере нарушения клиренса ЛНП макрофагами интимы и появления внеклеточных скоплений модифицированных липопротеидов.
Следует отметить, что все экспериментальные исследования, посвященные роли лимфоцитов в атерогенезе, были выполнены на животных моделях с выраженной гиперлипидемией (мыши с нокаутированными генами рецептора ЛНП или АроЕ и нарушенным захватом ЛНП [3—5]), в то время как у человека это относительно редкое состояние (распространенность семейной гиперхолестеринемии составляет около 1:500 [29, 30]). Различия в обмене липопротеидов между грызунами и приматами не позволяют в полной мере исследовать особенности прогрессирования атеросклероза на фоне предсуществующей терапии статинами. Согласно Европейским рекомендациям по ведению больных с периферическим атеросклерозом [8], целевые уровни ХС ЛНП соответствуют таковым и для лиц с высоким риском развития сердечно-сосудистых заболеваний, что в свою очередь способствует раннему назначению гиполипидемической терапии таким пациентам. Таким образом, экспериментальные модели не всегда могут соответствовать реальной клинической ситуации.
Несмотря на меры, направленные на снижение уровня ХС ЛНП в крови и коррекцию факторов риска, в ряде случаев атеросклероз прогрессирует. Мы проанализировали взаимосвязь клеточных показателей и скорости прогрессирования атеросклероза при разделении пациентов на группы по медиане ХС ЛНП (3,5 мМ). Уровень ХС ЛНП 3,5 мМ является целевым для субъектов с низким риском развития сердечно-сосудистых заболеваний [8, 31]. На основании полученных результатов мы предполагаем, что у больных с уровнем ХС ЛНП в крови менее 3,5 мМ риск прогрессирования атеросклероза связан с воспалительным «фоном», в частности, повышенным содержанием в крови Tх17 и Т-акт и снижением индекса Трег/Тх17. Таким образом, поиск возможностей воздействия на иммуновоспалительное звено атерогенеза может являться перспективным направлением терапии атеросклероза, направленным на снижение скорости прогрессирования заболевания и уменьшение риска развития его осложнений.



