Общеизвестно, что заболеваемость сердечно-сосудистыми заболеваниями (ССЗ), в том числе и хронической сердечной недостаточностью (ХСН), увеличивается с возрастом [1]. ССЗ являются ведущей причиной смертности в странах Европы (в том числе в России) и США. ХСН имеется у 11 млн пациентов только в России [2].
В ближайшее время по мере старения населения ожидается, что число больных с ССЗ резко возрастет. Это, в свою очередь, подразумевает значительную социальную и экономическую нагрузку на общество. В качестве объяснения можно привести по крайней мере 5 причин [3]. Во-первых, ХСН обычно развивается в период конечной стадии сердечно-сосудистого континуума и является частой причиной госпитализации пациентов пожилого возраста. Во-вторых, постоянный рост числа лиц пожилого возраста и особенно предрасположенных к появлению ХСН в связи с биологическими факторами и наличием сопутствующих заболеваний, ассоциированных со старением. В-третьих, улучшение лечения ССЗ, особенно инфаркта миокарда (ИМ), артериальной гипертензии (АГ) и в связи с этим — увеличение числа пациентов более молодого возраста с ССЗ (в частности, моложе 65 лет), которые доживают до старости, что ведет к потенциальному росту ХСН у пожилых людей. В-четвертых, ишемическая болезнь сердца (ИБС), кроме АГ, часто встречающаяся у лиц пожилого возраста, служит распространенной причиной ХСН. В-пятых, широко распространенный у лиц старших возрастных групп ИМ с подъемом сегмента ST имеет особенно тяжелые последствия, поскольку приводит к более тяжелой дисфункции левого желудочка, ремоделированию сердца и развитию ХСН по сравнению с таковыми у пациентов более молодого возраста.
 За последнее время качество оказания терапевтических и хирургических методов лечения ХСН значительно улучшили показатели выживаемости [4—5]. При этом прогноз продолжительности и качества жизни у пациентов с данным заболеванием остается низким, что мотивирует ученых к поиску новых стратегий ранней диагностики и более качественной терапии ХСН [6].
За последнее время качество оказания терапевтических и хирургических методов лечения ХСН значительно улучшили показатели выживаемости [4—5]. При этом прогноз продолжительности и качества жизни у пациентов с данным заболеванием остается низким, что мотивирует ученых к поиску новых стратегий ранней диагностики и более качественной терапии ХСН [6].
Хотя процесс старения не приводит к ХСН, вполне вероятно, что связанные с возрастом изменения снижают порог клинического проявления этого синдрома. Существенные изменения диастолической функции сердца, АГ, атеросклероз, кальцификация клапанов сердца, возрастные амилоидные отложения в тканях сердца — это и многое другое связано со старением и повышенным риском развития ХСН [7]. У многих пациентов с ССЗ также имеются сопутствующие хронические заболевания других органов и систем, в том числе почек и легких.
Кроме возраста и наличия сопутствующих заболеваний, немаловажную роль в развитии и прогрессировании ХСН играют генетические и экологические факторы. В последнее время теломеры рассматриваются в качестве движущей силы, с помощью которой генетические и экологические факторы совместно влияют на биологический возраст и темпы старения, и, следовательно, на риск развития изменений в организме человека, связанных со старением [8]. Большинство соматических клеток in vitro могут пройти лишь определенное число делений клетки до достижения старения и гибели. Это так называемый барьер (предел, лимит) Хейфлика. Это явление открыто в 60-е годы XX века Леонардом Хейфликом [9]. Таким образом, теломеры можно считать показателем или маркером биологического возраста. Несмотря на небольшое количество исследований в данной области, потенциальная роль теломеров и теломеразы в развитии и прогрессировании ССЗ очевидна [8].
В этом обзоре мы подробно остановимся на современных знаниях о старении сердца, структуре теломеров, потенциальной роли длины теломеров в развитии сердечной недостаточности; обратим особое внимание на диастолическую хроническую сердечную недостаточность — ДХСН (вопросы этиологии, патогенеза и некоторых аспектов лечения).
Изменения «стареющего» сердца на функциональном уровне. По мере старения у человека в сердечно-сосудистой системе постепенно формируются морфологические и функциональные изменения, которые являются основой для развития заболеваний (рис. 1).
Частота развития ИМ и выраженность жесткости сосудов увеличиваются с возрастом [10]. Это приводит к увеличению конечного диастолического давления в левом желудочке (ЛЖ) в покое и при нагрузке [11]. Ранние изменения диастолического наполнения наблюдаются у пожилых людей (это явление видно на эхокардиограмме как изменение скорости заполнения ЛЖ — отношение E/A) [12]. Важные возрастные изменения особенно заметны во время физических нагрузок. Физическая нагрузка предполагает интенсивную работу сердца. У пожилых людей в результате регулярной физической нагрузки или тренировок, как правило, увеличение ударного объема происходит за счет увеличения конечного диастолического объема, обусловленного процессами дилатации. У молодых пациентов увеличение ударного объема происходит за счет увеличения фракции выброса (ФВ) ЛЖ, но не дилатации сердца [13].
Чем старше возраст пациента, тем меньше изменяется частота сердечных сокращений во время физических нагрузок, при этом происходит более выраженное увеличение артериального давления (АД) [13]. Разница в ответе ритма сердца у молодых и пожилых пациентов связана со сниженным ответом на катехоламины и дегенерацией аксонов симпатических нейронов, иннервирующих предсердия [14—15]. Кроме того, число клеток водителя ритма синусного узла значительно уменьшается с возрастом (от 50% в юности до менее чем 30% в пожилом возрасте) [16]. Одним из основных изменений сосудов в процессе старения является снижение эластичности периферических сосудов и аорты, что объясняет часто наблюдающуюся изолированную систолическую АГ у пожилых [11].
Морфологические и клеточные изменения «стареющего» сердца. Миокард состоит из кардиомиоцитов и соединительной ткани [17]. Здоровая ткань сердца состоит на 20—25% из кардиомиоцитов [17]. Во время старения большинство компонентов миокарда подвергается структурным изменениям. Изменение морфологии характеризуется потерей числа миоцитов с последующей гипертрофией оставшихся жизнеспособных миоцитов [18]. Остальные миоциты часто содержат несколько ядер (полиплоидия). Механизмом, который, вероятно, ответственен за потерю миоцитов, является апоптоз (или запрограммированная смерть клеток). Одновременно происходит увеличение содержания коллагена, фиброз и отложение амилоида и липофусцина, изменения в обмене кальция [19—20]. Возрастные изменения затрагивают и митохондрии. У этих органелл возникает тенденция становиться больше в размере. При этом они менее эффективны, так как уменьшается выработка АТФ в клетке [21].
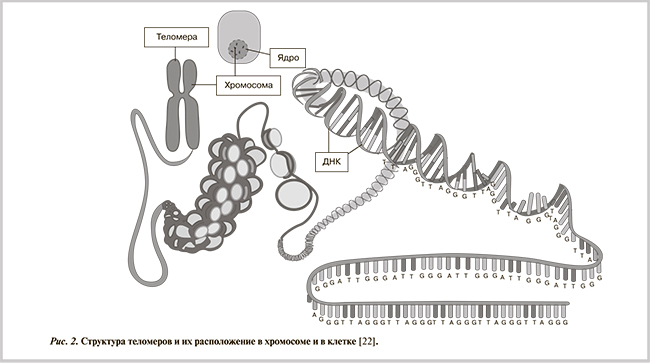
Возрастные изменения сердца на генетическом уровне. Во многих современных учебных пособиях и монографиях теломерами называют специализированные концевые районы линейной хромосомной дезоксирибонуклеиновой кислоты (ДНК), состоящей из многократно повторяющихся коротких нуклеотидных последовательностей. Однако это определение неполное. В состав теломеров входят также многие белки, специфически связывающиеся с теломерными ДНК-повторами. Таким образом, теломеры (как и другие хромосомы эукариот) построены из дезоксинуклеопротеидов, т.е. комплексов ДНК с белками (рис. 2). Теломерные повторы — весьма консервативные последовательности. К примеру, повторы всех позвоночных состоят из 6 нуклеотидов (TTAGGG)n, повторы всех насекомых — из 5 (TTAGG)n, повторы большинства растений — из 7 (TTTAGGG)n. Длина теломерных ДНК у человека колеблется от 2 до 20 тыс. пар нуклеотидных остатков (т.н.п.), а у некоторых видов мышей может достигать сотен т.н.п. [23].
Основными функциями теломеров являются следующие [24].
1. Механические: теломеры участвуют в фиксации хромосом к ядерному матриксу.
2. Стабилизационные:
а) если в клетке нет теломеразы (или ALT), то наличие теломеров предохраняет от недорепликации генетически значимые отделы ДНК;
б) если же в клетке есть теломеразная активность, то появляется еще одна возможность — стабилизация концов разорванных хромосом. В присутствии же теломеразы к местам разрыва присоединяется теломерная ДНК. Это стабилизирует хромосомные фрагменты и позволяет им функционировать.
3. Влияние на экспрессию генов: активность генов, расположенных рядом с теломерами, снижена (репрессирована). При значительном же укорочении теломеров эффект положения пропадает, и прителомерные гены активируются.
4. «Счетная» функция: теломерные отделы ДНК выступают в качестве часового устройства (так называемого репликометра), которое отсчитывает число делений клетки после исчезновения теломеразной активности. После этого нарушается клеточный цикл и, в конечном счете, клетка погибает.
 Группой ученых во главе с Pim van der Harst проведено исследование, в котором изучали длину теломеров у больных с ХСН [25]. В исследование были включены 803 участника (183 в группе контроля и 620 с ХСН в возрасте от 40 до 80 лет, имеющие II—IV функциональный класс (ФК) по NYHA и ФВ ЛЖ 40% и меньше).
Группой ученых во главе с Pim van der Harst проведено исследование, в котором изучали длину теломеров у больных с ХСН [25]. В исследование были включены 803 участника (183 в группе контроля и 620 с ХСН в возрасте от 40 до 80 лет, имеющие II—IV функциональный класс (ФК) по NYHA и ФВ ЛЖ 40% и меньше).
Установлено, что длина теломеров в группе пациентов с ХСН меньше, чем в группе контроля (0,64 T/S и 1,05 T/S соответственно). Длина теломеров у пациентов с ХСН II ФК по классификации NYHA составляла в среднем 0,67 T/S, с ХСН III ФК — 0,63 T/S, с ХСН IV ФК — 0,55 T/S. Следует отметить, что длина теломеров у лиц с ишемической этиологией ХСН была меньше, чем у лиц с ХСН неишемической природы (рис. 3).
J. Collerton и соавт. изучали связь между длиной теломеров и величиной ФВ ЛЖ [26]. В исследовании у 89 пациентов старше 85 лет определяли длину теломеров (в режиме реального времени методом полимеразной цепной реакции) с последующим определением величины ФВ ЛЖ в М-режиме. Средний возраст участников составил 85,2 года (от 84,9 до 85,7 года).
Установлено, что меньшая длина теломеров коррелирует с меньшей ФВ ЛЖ (одно стандартное отклонение длины теломеров связано с 5% увеличением ФВ ЛЖ). Определена значимая связь между ФВ ЛЖ в М-режиме и полом: ФВ ЛЖ на 9,9% при 95% доверительном интервале от 3,0 до 16,8% выше у женщин, чем у мужчин (p=0,004). Взаимосвязь длины теломеров и ФВ ЛЖ в М-режиме с поправкой на пол отображена на рис. 4.
О связи длины теломеров и ХСН свидетельствуют результаты исследования, проводимого группой ученых во главе с H. Oh [27]. Авторы анализировали длину теломеров у пациентов с ХСН, которые страдали идиопатической или ишемической дилатационной кардиомиопатией. В группу сравнения были включены пациенты с гипертрофической обструктивной кардиомиопатией (ГОКМП) с нормальными показателями насосной функции желудочков сердца. Материал для последующего определения длины теломеров брали из эксплантированных сердец во время трансплантации. В группу контроля были включены пациенты без признаков ХСН (материал брали у пациентов-доноров при трансплантации сердца или жертв дорожно-транспортных происшествий). Установлено, что у пациентов с ХСН средняя длина теломеров на 25% меньше, чем у пациентов с ГОКМП и пациентов без признаков ХСН (6,5±0,2, 7,7±0,1 и 7,8±0,2 kb соответственно; р=0,0001) (рис. 5).
Подобное исследование проведено группой ученых во главе с C. Chimenti [28]. В исследование были включены 19 пожилых пациентов (73±2 года) с ХСН, основной причиной которой была дилатационная кардиомиопатия (1-я группа). В группе контроля было 7 пациентов (средний возраст 76±4 года) с нормальной ФВ ЛЖ. У пациентов обеих групп оценивали длину теломеров миокарда. Удалось установить, что длина теломеров в 1-й группе была на 40% короче, чем в контрольной.
 K. Urbanek проведено исследование, одной из задач которого был анализ длины теломеров у пациентов с ХСН ишемической этиологии [29]. С этой целью в исследование были включены 3 группы пациентов: 1-я — 20 пациентов с острым ИМ, 2-я — 20 пациентов с постинфарктной кардиомиопатией и 3-я группа — группа контроля (n=12). Установлено, что длина теломеров у пациентов с ХСН ишемической природы меньше, чем у пациентов с острым ИМ и пациентов группы контроля. Активность теломеразы у пациентов 2-й группы была выше, чем в 3-й группе, но меньше, чем в 1-й.
K. Urbanek проведено исследование, одной из задач которого был анализ длины теломеров у пациентов с ХСН ишемической этиологии [29]. С этой целью в исследование были включены 3 группы пациентов: 1-я — 20 пациентов с острым ИМ, 2-я — 20 пациентов с постинфарктной кардиомиопатией и 3-я группа — группа контроля (n=12). Установлено, что длина теломеров у пациентов с ХСН ишемической природы меньше, чем у пациентов с острым ИМ и пациентов группы контроля. Активность теломеразы у пациентов 2-й группы была выше, чем в 3-й группе, но меньше, чем в 1-й.
Диастолическая сердечная недостаточность. Клиницистам известно, что у лиц, длительно страдающих АГ, гораздо чаще, чем у лиц с нормальным АД, развиваются ИМ, мозговой инсульт, изменения сосудов глазного дна и хроническая почечная недостаточность. Эта закономерность хорошо демонстрируется предложенной в 1991 г. V. Dzau и Е. Вraunwald схемой сердечно-сосудистого континуума, представляющего цепь связанных между собой событий, начиная от факторов риска (включающих АГ), и заканчивающихся ХСН (рис. 6). Эта цепь может быть прервана на любом этапе развитием ИМ, мозгового инсульта, внезапной смертью (коронарной или аритмической).
ХСН и ее тяжесть ассоциируют со снижением систолической функции ЛЖ, которую обычно оценивают по ФВ ЛЖ. Однако у отдельных больных признаки недостаточности кровообращения отмечают при нормальной или незначительно измененной ФВ ЛЖ. Число таких пациентов колеблется от 35 до 50% [31]. В этих случаях используется термин «ХСН с сохраненной систолической функцией ЛЖ». В то же время не стоит отождествлять понятия «ХСН с сохраненной систолической функцией ЛЖ» и «диастолическая сердечная недостаточность». Первое — более широкое понятие, включающее любые проявления сердечной недостаточности с ФВ ЛЖ более 45%, второе — только случаи сердечной недостаточности с подтвержденным нарушением диастолической функции ЛЖ. Предположить ДХСН врач должен в тех случаях, когда ФВ ЛЖ больше 45% и имеются признаки ХСН с ее типичными проявлениями: ортопноэ, одышка, отеки и т.п. Клинических отличий ДХСН от систолической нет. Имеются характерные эхокардиографические признаки ДХСН: конечный диастолический размер (КДР) ЛЖ не увеличен, стенки, как правило, утолщены, ФВ ЛЖ в норме.
Согласно рекомендациям Рабочей группы Европейского общества кардиологов [31] диагноз первичной (изолированной) ДХСН правомочен при обязательном наличии всех следующих критериев:
- клинических признаков собственно ХСН;
- нормальной или незначительно сниженной сократительной способности миокарда (ФВ ЛЖ >45% и индекса КДР ЛЖ <3,2 см/м2).
- данных о нарушенном расслаблении или заполнении ЛЖ, признаков повышенной жесткости камеры ЛЖ.
Следует учитывать различие терминов «диастолическая дисфункция» и «диастолическая сердечная недостаточность»: ДХСН всегда включает диастолическую дисфункцию, но наличие диастолической дисфункции еще не свидетельствует о наличии сердечной недостаточности.
Схематично патофизиология процесса представлена на рис. 7 [32]. На 1-й ступени под влиянием различных повреждающих факторов (перегрузки, ишемия, ИМ, гипертрофия ЛЖ и т.д.) нарушается процесс активного расслабления миокарда и раннего наполнения ЛЖ, что на этом этапе полностью компенсировано активностью левого предсердия и поэтому не проявляется даже при нагрузках. Прогрессирование заболевания и повышение жесткости камеры ЛЖ сопровождается вынужденным ростом давления заполнения ЛЖ (предсердие уже не справляется!), особенно заметным при нагрузках. Отмечаются еще большее затруднение притока крови к ЛЖ и патологический рост давления в легочной артерии, что снижает толерантность к нагрузкам (2-я ступень). Дальнейший рост давления заполнения ЛЖ (3-я ступень) полностью «выводит из строя» предсердие; приток крови к желудочку (отток крови из легких) снижен критически, что сопровождается падением сердечного выброса, резким снижением толерантности к физическим нагрузкам и застоем в легких (развернутая картина ХСН). Таким образом, механизм процесса представляет собой классический вариант развития застоя, вызванного ухудшением оттока крови из легких (backward failure), обусловленным ухудшением активного расслабления миокарда и повышением жесткости камеры ЛЖ.
Обсуждая вопрос о сердечной недостаточности, невозможно не упомянуть закон Франка—Старлинга, который объясняет увеличение силы сердечных сокращений при увеличении длины кардиомиоцитов. Характерно, что при нарушении диастолы компенсаторная роль данного механизма в ответ на быстрый рост пред- и посленагрузки затруднена в связи со снижением эластичности миокарда. Конечным результатом этого будет создание основы для нередко стремительного роста легочного венозного давления, что объясняет характерную для пациентов с диастолической ХСН опасность в виде острого развития отека легких после приема соленой пищи, быстрого подъема АД или начала фибрилляции предсердий [33].

Ввиду ограниченности данных по вопросу лечения больных с ДХСН, связанной с отсутствием достаточного количества рандомизированных проспективных исследований по этому вопросу, единых рекомендаций и тактики ведения больных данной группы нет [34]. В настоящее время отсутствуют убедительные доказательства улучшения выживаемости при использовании какого-либо специфического медикаментозного лечения у пациентов с ДХСН. Тем не менее эффективность применения некоторых препаратов показана в отдельных исследованиях и продолжает изучаться.
Первым и обязательным условием лечения больных с ДХСН является выявление и коррекция всех факторов и заболеваний, способствующих развитию диастолических расстройств, появлению и прогрессированию заболевания. К ним чаще всего относятся АГ и гипертрофия ЛЖ, ИБС, констриктивные поражения миокарда/перикарда, сахарный диабет, ожирение и т.д. Поэтому контроль АД, успешное лечение ИБС, коррекция уровня глюкозы, нормализация массы тела, умеренные физические нагрузки могут быть важным подспорьем в успешном ведении больных этой сложной для лечения группы.
Некоторые аспекты лечения больных с диастолической сердечной недостаточностью. Известно, что блокаторы ренин-ангиотензин-альдостероновой системы (ингибиторы ангиотензинпревращающего фермента — АПФ, антагонисты рецепторов ангиотензина II) и β-адреноблокаторы относятся к основным средствам лечения большинства заболеваний, приводящих к ХСН с сохраненной систолической функцией ЛЖ, поэтому их наличие в числе препаратов, рекомендованных больным с ДСН, не вызывает сомнений.
Ингибиторы АПФ способны напрямую улучшать релаксацию, растяжимость миокарда, а также оказывать опосредованное действие на диастолические свойства ЛЖ за счет своего гипотензивного эффекта и способности уменьшать выраженность гипертрофии и фиброза миокарда. В ранних исследованиях показано, что терапия ингибиторами АПФ у пациентов с ХСН с сохраненной систолической функцией ЛЖ достоверно продлевает время до вынужденной госпитализации из-за развития декомпенсации, хотя и не снижает смертность. Достоверное улучшение «суррогатных конечных точек» (функционального статуса, толерантности к нагрузке, качества жизни) у больных с ХСН и относительно сохраненной сократимостью (ФВ >45%) показано в проспективном российском исследовании ФАСОН. Единственное завершившееся к настоящему времени плацебо-контролируемое исследование по оценке влияния ингибиторов АПФ на выживаемость пожилых больных с ДХСН (>70 лет) — (PEP-CHF), выполненное с периндоприлом, не показало достоверного снижения общей или сердечно-сосудистой смертности на фоне лечения ингибиторами АПФ. Тем не менее через 1 год после начала исследования терапия ингибиторами АПФ ассоциировалась с достоверным снижением риска внеплановой госпитализации из-за декомпенсации (относительный риск 0,63 при 95% доверительном интервале от 0,40 до 0,97; p=0,033). Клинически у пациентов, находившихся на лечении периндоприлом, отмечался достоверно меньший ФК ХСН и достоверно бо'льшим было увеличение расстояния в тесте с 6-минутной ходьбой. Более того, ретроспективный анализ показал, что в подгруппе моложе 75 лет эффект периндоприла был более отчетливым и сопровождался снижением риска смерти и количества госпитализаций из-за обострения ХСН. Мета-анализ всех исследований по применению ингибиторов АПФ при лечении больных с ХСН и сохраненной систолической функцией ЛЖ продемонстрировал снижение риска смерти без достоверного влияния на риск госпитализаций, в том числе связанных и с обострением ХСН. Таким образом, пока не доказана способность ингибиторов АПФ улучшать прогноз у пациентов с ХСН и сохраненной систолической функцией ЛЖ и ДХСН, однако применение препаратов этой группы у таких больных абсолютно оправдано, по крайней мере, в связи с улучшением функционального статуса пациентов и уменьшением риска вынужденных госпитализаций.
Блокаторы медленных кальциевых каналов благоприятно воздействуют на диастолическую дисфункцию ЛЖ, контролируя уровень АД, снижая потребность миокарда в кислороде, вызывая дилатацию коронарных артерий и обратное развитие гипертрофии ЛЖ. Современный антагонист кальция амлодипин оказывает мощное сосудорасширяющее действие и относится к наиболее часто применяемым в клинической практике антагонистам кальция. Наряду с антигипертензивными эффектами амлодипин способен оказывать вазопротективное и антиатеросклеротическое действие (подтверждено в исследованиях PREVENT и CAMELOT). С точки зрения снижения риска развития сердечно-сосудистых осложнений и улучшения прогноза при АГ амлодипин продемонстрировал выраженный протективный эффект в таких исследованиях, как ALLHAT, VALUE, ASCOT, ACCOMPLISH.
В клинической практике врачи довольно часто используют с гипотензивной целью комбинацию ингибиторов АПФ с дигидропиридиновыми антагонистами кальция. Данная комбинация препаратов дает значительно меньше побочных действий, чем каждый компонент в отдельности.

В России зарегистрирована фиксированная комбинация антагониста кальция амлодипина и ингибитора АПФ лизиноприла под названием «экватор» (Gedeon Richter, Венгрия), который производится в 3-х дозировках: амлодипина 5 мг + лизиноприл 10 мг, амлодипин 5 мг + лизиноприл 20 мг, амлодипин 10 мг + лизиноприл 20 мг .
У препарата экватор существует убедительная доказательная база.
В исследовании HAMLET доказана высокая гипотензивная эффективность этой лекарственной комбинации у лиц с «мягкой» и «умеренной» формами АГ при сопутствующей гипертрофии миокарда ЛЖ.
Результаты исследования ALFESS также подтвердили эффективность и безопасность препарата. Через 12 нед терапия оказалась эффективной у 92% пациентов, у большинства достоверно улучшилось качество жизни, 94% оценили переносимость препарата как отличную (побочные эффекты зарегистрированы у 8% больных) [35].
В России оценку препарата экватор проводили в ходе многоцентрового исследования ЭКВАТОР. Авторами отмечены высокие эффективность, безопасность и хорошая переносимость лечения [36].
В исследовании ДИРИЖЕР (ДИРотон в лечении артерИальной гипертензии у пациентов с метаболическим синдромом и неалкогольной Жировой болЕзнью печени) [37] участвовали 72 пациента [средний возраст пациентов составлял 50,6±12,6 года, среди пациентов 45% женщин (n=32) и 55% мужчин (n=40)]. Это были пациенты с метаболическим синдромом, АГ и сопутствующей неалкогольной жировой болезнью печени.
Участники исследования были рандомизированы в 2 группы. 1-ю группу составили 38 пациентов с применением препаратов на основе лизиноприла, а 2-ю группу – 34 пациента с применением периндоприла. Пациенты из 1-й группы имели более выраженное ожирение и более высокий уровень систолического и диастолического АД, а также несколько бо'льшую массу миокарда ЛЖ. На первом визите исходно в зависимости от степени АГ (от уровня повышения АД) пациенты из 1-й группы получали 10 мг лизиноприла, пациенты из 2-й группы получали 10 мг периндоприла.
Если в течение 10 суток не удавалось достигнуть целевых значений АД (<140/90 мм рт.ст.), то на втором визите пациентам проводилась коррекция антигипертензивной терапии. В 1-й группе при недостижении целевых цифр АД назначалась терапия фиксированной комбинацией амлодипина с лизиноприлом (n=12) (препарат экватор в дозе 5 мг + 10 мг) при 3-й степени АГ, фиксированной комбинацией лизиноприла с гидрохлортиазидом (n=16) при 2-й степени АГ или лизиноприлом в дозе 20 мг при 1-й степени АГ.
Во 2-й группе через 10 дней при недостижении целевых уровней АД назначалась фиксированная комбинация периндоприла с амлодипином (n=18) при 2–3-й степени АГ, либо периндоприла с индапамидом (n=16) при 1–2-й степени АГ. Монотерапия периндоприлом со второго визита не проводилась.
Пациенты по показаниям получали сопутствующую терапию статинами. Период наблюдения составлял 12 нед.

Исходные параметры ЭхоКГ позволили выявить наличие у пациентов сохраненной фракции выброса ЛЖ 62±4%. Масса миокарда ЛЖ составила 219±58 г, индекс массы миокарда ЛЖ – 106,9±19,3 г/м2, толщина межжелудочковой перегородки 1,15±0,16 см, задняя стенка ЛЖ – 1,1±0,12 см, что указывало на гипертрофию миокарда ЛЖ, незначительная и умеренная дилатация левого предсердия, объем левого предсердия (ЛП) составил 59±15 мл. Средние показатели диастолической функции ЛЖ у пациентов до лечения указывали на наличие диастолической дисфункции по 1-му типу – нарушение релаксации ЛЖ. Регистрировалось уменьшение пика Е и увеличение пика А по трансмитральному потоку, уменьшение е’ и увеличение а’ по результатам тканевой допплерографии фиброзных колец митрального клапана. Умеренно выраженная диастолическая дисфункция также подтверждалась соотношением Е/А = 0,69±0,08 и соотношением E/е’ = 7,9±0,9 (показатель E/е’ >7,0 выявлялся у всех пациентов с МС).
Удалось установить, что группа антигипертензивной терапии на основе лизиноприла имела более мощное антигипертензивное действие по сравнению с препаратами на основе периндоприла. В группе лизиноприла были достигнуты целевые уровни АД во всех подгруппах, причем на фоне фиксированной комбинации амлодипина с лизиноприлом (препарат экватор) отмечалась максимальная степень снижения систолического и диастолического АД. На фоне терапии через 12 нед отмечался больший регресс гипертрофии миокарда ЛЖ в группе лизиноприла (с 225 до 214 г) в сравнении с группой периндоприла (с 211 до 201 г, р<0,01). Уменьшился объем ЛП c 61 до 55 мл в группе лизиноприла, и с 56 до 51 мл в группе периндоприла (р<0,01). На фоне антигипертензивной терапии отмечалось улучшение диастолической функции ЛЖ. Увеличилось соотношение Е/А в обеих группах, а также уменьшилось соотношение E/е’, причем более значимо в группе терапии препаратом экватор. Регресс гипертрофии миокарда ЛЖ, уменьшение размеров ЛП, улучшение диастолы предполагает профилактику ремоделирования сердца.
Таким образом, результаты исследования ДИРИЖЕР демонстрируют преимущества комбинации амлодипина и лизиноприла в лечении АГ и ХСН (в частности, ДХСН).
Заключение
Актуальность проблемы хронической сердечной недостаточности подчеркивается ее несомненной печальной прогностической значимостью. Под влиянием факторов риска с возрастом в сердце происходит ряд изменений на функциональном, морфологическом, клеточном и генетическом уровнях, результатом которых является развитие хронической сердечной недостаточности. В свою очередь в последнее время особое внимание уделяется изучению диастолической сердечной недостаточности ввиду высокой распространенности и некоторых трудностях в диагностике. Очевидно, что диагностику и лечение диастолической сердечной недостаточности следует начинать как можно раньше, до появления необратимых структурных изменений миокарда и развития систолической дисфункции сердца. С этой целью в последнее время особое внимание уделяется генетическим методам диагностики хронической сердечной недостаточности, и, в частности, диастолической сердечной недостаточности. В лечении диастолической сердечной недостаточности также остается много открытых вопросов. Однако предельно ясно, что влияя на такой фактор риска развития хронической сердечной недостаточности как артериальная гипертония, можно предотвратить развитие всей череды событий «сердечно-сосудистого континуума».
Все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.



