Сердечно-сосудистые заболевания (ССЗ), как правило, считаются зависящими от возраста. С течением времени происходит старение сердечно-сосудистой системы, что приводит к изменению структуры и функции сердца, сосудов, создавая тем самым субстрат для развития болезней.
Однако хронологический возраст не всегда отражает истинное биологическое старение и связанный с ним риск. В связи с этим в настоящее время ведутся изучение физиологических возрастных изменений сердечно-сосудистой системы у практически здоровых людей и разработка количественных показателей, позволяющих оценивать степень таких изменений и проводить стратификацию риска развития ССЗ [1].
С увеличением возраста даже в отсутствие ССЗ миокард левого желудочка (ЛЖ) подвергается ремоделированию, изменяется его сократительная деятельность. При этом систолическая функция ЛЖ в покое не нарушается, а изменения возникают в основном в диастолическую фазу сердечного цикла [2]. Исследования показали, что чувствительным маркером изолированной диастолической дисфункции (ДД) является повышение уровня N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) [3]. Кроме того, отмечено его повышение с увеличением возраста у лиц без ССЗ независимо от нарушений диастолической функции ЛЖ [4]. Это стало предпосылкой к изучению уровня NT-proBNP для уточнения его роли в возрастных изменениях сердца.
Типичное возрастное ремоделирование миокарда ЛЖ зависит от воздействия различных факторов риска развития ССЗ. Оценка лишь структуры и функции сердца не позволяет судить о независимом влиянии возраста на миокард. Это создает предпосылки для поиска маркеров, которые отражали бы истинное старение миокарда ЛЖ в условиях совокупного воздействия различных факторов.
Мы предположили, что возможным механизмом развития ДД миокарда ЛЖ с увеличением возраста является старение кардиомиоцитов. Старение клетки сопровождается снижением ее функционального потенциала, а также ведет к ее гибели, замещению соединительной тканью и компенсаторной гипертрофии других кардиомиоцитов [5]. Одним из маркеров старения клетки служит длина теломер лейкоцитов периферической крови. Теломеры — повторяющиеся нуклеотидные последовательности ДНК (TTAGGG), расположенные на концах каждой хромосомы. Теломерная ДНК способна поддерживаться ферментом теломеразой. Так как активность теломеразы в соматических клетках низкая, длина теломер прогрессивно сокращается при каждом делении клетки, и, достигнув критически короткой длины, ведет к остановке клеточного цикла, старению и гибели клетки [6].
Длина теломер как маркер репликативного старения должна быть связана, как минимум, со старением пролиферирующих тканей. До недавнего времени считалось, что кардиомиоциты являются репликативно неактивными клетками во взрослом периоде. Однако установлено, что наряду с неделящимися клетками есть популяция репликативно активных кардиомиоцитов. Так, в миокарде отмечено уменьшение длины теломер с увеличением возраста [7].
В данной работе оценивалась длина теломер в клетках периферической крови. Известно, что ткани с разной пролиферативной активностью имеют сходную скорость укорочения теломер, несмотря на отличие по их длине. Одним из объяснений такой эквивалентности является связь длины теломер в соматических тканях с репликацией стволовых клеток, скорость деления которых одинакова для всех тканей независимо от их пролиферативного статуса. Поэтому измерение длины теломер в легкодоступных тканях, таких как кровь, может служить в качестве суррогатного параметра для определения относительной длины теломер в других тканях [8].
Цель исследования: оценить диастолическую функцию ЛЖ и уровень NT-proBNP у лиц разного возраста без клинических проявлений ССЗ и их связь с длиной теломер.
Материал и методы
Отбор участников. На этапе скрининга были обследованы 188 человек разного возраста. Предварительный скрининг включал сбор анамнеза, оценку артериального давления (АД), частоты сердечных сокращений (ЧСС), индекса массы тела (ИМТ, кг/м2). Лица, имеющие симптомы или анамнез ССЗ (в том числе артериальную гипертонию, инсульт, ишемическую болезнь сердца, заболевания периферических артерий, сердечную недостаточность (СН), пороки сердца) и тяжелых соматических заболеваний, а также с ИМТ ≥30 кг/м2, были исключены из исследования. У включенных в исследование участников брали образцы крови для лабораторных анализов (клинический и биохимический), регистрировали электрокардиограмму (ЭКГ) и выполняли пробу с физической нагрузкой (тредмил-тест по протоколу BRUCE, Intertrack, SCHILLER). Лица с отклонениями в анализах крови, нарушениями ритма и проводимости сердца по данным ЭКГ и положительной пробой с физической нагрузкой были также исключены из исследования.
В исследование были включены 150 человек в возрасте 28—75 лет. Всем выполнены эхокардиография (ЭхоКГ), определение уровня NT-proBNP в плазме и измерение длины теломер в лейкоцитах. Протокол исследования был одобрен локальным Этическим комитетом, все участники дали письменное информированное согласие на участие в исследовании.
Трансторакальную 2D-ЭхоКГ проводили с помощью системы Philips IE-33 по стандартному протоколу. Все измерения были получены в результате их оценки по 3 сердечным циклам. Фракция выброса ЛЖ была рассчитана по методу Симпсона. Для оценки диастолической функции ЛЖ проводили допплеровское исследование трансмитрального потока, полученного из апикальной 4-камерной позиции. Измеряли скорости раннего (пик Е) и позднего (пик А) наполнения ЛЖ, их соотношение (Е/А), время замедления раннего диастолического кровотока (DT), время изоволюмического расслабления (IVRT). Диастолическую функцию также оценивали c помощью тканевой миокардиальной допплеро-графии из апикальной позиции доступа с установлением контрольного объема в области боковой стенки фиброзного кольца митрального клапана. Были измерены максимальные скорости раннего диастолического пика Em, позднего пика Am, отношения Em/Am, E/Em [9].
Кроме того, был произведен анализ легочного венозного спектра (правой верхней легочной вены) в апикальной 4-камерной позиции методом импульсноволновой допплерографии. Оценивали такие параметры, как отношение систолического антеградного потока (S) в легочных венах к диастолическому (D), скорость и продолжительность ретро-градного потока в легочных венах (Ar и tApv) [10].
Определение уровня NT-proBNP. Мозговой натрийуретический пептид продуцируется в виде предшественника — proBNP. Под действием специфической протеазы происходит расщепление proBNP на два фрагмента — С-концевой фрагмент BNP и NT-proBNP. В плазме они циркулируют в равных концентрациях. Но NT-proBNP имеет более длительный период полураспада и его определение в крови считается более информативным. NT-proBNP определяли в плазме крови с EDTA с помощью метода иммунохемилюминесценции (Abbot Architect 2000i).
Измерение длины теломер лейкоцитов. Традиционный метод измерения длины теломер основан на определении средней длины рестрикционных фрагментов путем блот-гибридизации по Саузерну. Этот способ заключается в разрезании геномной ДНК с помощью эндонуклеаз, рестрикции и дальнейшем анализе размеров образующихся фрагментов. Метод трудоемкий и требует большого количества ДНК.
В последнее время получил широкое распространение метод определения относительной длины теломер с помощью количественной полимеразной цепной реакции (ПЦР), который использовался в данном исследовании. Относительная длина теломер лейкоцитов, полученная данным способом, коррелирует с длиной рестрикционных фрагментов. Геномная ДНК была выделена из 300 мкл периферической крови стандартным методом. В ходе анализа методом ПЦР в реальном времени оценивали количество ДНК с теломерной последовательностью в геноме (T). Одновременно проводили ПЦР в реальном времени к однокопийному участку геномной ДНК (S). Отношение количеств теломерной и однокопийной матриц (T/S) пропорционально средней длине теломер. Для получения относительной длины теломер все экспериментальные образцы ДНК сравнивали с одним и тем же контрольным образцом ДНК. Такой анализ является простым, быстрым и обладает большой пропускной способностью [11].
Статистическую обработку данных выполняли с помощью статистической системы SAS 9.1. Проводили сравнительный анализ независимых выборок. Для частотных показателей применяли модифицированный критерий t Стьюдента с учетом arcsin-преобразования Фишера, а для показателей, измеренных по интервальной или относительной шкале, использовали дисперсионный анализ ANOVA. Результаты представлены в процентах для качественных переменных или в виде среднего и его ошибки или стандартного отклонения для количественных данных. Для оценки связи длины теломер с показателями диастолической функции ЛЖ, NT-proBNP проводили корреляционный анализ (линейные корреляции Пирсона, ранговые корреляции Спирмена), линейный регрессионный анализ. После поправки на пол, ИМТ, уровень систолического/диастолического АД был проведен двумерный ANOVA, чтобы выяснить, являются ли воздействия двух факторов (длина теломер и возраст) на показатели ДД (отношение E/A) независимыми друг от друга. Различия считали статистически значимыми при p<0,05.
Результаты
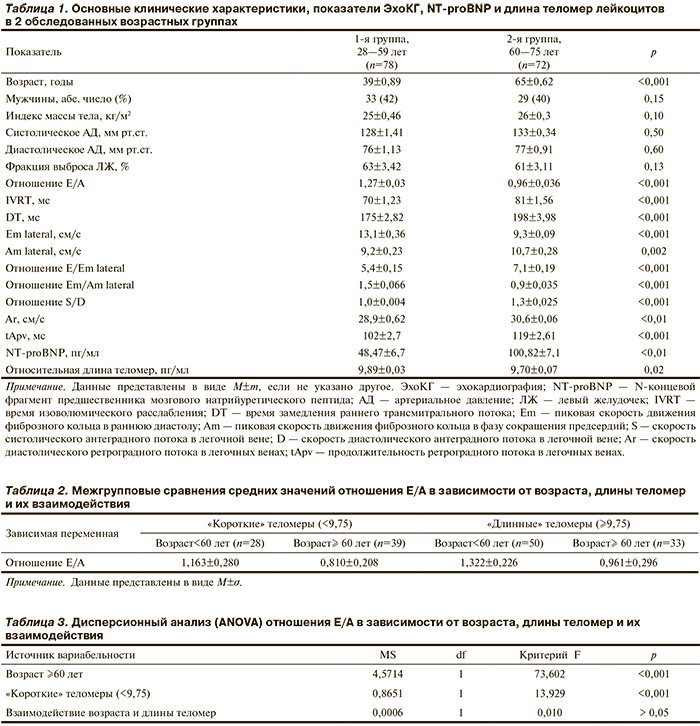
Все участники были разделены на 2 группы по возрасту: 1-я группа (n=78; 28—59 лет) и 2-я группа (n=72; 60—75 лет). Средний возраст составлял 39±0,89 и 65±0,62 года соответственно (p<0,001). Группы были сопоставимы между собой по полу, ИМТ, уровню АД. Основные клинические характеристики, показатели ЭхоКГ, NT-proBNP и длины теломер лейкоцитов представлены в табл. 1.
При анализе диастолической функции ЛЖ следует отметить, что возраст >60 лет был ассоциирован с более низкими значениями E/A (p<0,001), Em/Am (p<0,001) и более высокими значениями IVRT (p<0,001), DT (p<0,001), параметров легочного спектра — S/D (p<0,001), скорости ретроградного потока Ar (p<0,01) и его продолжительности (p<0,001). NT-proBNP оказался в пределах референсных значений в обеих группах, тем не менее достоверно более высокий его уровень был в группе лиц пожилого возраста (p<0,01). Длина теломер — величина не абсолютная, а относительная. В общем ряду индивидуальных значений этих относительных величин была вычислена медиана, которая составила 9,75. Группы (короткие и длинные теломеры) формировались с учетом этого медианного значения. Теломеры считались короткими, если их длина была меньше этого значения, и длинными, если ≥9,75. Относительная длина теломер была меньше у лиц старше 60 лет. Возраст отрицательно и статистически значимо коррелировал с длиной теломер (r=–0,36; p<0,001).

Была также выявлена положительная корреляция длины теломер с параметрами диастолической функции ЛЖ — E/A (r=0,3; p<0,01) и Em/Am (r=0,36; p<0,05). Изменение этих показателей с увеличением длины теломер отражено в линейной регрессионной модели (см. рисунок).
В результате дисперсионного анализа (ANOVA) возраст >60 лет оказался достоверно связан с показателем E/A (F=73,6; p<0,001). При этом длина теломер лейкоцитов достоверно и независимо от возраста ассоциирована с E/A (табл. 3). Лица пожилого возраста с короткими теломерами имели более низкие значения E/A, чем лица той же возрастной группы с более длинными теломерами (табл. 2). Однако не получено достоверной связи уровня NT-proBNP с длиной теломер (r=–0,023; p>0,05).
Обсуждение
Результаты данного исследования с участием 150 человек показали, что в группе лиц старше 60 лет по сравнению с младшей группой наблюдаются изменения диастолической функции ЛЖ даже в отсутствие ССЗ. По данным эпидемиологических исследований, изолированная ДД ЛЖ наблюдается у 50% пожилых лиц без ССЗ [12]. Одной из причин развития ДД ЛЖ с увеличением возраста являются увеличение массы миокарда и ухудшение его эластических свойств — податливости стенок. Кроме того, прогрессирующее снижение диастолической функции ЛЖ по мере увеличения возраста характеризуется нарушением активного расслабления ЛЖ. Последнее сопровождается замедлением скорости падения давления в ЛЖ и снижением раннего пассивного наполнения ЛЖ (пика Е), что ведет к необходимости усиления предсердного сокращения (пика А) для поддержания адекватного объема ЛЖ и сердечного выброса [13].
В данной работе у лиц старше 60 лет выявлены достоверно меньшие отношения E/A, а также увеличение IVRT и DT, что присуще I типу ДД, так называемой замедленной релаксации ЛЖ. С увеличением возраста наблюдаются изменения легочного венозного потока. У лиц пожилого возраста отмечались бо'льшие отношения S/D, а также показатели ретроградного тока крови в легочные вены (Ar, tApv), что также свидетельствует о нарушении наполнения ЛЖ и увеличении конечного диастолического давления ЛЖ.
В настоящее время перспективным направлением в изучении диастолической функции ЛЖ является тканевая миокардиальная допплер-ЭхоКГ. В отличие от традиционного метода оценки трансмитрального потока диастолические показатели движения фиброзного кольца митрального клапана не зависят от ЧСС, ритма и преднагрузки (давления в левом предсердии, легочных венах), сердечного выброса и систолического АД. В данной работе в группе пожилых лиц отмечались снижение скорости Em, отношения Em/Am и увеличение E/Em, что наблюдается при нарушении расслабления миокарда ЛЖ. Тканевой допплер является более чувствительным методом в определении возрастных изменений на ранних этапах. Так, по некоторым данным, уменьшение отношения Е/А <1 у здоровых людей наступает в возрасте 60—69 лет, в то время как снижение отношения Em/Am<1 — в возрасте 40—49 лет. Одним из объяснений может служить то, что нарушение процесса активного расслабления продольных волокон миокарда происходит еще до снижения глобальной диастолической функции [9].
В рамках данной работы проводилась также оценка уровня NT-proBNP. Его значения оказались достоверно выше в группе лиц старше 60 лет. Подобные результаты у лиц пожилого возраста в отсутствие ССЗ, гипертрофии ЛЖ, с нормальным синусовым ритмом и нормальной функцией почек получены и другими исследователями [4]. Некоторые ученые объясняют его повышение с возрастом ремоделированием миокарда ЛЖ. Известно также, что NT-proBNP способен увеличиваться при нарушении диастолической функции ЛЖ даже в отсутствие снижения систолической функции, что характерно для пожилых лиц [3].
Механизмы, лежащие в основе развития зависящей от возраста ДД ЛЖ, повышения уровня NT-proBNP с увеличением возраста, неясны. Мы предположили роль старения клеток. Изучение процессов старения клеток началось более 100 лет назад. Но до сих пор непонятно, как оно связано со старением сердца или организма в целом. Одна из теорий старения клетки, предложенная А.М. Оловниковым в 1971 г., основана на укорочении теломер — концевой недорепликации ДНК [14].
Нами проверена гипотеза, что длина теломер, являясь маркером старения клеток, может быть связана с зависящими от возраста изменениями диастолической функции ЛЖ, повышением уровня NT-proBNP. В результате статистического анализа показано, что наиболее чувствительные параметры диастолической функции ЛЖ — E/A и Em/Am достоверно и независимо от возраста связаны с длиной теломер лейкоцитов. Наличие коротких теломер предопределяло более выраженные нарушения диастолы в одной возрастной группе. Это позволяет предполагать, что старение миокарда обусловлено старением кардиомиоцитов, ассоциированным с укорочением теломер.
Однако связи длины теломер с уровнем NT-proBNP выявить не удалось. Вероятно, его повышение является лишь следствием возрастного ремоделирования миокарда (по данным литературы) или нарушения в диастолической функции ЛЖ, но не имеет непосредственной связи со старением клеток.
Раньше считалось, что кардиомиоциты — это терминально дифференцированные (неделящиеся) клетки, длина теломер которых с возрастом по логике не должна изменяться. Соответственно возрастное ремоделирование миокарда объясняли лишь клеточной потерей, обусловленной апоптозом. Так, в возрасте от 17 до 90 лет в сердце человека посредством апоптоза погибает почти 35% кардиомиоцитов. В год ЛЖ теряет около 38 млн кардиомиоцитов. Гибель клеток при этом ведет к компенсаторной гипертрофии оставшихся кардиомиоцитов, ремоделированию миокарда и нарушению его сократительной деятельности [15]. Потеря клеток в миокарде сопровождается увеличением содержания коллагена, что ведет к повышению жесткости миокарда, снижению его податливости [16].
В последнее время ученые выявили, что наряду с неделящимися клетками у взрослых и пожилых людей существует группа кардиомиоцитов (менее 50%), способных к делению, а также к обновлению за счет «кардиальных» стволовых клеток или клеток-предшественников. Такие кардиомиоциты на определенном этапе подвергаются аресту клеточного цикла посредством p16INK4A/p53 — ингибиторов пролиферации клеток и переходят в состояние их старения. «Старые» кардиомиоциты показывают уменьшение длины теломер до 15 kb, вместо 30 kb [17].
M. Terai и соавт. удалось установить, что с увеличением возраста как в кардиомиоцитах, так и в клетках-предшественниках наблюдается уменьшение длины теломер. При этом авторы выявили отрицательную корреляцию длины теломер клеток миокарда с возрастом [7].
Укорочение длины теломер в кардиомиоцитах сопровождается их старением — уменьшением в размере, накоплением в них неразлагающихся соединений (липофусцина), нарушением работы митохондрий и лизосом. Накопление «стареющих» клеток с увеличением возраста способствует развитию фенотипа стареющего сердца. Так, у мышей укорочение теломер сопровождалось снижением массы ЛЖ, нарушением релаксации и сократительной способности ЛЖ, а также развитием СН [18].
Механизмом связи длины теломер с развитием зависящей от возраста ДД ЛЖ может быть репликативное старение кардиомиоцитов (ограничение количества делений). Кроме того, показано, что накопление в кардиомиоцитах с возрастом p16INK4a (маркера репликативного старения) связано с апоптозом миоцитов и их клеток-предшественников. Как известно, апоптоз считают одним из главных механизмов старения миокарда. Возможно, апоптоз является не первичным индуктором старения миокарда, как предполагалось ранее, а запускается в результате критического укорочения длины теломер [19].
Ряд авторов сообщают о наличии связи длины теломер с развитием изолированной диастолической СН у лиц пожилого возраста [20]. Одной из немногих работ, посвященных изучению связи старения миокарда с длиной теломер, явилось исследование «Тhe Newcastle 85+ study». Участниками исследования были лица старше 85 лет, которым проводились ЭхоКГ и определение длины теломер лейкоцитов. Связи параметров диастолической функции ЛЖ с длиной теломер не получено, что, по мнению авторов, обусловлено малым числом участников, наличием у них снижения глобальной систолической функции на фоне ССЗ, а также некоторыми техническими ограничениями измерения диастолической функции ЛЖ с помощью портативного прибора на дому. Однако была обнаружена сильная положительная связь длины теломер лейкоцитов с фракцией выброса ЛЖ независимо от ССЗ, что позволило сделать вывод о существовании механизмов, с помощью которых старение оказывает непосредственное влияние на функцию миокарда [21].
Заключение
Результаты данной работы подтвердили, что пожилой возраст ассоциирован со снижением диастолической функции левого желудочка. При этом наиболее чувствительные параметры нарушения диастолы оказались достоверно и независимо от возраста связаны с длиной теломер лейкоцитов — маркером старения клеток. Это позволяет длину теломер рассматривать в качестве биомаркера старения сердца. Их оценка пока далека от современной клинической практики, тем не менее изучение старения клеток, возможно, изменит подход к профилактике сердечно-сосудистых заболеваний у пожилых лиц.



