Согласно Европейским рекомендациям [1], хроническая сердечная недостаточность (ХСН) рассматривается как «клинический синдром с появлением характерных симптомов (одышка, отек лодыжек, слабость) и признаков (набухание шейных вен, хрипы в легких и смещение верхушечного толчка) в результате структурных или функциональных изменений сердца». Таким образом, ХСН «представляет собой состояние с комплексом характерных симптомов, которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме». Наиболее частыми причинами ХСН являются артериальная гипертензия и ишемическая болезнь сердца (ИБС); среди других причин выделяют дилатационную кардиомиопатию, пороки сердца, миокардит, сахарный диабет 2 типа и другие эндокринные нарушения [2]. В 2002 г. в Российской Федерации, по некоторым данным, насчитывалось более 8 млн больных с характерными признаками ХСН [3]. Летальность при ХСН остается высокой, средняя годовая смертность среди пациентов с ХСН I–IV функциональным классом (ФК) составляет 6%, а среди больных с клинически выраженной ХСН – 12% [2]. В США ХСН выявлена у 5,8 млн взрослых лиц; по данным американских кардиологов, ее частота возрастет к 2030 г. на 25%, особенно среди пожилых пациентов. Учитывая распространение и высокую частоту госпитализаций больных ХСН затраты на их лечение в последующие годы возрастут с 30,7 до 69,8 млрд долларов США [4].
Диагностика ХСН в большинстве случаев не представляет больших трудностей и основывается на жалобах больного, физикальном обследовании, наличие клинических признаков (одышка, ограничение физической нагрузки, отеки лодыжек, появляющиеся в покое или при нагрузке) и результатах объективных методов обследования, отражающих структурные изменения сердца, а также оценке систолической и диастолической функций миокарда (данные ЭКГ, рентгенография грудной клетки, эхокардиография и др.). В настоящее время в диагностике ХСН широко используется метод определения в плазме крови натрийуретических пептидов, в частности мозгового натрийуретического пептида (BNP) и его предшественника – N-proBNP. Этот метод позволяет не только выявлять СН, но и проводить дифференциальную диагностику в неясных случаях и оценивать эффективность терапии. Особенно важна ранняя диагностика, т.к. лечение на стадии еще не сформировавшихся выраженных изменений сердца может замедляет их развитие и улучшать прогноз.
С этой целью Американская коллегия кардиологов и Ассоциация сердца детализировали классификацию ХСН [5], которая представлена в таблице.
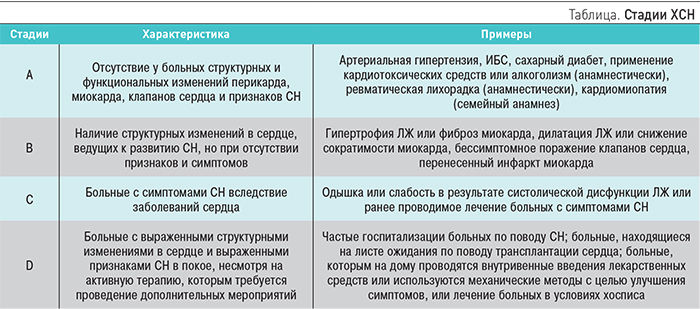
Таким образом, данная классификация определяет факторы риска и отражает те структурные изменения сердца, которые способствуют развитию ХСН, а это, в свою очередь, позволяет выбрать тактику лечения больных, у которых еще не выявляются признаки дисфункции левого желудочка (ЛЖ) и отсутствуют симптомы недостаточности кровообращения. Подчеркивается, что эта классификация не заменяет, а дополняет разработанную ранее классификацию с выделением 4-х классов ХСН (New York Heart Association, NYHA), основанную на функциональной активности пациентов. Следует подчеркнуть, что, согласно классификации NYHA, определение класса ХСН проводится на основании субъективной оценки врача; кроме того, установленный класс ХСН в течение короткого времени может меняться, хотя принцип лечения больных с различными ФК изменяется незначительно, вместе с тем классификация по стадиям позволяет более детально подходить к оценке состояния больных ХСН и рационально определять тактику лечения на каждой стадии развития ХСН.
Анализируя принципы терапии, используемые в крупномасштабных мультицентровых клинических исследованиях, можно выделить несколько этапов, отражающих их эффективность. Так, в прошлом в лечении больных ХСН основной принцип терапии заключался в улучшении гемодинамики, что было показано в исследовании V-HeFT [6], в котором лечение гидралазином в комбинации с изосорбида динитратом снижало летальность больных по сравнению с празозином и плацебо.
В дальнейшем изучение патофизиологических механизмов становления и прогрессирования ХСН позволило установить роль нейрогуморальных систем, в частности, симпатоадреналовой и ренин-ангиотензиновой, что существенно изменило принципы терапии, снизило летальность, частоту госпитализаций и улучшило качество жизни пациентов. Кроме того, было установлено, что сердце обладает «внутренней пластичностью» и может дилатироваться при СН в ответ на нагрузки и поражения миокарда, а также восстанавливать размеры после нейрогуморальной блокады или снижения пред- и постнагрузки [7]. Таким образом, применение средств, снижающих активность указанных выше систем, благоприятно отражается на результатах лечения. Это было продемонстрировано в нескольких исследованиях с применением ингибиторов ангиотензинпревращающего фермента (иАПФ), в частности эналаприла [8], результаты которых показали, что эналаприл на 16–40% снижал летальность больных ХСН, а исследование V-HeFT II [9] выявило существенное преимущество эналаприла перед комбинацией гидралазина и изосорбида динитрата в отношении снижения летальности пациентов. Таким образом, эти исследования, с одной стороны, выявили важную роль ангиотензина II в патогенезе ХСН, способствующего повышению постнагрузки, изменению структуры сердца, активированию симпатоадреналовой системы и эндотелина [10–12], а с другой, показали, что иАПФ, снижающие его активность, оказывают хороший клинический эффект. Однако в последующем было установлено, что, несмотря на применение иАПФ (даже в высоких дозах), активность ангиотензина II, хоть и в меньшей степени, но сохраняется [13, 14]. С целью более полного подавления эффектов ангиотензина II был разработан и внедрен в практику новый класс лекарственных средств, блокирующих рецепторы ангиотензина II, эффективность которых также была изучена у больных ХСН. Так, исследование Val-HeFT [15] показало, что валсартан оказывал у этой группы пациентов хороший эффект (снижал выраженность клинических симптомов СН, частоту госпитализаций и летальность), однако эффективность этих средств не превышала эффект иАПФ. Ориентируясь на эти результаты, иАПФ и блокаторы рецепторов ангиотензина II (БРА) рассматриваются как средства первого выбора в лечении больных ХСН.
ЭФФЕКТИВНОСТЬ БЛОКАТОРОВ МИНЕРАЛОКОРТИКОИДНЫХ РЕЦЕПТОРОВ
Предполагалось, что монотерапия иАПФ, блокируя ангиотензина II, будет угнетать активность и другого ключевого компонента этой системы – минералокортикоида альдостерона, который также оказывает отрицательные эффекты при СН, способствуя ремоделированию сердца и сосудов, развитию фиброза, увеличению ригидности миокарда, уменьшению синтеза оксида азота, развитию гипокалиемии и аритмии [16]. В проведенных ранее исследованиях у больных ХСН установлена прямая связь между уровнем альдостерона в крови и снижением толерантности к физической нагрузке, повышением заболеваемости и летальности [16, 17], поэтому блокада альдостерона имеет важное значение. Повышение концентрации альдостерона у больных ХСН может быть достаточно выраженным вследствие как его увеличенного синтеза в надпочечниках и клетках сосудов, так и замедления скорости печеночного клиренса [18]. Однако, несмотря на снижение уровня ангиотензина II на фоне терапии иАПФ, активность альдостерона сохранялась – феномен, получивший название «ускользание альдостерона». По некоторым данным, этот феномен встречается у 50% больных, получающих эти препараты [18, 19]. В некоторых исследованиях было даже показано, что уровень альдостерона может увеличиваться выше исходного значения уже в первые 3 дня от начала лечения иАПФ [20]. С целью подавления активности альдостерона были разработаны несколько стратегий, в частности использование высоких доз иАПФ или комбинации последних с БРА. Однако и в этих случаях не удалось исключить феномен «ускользания альдостерона» [21, 22]. Определить, разовьется ли данный феномен до назначения иАПФ больным ХСН, в настоящее время невозможно, т.к. отсутствуют клинико-лабораторные критерии его выявления. Причины развития феномена не установлены. Среди возможных обсуждаются несколько механизмов, в частности независимая от ангиотензина II продукция альдостерона в сердце, мозге, сосудистой стенке; стимуляция синтеза альдостерона эндотелином и/или за счет альтернативных энзимных путей синтеза [23, 24].
Блокировать активность альдостерона у больных ХСН стало возможным при дополнительном назначении к стандартной терапии его антагониста – неселективного блокатора альдостероновых рецепторов спиронолактона (СП), и результаты первого крупного международного клинического исследования RALES [25] показали хороший клинический эффект. В этом исследовании авторы, применяя СП в небольших дозах (25–50 мг/ сут) в среднем в течение 24 мес у больных, получавших иАПФ, выявили снижение летальности на 30% (как от прогрессирования СН, так и частоты случаев внезапной смерти). В другом исследовании было показано, что СП улучшал функцию ЛЖ и повышал толерантность к физической нагрузке [26]. Результаты этих исследований стимулировали дальнейшие научные разработки не только по изучению механизмов, при которых снижение активности альдостерона оказывало благоприятный эффект у больных данной патологией, но и по созданию новых блокаторов минералокортикоидных рецепторов, лишенных неблагоприятных побочных эффектов СП, которые ограничивают его применение.
Подобные исследования позволили создать путем модификации молекулы СП новый селективный антагонист альдостерона – эплеренон (ЭП), который не взаимодействует с андрогеновыми и прогестероновыми рецепторами. После приема внутрь биодоступность ЭП составляет 67% [27], при одновременном приеме с пищей биодоступность и время до достижения пика плазменной концентрации не изменяются. ЭП метаболизируется в печени изоэнзимом CYР3А4 системы цитохрома Р-450 с образованием неактивных метболитов, поэтому одновременный прием с кетоконазолом, верапамилом или эритромицином, ингибирующими активность этого изофермента, требует снижения дозы ЭП [28]. ЭП экскретируется с мочой (67%) и калом (37%). Максимальная концентрация ЭП в крови выявлена у лиц в возрасте 65 лет и старше; она увеличивается и у пациентов с почечной недостаточностью [29]. В отличие от СП, ЭП проявляет большую тропность к альдостероновым рецепторам, а его аффинность к прогестероновым и андрогеновым рецепторам в 100 и 1000 раз ниже, чем у СП [30], поэтому наиболее часто встречающиеся побочные эффекты ингибиторов минералокортикоидных рецепторов при применении ЭП наблюдаются существенно реже.
Как было показано в экспериментальных исследования, ЭП оказывает разнообразные эффекты, которые могут благоприятно отражаться на эффективности лечения больных. Так, установлено, что препарат улучшает эндотелиальную функцию; снижает выраженность оксидативного стресса, независимо от снижения давления; уменьшает ремоделирование сосудов и повышает уровень оксида азота [31].
Результаты исследования RALES послужили основанием для проведения теми же авторами другого мультицентрового рандомизированного двойного слепого плацебо-контролируемого исследования EPHESUS [32], в котором оценивали эффективность другого антагониста минералокортикоидных рецепторов ЭП у больных острым инфарктом миокарда. В этом исследовании участвовали 674 центра в 37 странах. В исследование включали больных на 3–14-й день (в среднем через 7 дней) после острого инфаркта с признаками левожелудочковой недостаточности (фракция выброса ≤40%), получавших иАПФ или БРА, β-адреноблокаторы, диуретики и аспирин. Начальная доза ЭП составляла 25 мг/сут, которую через 4 нед, при отсутствии противопоказаний, увеличивали до 50 мг/сут. Из общего количества больных (6642 человека) 3319 получали ЭП (1-я группа), 3313 – плацебо (2-я группа). Первичными конечными точками служили время до развития смерти от любой причины и время до наступления смерти от сердечно-сосудистых причин или до первой госпитализации по этим же причинам (повторный инфаркт миокарда, СН, инсульт, желудочковые аритмии). Основными вторичными конечными точками служили смерть от любой причины или от сердечно-сосудистых причин, а также госпитализация по любой причине. Лечение продолжалось до тех пор, пока не было зарегистрировано 1012 летальных случаев (в среднем исследование продолжалось 16 мес). Летальность от любой причины в 1-й группе составила 14,4% (478 случаев), во 2-й – 16,7% (554 случая). Летальность от сердечно-сосудистых причин или госпитализации по этим же причинам составили 26,7% (885 больных, 1-я группа) и 30,0% (993 больных, 2-я группа) соответственно. Таким образом, в 1-й группе наблюдалось снижение летальности от сердечно-сосудистых причин (внезапная смерть, инфаркт миокарда, СН) по сравнению со 2-й группой. Также в этой группе на 23% было меньше случаев госпитализации по поводу СН. С использованием метода Каплана–Мейера было установлено, что летальность в течение года в 1-й группе составила 11,8%, во 2-й группе – 13,6%.
Выраженная гиперкалиемия (≥6 ммоль/л) отмечена в 1-й группе у 5,5%, в 2-й – у 3,9% пациентов, что потребовало госпитализации 15 и 3 больных соответственно. Высокий уровень калия, как правило, достигался у больных с исходно сниженным клиренсом креатинина. Так, при значении последнего <50 мл/мин выраженная гиперкалиемия встречалась у 10,1% больных в 1-й группе и у 5,9% во 2-й; при более высоком уровне (>50 мл/мин) у 4,6 и 3,5% пациентов соответственно.
Таким образом, результаты исследования показали, что ЭП значительно снижал летальность от сердечно-сосудистых причин, в основном за счет снижения риска внезапной смерти у больных после острого инфаркта миокарда. Также снижались риск прогрессирования СН, развития инфаркта миокарда и частота госпитализаций.
Несмотря на благоприятные результаты применения блокаторов минералокортикоидных рецепторов у пациентов с выраженной ХСН и у больных, перенесших инфаркт миокарда, осложненный нарушением систолической функции ЛЖ, все же оставались нерешенные вопросы в отношении эффективности этих средств у больных с нетяжелым течением ХСН. С этой целью было предпринято исследование EMPHASIS-HF [33], выполненное двойным слепым рандомизированным методом у 2737 больных с ХСН (NYHA II; фракция выброса не более 35%; возраст 55 лет и старше). ЭП назначали в начальной дозе 25 мг/ сут (1-я группа) на фоне комплексной терапии, включавшей иАПФ, БРА и β-адреноблокаторы в максимально переносимой дозе. Через 4 нед при отсутствии противопоказаний дозу ЭП увеличивали до 50 мг/сут. Группа больных, получавших плацебо, служила контролем. Исследование было преждевременно прекращено, т.к. промежуточный анализ, проведенный через 21 мес от его начала, показал значительное снижение в количестве летальных случаев (12,5 против 15,5%) от сердечно-сосудистых причин, а также снижение частоты госпитализаций по причине ХСН в 1-й группе (18,3 против 25,9% в контрольной группе). Статистически значимое увеличение концентрации калия в сыворотке крови (более 5,5 ммоль/л) отмечали в 1-й группе (11,8 против 7,2% в контрольной группе), однако не было различий между группами при концентрации калия более 6 ммоль/л (2,5 против 1,9%). Это встречалось, несмотря на то, что у ⅓ больных значение скорости клубочковой фильтрации (СКФ) было <60 мл/мин/1,73 м2.
Таким образом, эти исследования показали, что, независимо от стадии ХСН, ЭП оказывает выраженный клинический эффект у больных систолической дисфункцией ЛЖ. Вместе с тем в исследовании RAAM-PEF [34] было показано, что ЭП улучшает также и диастолическую функцию у больных ХСН.
Обсуждая механизмы, которые обуславливают хороший клинический эффект ЭП у данной группы пациентов, авторы указывают не только на благоприятные электролитные сдвиги, но и подчеркивают важность неренальных изменений, которые могут иметь большее значение. Среди них снижение воспалительных реакций в коронарных сосудах и, как следствие, уменьшение интерстициального фиброза миокарда, снижение оксидативного стресса, улучшение эндотелиальной функции, снижение агрегации тромбоцитов, активности металлопротеиназ и активности симпатоадреналовой системы, улучшение вариабельности частоты сердечных сокращений.
ПОБОЧНЫЕ ЭФФЕКТЫ БЛОКАТОРОВ МИНЕРАЛОКОРТИКОИДНЫХ РЕЦЕПТОРОВ
Клинические исследования, выполненные с СП и ЭП, показали, что наиболее частыми побочными эффектами являются электролитные и эндокринные нарушения. Так, сывороточная концентрация калия возрастала на 0,3 ммоль/л (исследование RALES) и на 0,3 и 0,16 ммоль/л соответственно (исследования EPHESUS и EMPHASIS-HF). Т.к. выраженная гиперкалиемия (концентрация в плазме >6 ммоль/л) является серьезным побочным эффектом, то разработаны специальные рекомендации по мониторингу уровня калия при назначении ингибиторов минералокортикоидных рецепторов. Прежде всего следует учитывать факторы риска развития гиперкалиемии при назначении антагонистов альдостерона [35]:
- Почечная недостаточность: повышенный риск при СКФ <60 мл/мин, высокий риск при СКФ <30 мл/мин.
- Сахарный диабет.
- Сниженный объем циркулирующей крови (диарея, активное лечение диуретиками).
- Пожилой возраст.
- Сопутствующая терапия: иАПФ, БРА, калийсберегающие диуретики (триамтерен, амилорид), донаторы калия, β-адреноблокаторы, нестероидные противовоспалительные средства, гепарина сульфат.
- Диета с высоким содержанием калия.
Разработаны рекомендации в отношении мониторинга уровня калия в крови на фоне лечения антагонистами альдостерона, которые включают определение клиренса креатинина до назначения этих средств, определение уровня калия через неделю и через месяц от начала лечения. Если через месяц уровень калия <5 мэкв/л, возможно при необходимости увеличить дозу препарата; если уровень калия в пределах 5,0–5,4 мэкв/л, то лечение продолжается в той же дозе; при концентрации калия от 5,5–6,0 мэкв/л доза снижается, при уровне калия ≥6 мэкв/л препарат отменяют [36]. Согласно рекомендациям FDA [37], особое внимание следует уделять пожилым пациентам и больным сахарным диабетом, т.к. у этих категорий чаще развиваются побочные эффекты антагонистов альдостерона (в частности гиперкалиемия); кроме того, необходимо корректировать дозы при сопутствующей терапии с нестероидными противовоспалительными средствами (неселективными и селективными), иАПФ и калийсодержащих средств.
Среди эндокринных нарушений частыми побочными эффектами являются гинекомастия, мастодиния (боли в области грудных желез у мужчин), нарушение менструальной функции и эректильная дисфункция. Эти эффекты особенно часто встречаются при назначении СП (гинекомастия и мастодиния у 10% в исследовании RALES и 0,5% в исследовании EPHESUS) и зависят от дозы и длительности лечения. Причины данных нарушений связаны с тем, что СП, снижая продукцию тестостерона, повышает превращение последнего в эстрадиол, блокирует связь андрогенов с рецепторами [38].
Эректильная дисфункция, по некоторым данным, встречается у 60–70% больных ХСН [39, 40], ее развитие обусловлено не только атеросклерозом, снижением продукции или усиленным распадом оксида азота, повышенным уровнем циркулирующего эндотелина, но и приемом лекарственных средств, некоторые из которых рассматриваются как стандарт в лечении этой категории пациентов (в т.ч. СП). Поэтому с целью снижения риска развития эректильной дисфункции у больных ХСН рекомендуется заменять СП на ЭП, не обладающий антиандрогенным эффектом и не способствующий эректильной дисфункции [40].
ЗАКЛЮЧЕНИЕ
Результаты крупномасштабных клинических исследований отчетливо показали, что добавление ингибиторов минералокортикоидных рецепторов к стандартной терапии больных ХСН (иАПФ, БРА, β-адреноблокаторы, диуретики) существенно повышают эффект проводимого лечения, улучшают гемодинамику, качество жизни и снижают летальность пациентов. Наблюдаемые улучшения обусловлены разнообразными эффектами СП и ЭП. Эффективность этих препаратов не зависела от наличия систолической дисфункции сердца при использовании СП или систолической и диастолической недостаточности при применении ЭП, а также от ее класса. Несмотря на то, что оба средства обладают одинаковым механизмом действия, ЭП имеет преимущество в отношении развития эндокринных побочных эффектов, что обусловлено минимальным ингибированием андрогеновых и прогестероновых рецепторов. Несмотря на доказанную эффективность этих средств у больных ХСН, следует учитывать противопоказания к их назначению, особенно у пожилых пациентов.


