По данным Европейского общества кардиологов (ESC), сердечная недостаточность присутствует у 1–2% взрослой популяции развитых стран. В течение одного года умирает 17% госпитализированных и 7% стабильных (амбулаторных) пациентов с сердечной недостаточностью [1]. Ухудшение прогноза пациента с хронической сердечной недостаточностью (ХСН) может быть обусловлено нарушениями углеводного и липидного обмена, ожирением, неалкогольной жировой болезнью печени (НАЖБП), которая рассматривается как самостоятельный фактор риска развития и прогрессирования ХСН [2]. Присутствие НАЖБП трехкратно повышает риск развития диастолической дисфункции (ДД) левого желудочка (ЛЖ) при сохраненной систолической функции у пациентов с сахарным диабетом (СД) 2 типа. Накопленные данные свидетельствуют о том, что наличие НАЖБП является независимым предиктором формирования ранних нарушений субстратного метаболизма миокарда [3–5] и в 5,5 раза увеличивается число госпитализаций по поводу ХСН в течение года [6]. Даже умеренное повышение уровня сывороточной γ-глутамилтранспептидазы (ГГТП) независимо ассоциируется с повышенным риском развития и прогрессирования ХСН [7–9]. Патогенез формирования кардиальной дисфункции у пациентов с НАЖБП не ясен, однако обсуждается роль инсулинорезистентности, липотоксичности на уровне миокарда, влияние провоспалительных цитокинов [10–12]; также отмечено, что увеличение содержания свободных жирных кислот может привести к накоплению липидов в миокарде с последующими изменениями в функции ЛЖ [13]. Показано, что изменения субстратного метаболизма миокарда ассоциируется при этом с нарушениями энергетических процессов в кардиомиоцитах, тканевой гипоксией, истощением запасов АТФ и нарушениями его электрической активности [10, 14]. В патогенезе повреждения гепатоцитов при НАЖБП отмечаются сходные патохимические расстройства, приводящие к нарушению функции митохондрий, истощению запасов АТФ с активацией свободнорадикальных процессов. Поэтому оценка эффективности и безопасности лекарственных препаратов, которые могли бы активно включаться во внутриклеточный метаболизм кардиомиоцитов и гепатоцитов, предупреждать негативные последствия инсулинорезистентности, глюкозо- и липотоксичности представляется перспективной и оправданной. Широкое применение в кардиологической практике получили цитопротекторы триметазидина сукцинат (ТМС) и 2-этил-6-метил-3-оксипиридина сукцинат (ЭМОПС) [15], в основе действия которых лежит способность оптимизировать внутриклеточный митохондриальный энергетический обмен и уменьшать потребность клеток в кислороде путем переключения энергообмена с окисления жирных кислот на преимущественную утилизацию глюкозы (более выгодный с точки зрения экономии кислорода вариант метаболизма) за счет стимуляции сукцинатдегидрогеназного пути метаболизма глюкозы и элементов цитохромной цепи (ЭМОПС) или блокады поступления жирных кислот в митохондрии (ТМС). Причем данные препараты обладают не только антигипоксическими, но и антиоксидантными свойствами, что позволяет им уменьшать негативное воздействие окислительного стресса и весьма целесообразно в лечении пациентов с сопутствующими нарушениями углеводного обмена [16]. Это делает актуальной оценку влияния ТМС и ЭМОПС в составе комбинированной терапии ХСН на структурно-функциональное состояние сердца, печени, проявление синдромов липотоксичности и инсулинорезистентности у пациентов с ХСН ишемической этиологии с нарушениями углеводного обмена. Также чрезвычайно важной является выработка алгоритма дифференцированного назначения указанных препаратов, т.к. по данным экспериментальных исследований применение pFox-ингибиторов (в частности, мельдония) может сопровождаться появлением или прогрессированием стеатоза печени, что опосредуется снижением печеночного пула карнитина, приводящим к нарушению метаболизма жирных кислот в печени [17].
МАТЕРИАЛЫ И МЕТОДЫ
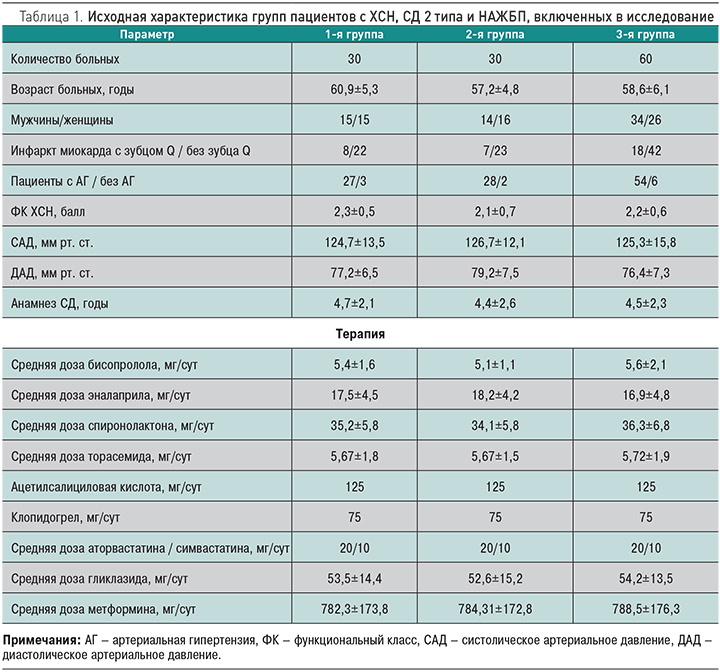
В исследование были включены 120 пациентов с ХСН ишемической этиологии и СД 2 типа. Все они имели клинические и ультразвуковые признаки НАЖБП [18]. Всем больным проводился расчет Fatty Liver Index (FLI) [19] и NAFLD Fibrosis Score (NFS) [20]. Пациентов, имеющих зависимость от алкоголя (потребление более 30 г/сут), в исследование не включали. Протоколы исследований были одобрены региональным этическим комитетом.
В отобранной когорте пациентов методом простой рандомизации было проведено разделение на группы, получающие в течение 16 нед препараты базисной терапии ХСН (n=60), а также комбинацию базисной терапии ХСН с цитопротекторами (n=60). Больные, принимающие цитопротекторы, дополнительно рандомизировались в отношении комбинации базисной терапии ЭМОПС или ТМС. В зависимости от результатов рандомизации были сформированы следующие группы пациентов. 1-я группа (n=30) включала больных ХСН и СД 2 типа (средний возраст 60,9±5,3 года), которым в дополнение к базисной терапии ХСН назначался ЭМОПС в суточной дозе 0,4 г перорально; 2-я группа (n=30) – пациенты с ХСН и СД 2 типа (средний возраст 57,2±4,8 года), получавших в дополнение к базисной терапии ХСН ТМС в суточной дозе 0,7 г перорально; 3-я группа (n=60) – контрольная – была представлена пациентами с ХСН и СД 2 типа, получавшими только базисную терапию ХСН (средний возраст 58,6±6,1 года). Больные всех групп были сопоставимы по возрасту, полу, тяжести заболевания, основным клиническим и гемодинамическим параметрам, а также используемым дозам препаратов базисной терапии ХСН и СД 2 типа. Исходная характеристика групп больных представлена в табл. 1. Всем пациентам проводилась оценка функционального класса ХСН и структурно-функционального состояния сердца на аппарате Sonoline G50 (Siemens, Германия) с допплеровским датчиком. Для оценки функционального состояния печени исследовали активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ) и γ-глутамилтранспептидазы (ГГТП) в сыворотке крови по общепринятым методикам на биохимическом анализаторе LIASYS-2 (AMS, Италия).
Изучали метаболические показатели, отражающие состояние углеводного (глюкоза крови натощак, гликозилированный гемоглобин) и липидного обмена (общий холестерин и его фракции, триглицериды) с расчетом индекса НОМА, характеризующего инсулинорезистентность (гомеостатическая модель ее оценки) [21].
Статистическая обработка результатов исследования проводилась при помощи пакета прикладных программ для обработки медицинской и биологической информации Statistica 7.0 (StatSoft, Inc., США). Нормальность распределений показателей оценивали по критерию Шапиро–Уилка. Сравнение независимых выборок проводили с привлечением критерия Краскела–Уоллеса. В качестве критического значения при проверке нулевой гипотезы принимали α=0,05. В случае связанных выборок использовали критерий Вилкоксона. В случае дихотомических показателей статистическая значимость различий долей оценивалась с привлечением точного метода Фишера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При оценке эффективности обоих цитопротекторов в составе 16-недельной комбинированной терапии ХСН у пациентов с СД 2 типа отмечали выраженный антиангинальный эффект препаратов, повышение толерантности к физическим нагрузкам и улучшение качества жизни пациентов по результатам Миннесотского и Сиэтлского опросников. Дополнительное назначение ЭМОПС в 1-й группе больных ХСН и СД 2 типа привело к уменьшению среднего балла по результатам Миннесотского опросника на 23,2%, прием ТМС во 2-й группе сопровождался уменьшением среднего балла по результатам этого опросника на 30,98%, в 3-й группе (контрольной) указанный показатель составил 15,3%. По данным Сиэтлского опросника в группах приема цитопротекторов наблюдалось достоверное (по критерию знаков) и сопоставимое по сравнению с группой базисной терапии уменьшение количества приступов стенокардии в неделю и потребности в нитроглицерине. Таким образом, несмотря на различия фармакологического эффекта использованных миокардиальных цитопротекторов (подавление транспорта и окисления жирных кислот в митохондриях – ТМС или прямая стимуляция окисления глюкозы и улучшение транспорта энергетического субстрата в митохондриях – ЭМОПС), оба препарата обладают выраженным антиангинальным потенциалом и способностью уменьшать потребность ишемизированного миокарда в кислороде.
По данным теста 6-минутной ходьбы, пройденная дистанция увеличилась при приеме ТМС и ЭМОПС на 38,8 и 31,7% соответственно против 24,7% в контрольной группе (р>0,05).
Как в основных, так и в контрольной группе пациентов наблюдалось улучшение клинического состояния больных, статистически более значимое при использовании цитопротекторов в составе комбинированной терапии ХСН. Отмечалось статистически значимое снижение функционального класса ХСН, более выраженное как в группах приема ТМС (-26,8 против -9,7% в группе контроля; р<0,05) и ЭМОПС (-28,5 против -11,2% в группе контроля; р<0,05). Аналогичная тенденция прослеживалась и в отношении динамики среднего балла по шкале оценки клинического состояния при ХСН. Также статистически значимым оказалось увеличение фракции выброса ЛЖ у больных, которым дополнительно назначались ТМС (на 15 против 2,6% в контрольной группе) и ЭМОПС (на 11,2 против 3,5%). Следует обратить внимание на то, что у всех пациентов, включенных в исследование, преобладали наиболее неблагоприятные типы ремоделирования ЛЖ – эксцентрическое (ЭР) и концентрическое (КР). Суммарное количество этих типов ремоделирования у пациентов с ХСН, СД 2 типа и НАЖБП составило 78,6%.
Дополнительный прием ТМС в течение 16 нед в составе базисной терапии ХСН привел к уменьшению суммарной частоты выявления ЭР и КР на 12,8% (p<0,05). Достоверно возросло количество больных с нормальной геометрией ЛЖ: с 0 до 7% (p<0,05). Различие с контрольной группой не достигло статистической значимости. Использование ЭМОПС также привело к уменьшению суммарного количества больных с КР и ЭР ЛЖ на 8,9% (p<0,05). Количество пациентов с нормальной геометрией ЛЖ достоверно увеличилось с 4,1 до 7,2% (p<0,05). Различие с контрольной группой также не достигло статистической значимости. Одним из механизмов, опосредующих благоприятное влияние ТМС и ЭМОПС на процессы ремоделирования ЛЖ, может быть статистически значимое снижение уровня триглицеридов в результате их 16-недельной терапии, что сопровождалось достоверной корреляцией уровня триглицеридов и индекса массы миокарда ЛЖ (r=0,72, p<0,05).
Прием цитопротекторов в составе комбинированной терапии ХСН у больных СД 2 типа сопровождался их положительным влиянием на показатели трансмитрального кровотока и ДД ЛЖ. Положительная динамика отмечалась при приеме как ТМС, так и ЭМОПС: отмечено увеличение числа больных c I стадией ДД ЛЖ до 28,6% в группе ТМС и до 20% в группе ЭМОПС. Обнаруженный эффект цитопротекторов в данном случае может быть связан с их положительным влиянием на процессы аэробного гликолиза и нормализацией окисления митохондриальных субстратов – свободных жирных кислот и глюкозы, нарушение утилизации которых рассматривается как основная причина развития ДД ЛЖ у пациентов с ХСН. Однако, по мнению Ю.Н. Федулаева и соавт. (2013) [23], отсутствие значимого эффекта у больных с псевдонормализацией и рестрикцией обусловлено имеющимся интерстициальным фиброзом и более выраженными изменениями в стенке коронарных артерий мышечного типа, а также небольшим накоплением в митохондриях недоокисленных жирных кислот, которые сами могут служить субстратом для перекисного окисления, вызывая образование токсичных свободных радикалов
В ходе проведенного исследования проводилась оценка влияния ТМС и ЭМОПС на показатели функционального статуса печени, а также индексы стеатоза и фиброза печени, которые позволяют дать скрининговую оценку тяжести структурного поражения печени у пациентов с НАЖБП и метаболическими нарушениями [23].
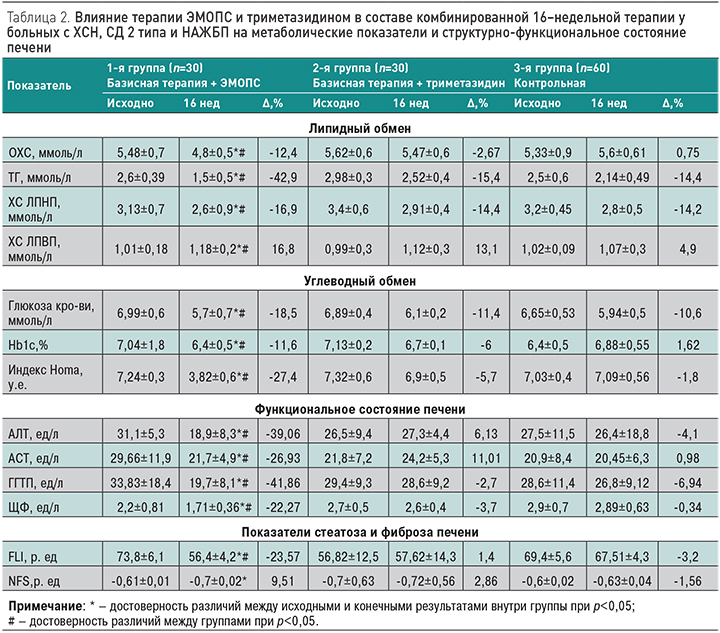
Полученные в ходе нашего исследования результаты свидетельствуют об отсутствии статистически значимого влияния ТМС на показатели функционального состояния печени, индексы ее стеатоза и фиброза печени у пациентов с ХСН и СД 2 типа, тогда как ЭМОПС оказывал выраженное гепатопротекторное действие (табл. 2). Исходная активность АСТ и АЛТ выше нормальных значений (но не более чем в 3 раза) отмечалась у 20% больных основных и 23,3% – контрольной группы. Отмечено статистически достоверное снижение активности АСТ и АЛТ в группе больных, принимавших ЭМОПС (на 39,06 и 26,93% соответственно против 4,1 и 0,98% в контрольной группе). Через 16 нед терапии ЭМОПС в составе комбинированной терапии ХСН показатели АСТ и АЛТ нормализовались, тогда как в контрольной группе у 10% больных сохранилось повышение активности АСТ. Также в результате применения ЭМОПС наблюдалось снижение активности ЩФ и ГГТП. При этом активность снизилась на 22,7% против 0,34% в контрольной группе (p<0,05), а ГГТП – на 41,86 против 6,9% (p<0,05). Статистически значимо уменьшилось и количество больных с повышенной активностью ГГТП (с 26,7 до 0%), тогда как в контрольной группе повышение активности ГГТП сохранилось у 20% пациентов. Отмеченный эффект можно расценить как прогностически благоприятный признак для больных с ХСН и НАЖБП в свете данных о повышении ГГТП как предикторе высокого кардиоваскулярного риска и риска смерти у пациентов с ХСН [24].
Обращает на себя внимание статистически значимое снижение индекса стеатоза FLI в группе пациентов, принимающих ЭМОПС: на 23,57 против 3,2% в контрольной группе. Разница по этому показателю между группами ТМС и ЭМОПС достигла статистической значимости. Индекс NFS не претерпел достоверных изменений ни в одной из групп пациентов. В отношении ЭМОПС доказано антиксидантное, мембраностабилизирующее и антигипоксическое действие, обусловленное присутствием в составе препарата сукцината, поддерживающего активность сукцинатоксидазного звена даже в условиях глубокой гипоксии. В качестве антигипоксанта ЭМОПС стимулирует прямое окисление глюкозы по пентозофосфатному шунту, активируя сукцинатдегидроденазный путь окисления и переключая клеточный метаболизм с преимущественного окисления жирных кислот на окисление глюкозы.
Обсуждение вопроса эффективности использования метаболический препаратов-цитопротекторов невозможно без оценки их влияния на основные метаболические факторы нарушения субстратного метаболизма у пациентов с СД 2 типа и НАЖБП – гипергликемию, дислипидемию, инсулинорезистентность. Следует отметить, что как ТМС, так и ЭМОПС оказывали положительное метаболическое действие при использовании в составе комбинированной терапии пациентов с ХСН, СД 2 типа и НАЖБП. Однако по выраженности влияния на показатели липидного и углеводного обмена ЭМОПС значимо превосходил триметазидин (табл. 2), статистически значимо снижая все показатели, отражающие формирование синдромов липо- и глюкозотоксичности. Уровень триглицеридов статистически значимо снижался на 42,5 против 14,4% в группе контроля; аналогичная динамика прослеживалась и в отношении других показателей липидного обмена.
Завершая обсуждение вопроса о возможностях использования изученных метаболических препаратов в комбинированной терапии пациентов с ХСН, СД 2 типа и НАЖБП, следует отметить, что эффекты этих лекарственных средств не ограничиваются антиишемическим и антиоксидантным действием. К числу плейотропных эффектов ТМС относятся влияния на процессы хронического системного воспаления [25] и эндотелиальной дисфункции по данным оценки эндотелийзависимой реакции лучевой артерии [26], что может быть обусловлено воздействием препарата на внутриклеточные механизмы, такие как внутриклеточное содержание ионов кальция, активность митоген-активных протеинкиназ и продукцию сосудисто-эндотелиального фактора роста [27]. Существенным эндотелиотропным потенциалом обладает и ЭМОПС. При его применении у пациентов с ХСН и НАЖБП отмечено увеличение амплитуды эндотелиальных колебаний и коэффициента вариации (КV) при оценке показателей микроциркуляции, что отражает способность ЭМОПС улучшать эндотелиальную секрецию вазодилататоров сосудистой стенки, коррелирующую с положительными изменениями индексов стеатоза и фиброза печени [28].
ЗАКЛЮЧЕНИЕ
Таким образом, использование ТМС и ЭМОПС у пациентов с ХСН, СД 2 типа и НАЖБП вполне оправданно и оказывает дополнительное органопротективное действие. Применение ТМС и ЭМОПС сопровождается значимыми кардиопротективными эффектами (на процессы ремоделирования миокарда, систолическую и диастолическую дисфункцию). ТМС незначительно влияет на структурно-функциональное состояние печени, тогда как ЭМОПС демонстрирует выраженные гепатопротективные свойства, улучшая функциональное состояния гепатоцитов и достоверно снижая выраженность стеатоза печени. Кроме того, ЭМОПС обладает более выраженным влиянием на синдромы липо-, глюкозотоксичности и инсулинорезистеность, что может быть принципиально важным при использовании препаратов метаболического действия у коморбидных пациентов с ХСН, СД 2 типа и НАЖБП.



