ВВЕДЕНИЕ
Распространенность ХСН в мире превышает 26 млн человек; затраты, связанные с лечением декомпенсации ХСН, составляют более 108 млрд долл. в год [1]. С учетом старения населения ожидается дополнительный прирост уровня распространенности ХСН [2]. И это несмотря на то что за последние 20 лет достигнут большой успех в лечении ХСН, в результате чего прогноз амбулаторных больных с ХСН значительно улучшился [3].
Поэтому, несмотря на значительные терапевтические успехи, ХСН остается серьезной проблемой общественного здравоохранения [4], характеризуясь при этом большой вероятностью регоспитализации и/или смерти [5, 6], особенно в первые месяцы после выписки из стационара [5]. При этом декомпенсация ХСН является особым клиническим синдромом, требующим госпитализации из-за прогрессирования симптомов ХСН на фоне гиперволемии [7]. Выживаемость пациентов с ХСН после каждого перенесенного эпизода декомпенсации гемодинамики прогрессивно снижается. Правда, стоит отметить, что не рекомендуется использование факта потребовавшейся госпитализации по поводу декомпенсации ХСН в качестве суррогатной конечной точки [3].
Доступными маркерами перенапряжения нейрогуморальных систем могут быть нарушения водно-солевого гомеостаза или же зафиксированные при помощи ЭКГ нарушения [8]. Клинический портрет пациентов с ХСН часто осложняется электролитным дисбалансом [9]. Крупные иностранные регистры [5, 10, 11, 12] также сообщают о влиянии нарушений водно-солевого гомеостаза натрия и калия на ближайший и отдаленный прогноз у пациентов с ХСН со сниженной равно, как и с сохранной ФВЛЖ.
Однако вопрос о проблеме водно-солевого гомеостаза у пациентов, госпитализированных в нашей стране по поводу декомпенсации ХСН, недостаточно освещен в литературе.
Цель исследования. Изучить взаимосвязь между нарушениями водно-солевого гомеостаза при поступлении в стационар у пациентов, госпитализированных по поводу декомпенсации ХСН и отдаленным годичным прогнозом.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Методы исследования: данное проспективное исследование базируется на клинико-анамнестических данных, результатах лабораторно-инструментального обследования и годичного наблюдения за 111 пациентами, госпитализированными по поводу декомпенсации ХСН в ГБУЗ ГКБ № 24 ДЗМ им. Екатерины II, в январе 2015 г. — феврале 2016 г.
Исследование было «принято к сведению» локальным Комитетом по этике ФГАОУ ВО Первого МГМУ им. И.М. Сеченова Минздрава России (Сеченовский университет). Все пациенты-участники исследования были старше 18 лет и до включения в исследование подписывали Добровольное информированное согласие пациента после объяснения им его целей и задач (согласно Международным требованиям ВОЗ и Хельсинской декларации Всемирной медицинской ассоциации). Для сбора информации о состоянии пациентов, которые по тем или иным причинам не смогли прийти на консультацию после полугода и года, использовалось стандартное телефонное анкетирование самих пациентов либо членов их семей.
Критерии включения: все пациенты-участники исследования исходно имели диагноз ХСН любой этиологии и были госпитализированы в связи с нарастанием симптомов ХСН и признаками задержки жидкости в организме.

Критерии невключения-исключения: острая (de novo) сердечная недостаточность, острый коронарный синдром, тромбоэмболия ствола и крупных ветвей легочной артерии в течение последнего месяца, пациенты с активным миокардитом и эндокардитом, а также пациенты после операций на сердце и крупных сосудах и/или подвергавшиеся эндоваскулярному вмешательству в течение последнего месяца.
Кроме того, в исследование не включались пациенты с циррозом печени; с ХБП (регулярно получающие программный гемодиализ или другие виды почечно-заместительной терапии), а также злоупотребляющие алкоголем, ведущие асоциальный образ жизни, не понимающие целей и задач исследования ввиду когнитивных нарушений.
Были учтены и исключены такие вторичные причины электролитных сдвигов, как рвота, диарея и диабетический кетоацидоз.
Также из исследования исключались пациенты при нежелании продолжения участия в исследовании, появлении данных за активно протекающий онкологический процесс; с прогрессированием ХБП, требующим присоединения программного гемодиализа или других видов почечно-заместительной терапии.
Оборудование и расходный материал: все данные лабораторно-инструментального обследования были получены при их рутинном выполнении. Уровень креатинина определялся с использованием кинетического метода Джоффея, уреазно-глютамат-дегидрогеназного метода; уровень электролитов плазмы определялся ион-селективным методом при помощи системы клинической химии компании Instrumental laboratory SpA, модель «Ilab 650», Италия.
Индекс массы тела (ИМТ) рассчитывался как соотношение (массы тела в килограммах) / (рост в метрах, возведенный в квадрат), считаясь повышенным при значениях выше 25, в то время как ожирение диагностировалось при значениях ИМТ выше 30. Анемия диагностировалась при уровне гемоглобина ниже 130 г/л для женщин и 140 г/л для мужчин (в соответствии со стандартами 2015–2016 гг., рекомендованными клинической лабораторией ГБУЗ ГКБ № 24 ДЗМ).
ХБП, в соответствии с рекомендациями KDIGO (Chronic Kidney Disease Epidemiology Collaboration), 2012 [21], и диагностировалась при скорости клубочковой фильтрации (СКФ) ниже 60 мл/ мин/1,73м2. СКФ была рассчитана согласно представленному уравнению «2009 CKD–EPI creatinine equation» [21]:
(СКФ = 141 × min (SCr/k,1)a × max (SCr/k,1)-1,209 × 0,993возраст [× 1,018 для женщин] [× 1,159 для негроидной расы (в данном исследовании отсутствовавшей)],
где min SCr — это минимальный уровень креатинина либо его единственное значение, выраженное в мг/дл; max SCr — максимальный уровень сывороточного креатинина либо его единственное значение, выраженное в мг/дл; коэффициент a = (–0,329) для женщин и (–0,411) для мужчин; коэффициент k=0,7 для женщин и 0,9 для мужчин. Для перевода креатинина в привычные для России мкмоль/л рекомендуется значение уровня креатинина в мг/л умножить на коэффициент 88,4 [14].
Фракция выброса левого желудочка (ФВЛЖ) рассчитывалась по методу Симпсона и считалась сниженной при значениях 49% и ниже (пациенты с ФВЛЖ от 50% и выше имели гемодинамически значимое органическое поражение митрального либо аортального клапанов сердца). Систолическое давление в легочной артерии считалось повышенным при значениях выше 30 мм рт.ст., рассчитывалось по скорости струи регургитации на трикуспидальном клапане.
Распределение пациентов по группам проводилось в первые дни госпитализации по уровню натрия и калия сыворотки крови. Референтным считался диапазон значений 135–148 ммоль/л для натрия и 3,5–5,3 ммоль/л для калия в соответствии со стандартами 2015–2016 гг., рекомендованными клинической лабораторией ГБУЗ ГКБ № 24 ДЗМ.
Статистический анализ выполнен в программном обеспечении R (версия 2.14.1, R Core Teem 2011. R: A language and environment for statistical computing, R Foundation for Statistical Computing). Все значения р рассчитывались при помощи программы в 2 направлениях, считаясь при этом статистически значимыми при значениях ниже 0,05.

Антропометрические данные представлены в виде абсолютных либо процентных значений. Вид распределения количественных данных определялся математически при помощи критерия Шапиро–Уилка с точностью 0,05. Нормально распределенные количественные данные представлены как среднее ± стандартное отклонение, а для их сравнения использовался независимый t-тест Пирсона. Данные, имеющие отличное от нормального распределение, представлялись как медиана с интерквартильным интервалом, а для их сопоставления применялись непараметрические тесты, такие как U-тест Манна–Уитни для независимых выборок либо критерий Уилкоксона для связанных групп. Анализ выживаемости выполнен с использованием монофакторной и многофакторной регрессии Кокса.
РЕЗУЛЬТАТЫ
Все включенные 111 пациентов-участников исследования исходно имели ХСН и были госпитализированы в связи с нарастанием симптомов ХСН и признаками задержки жидкости в организме. Средний возраст составил 71±12 лет; 44,1% пациентов были мужского пола; экстренное поступление (IV ФК по NYHA) в 6% случаев; среднее ФВЛЖ 41±15%.
Нарушения водно-солевого гомеостаза при поступлении в стационар имели место в 33,3% случаев (гипонатриемия в 17,1% случаев; гипокалиемия в 12,6% случаев и гиперкалиемия в 9,0% случаев). Стоит отметить, что изначально включенные пациенты с гипернатриемией были в дальнейшем исключены из проводимого исследования ввиду появления новых данных за наличие у них активно протекающего онкологического процесса.
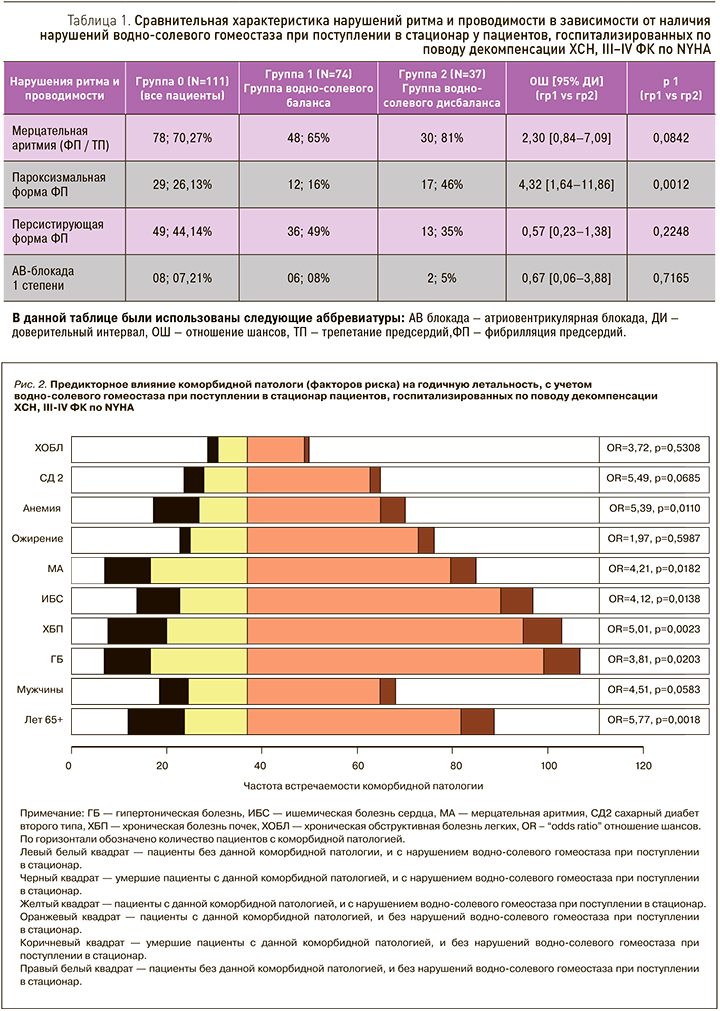
Пациенты с нарушением водно-солевого гомеостаза при поступлении в стационар характеризуются особым патофизиологическим профилем. Сравнительная характеристика предикторного влияния коморбидной патологии (факторов риска) на отдаленный годичный прогноз с учетом водно-солевого гомеостаза при поступлении в стационар представлена на рис. 1.
Результаты лабораторного обследования достоверно не отличались между группами пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA. Правда, стоит отметить статистически значимо более высокий уровень моноцитов в 1,33 раза (р=0,0387) и лактатдегидрогеназы в 1,23 (р=0,0366) среди пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA, по сравнению с пациентами, имевшими нормальный уровень натрия и калия. Результаты электрокардиографии и эхокардиографии достоверно не отличались между группами пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA.
Актуальные данные эхокардиографии были доступны у 103 пациентов (у оставшихся 8 пациентов эхокардиографические данные со сроком давности более года, доступные по данным выписок, были оценены на соответствие критериям включения-исключения, но при расчете не учитывались). Снижение ФВЛЖ имело место в 70,9% случаев (у 73 пациентов, среди которых у 32 пациентов ФВЛЖ была ниже 35%); во всех остальных 29,1% случаев (у 30 пациентов) было отмечено гемодинамически значимое поражение клапанов левого сердца. Cреднее ФВЛЖ 41±15% (95% ДИ 39–44%).
Пароксизмальная форма мерцательной аритмии статистически значимо преобладала среди пациентов с нарушением водно-солевого гомеостаза при поступлении в стационар по сравнению с пациентами, имевшими нормальный уровень электролитов сыворотки крови (OШ 4,32; 95% ДИ 1,64–11,86; p=0,0012) (табл. 1, 2).
Анализ выживаемости показал в целом, что общая смертность составляла 19,8% (22 пациента) к концу года наблюдения. По данным монофакторного регрессионного анализа с уровнем моноцитов было выявлено статистически значимое возрастание относительного риска годичной летальности в 2,3 раза [РО 2,27; 95% ДИ 1,07–2,37; p=0,023] и с уровнем мочевины в 4,7 раза [РО 4,68; 95% ДИ 1,10–1,25; p <0,01].
В то же время возрастание относительного риска годичной летальности, коррелирующее с уровнем ЛДГ [РО 0,995; 95% ДИ 0,998–1,01; p=0,32] и ФВЛЖ [РО (–0,838); 95% ДИ 0,96–1,02; p=0,402] , не достигло статистически значимой разницы, возможно, из-за малого числа наблюдений.
Диаграммы размахов уровней моноцитов и ФВЛЖ у подгрупп пациентов, госпитализированных по поводу декомпенсации ХСН III–IV ФК по NYHA, представлены на рис. 2.
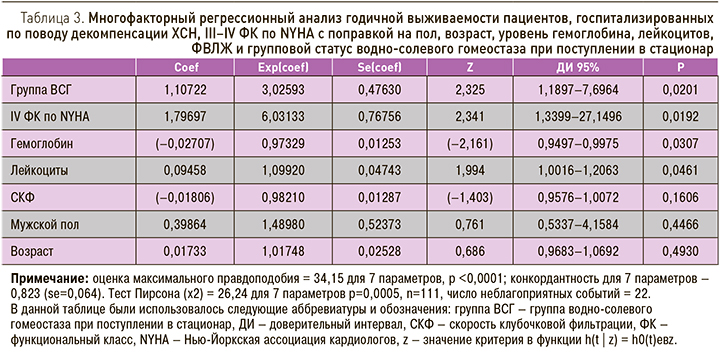
По данным многофакторного регрессионного анализа годичной выживаемости пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA с поправкой на уровень гемоглобина, лейкоцитов, СКФ, пол, возраст, ФК и групповой статус водно-солевого гомеостаза при поступлении в стационар, была выявлена конкордантность 0,82.
Так, статистически значимо независимо ассоциировались с возрастанием относительного риска в 2 раза: ФК [РО 2,34; 95% ДИ 1,34–27,15; p=0,0192], групповой статус водно-солевого гомеостаза при поступлении в стационар [РО 2,33; 95% ДИ 1,19–7,70; p=0,0201]; уровень лейкоцитов [РО 1,99; 95% ДИ 1,002–1,21; p=0,0461] и более низкий уровень гемоглобина [РО (–2,16); 95% ДИ 0,94– 0,998; p=0,0307] (табл. 3).
ОБСУЖДЕНИЕ
Развитие эпизода декомпенсации гемодинамики, требующего госпитализации, является одним из важнейших предикторов летальности для пациентов с ХСН [3]. Патогенетически регуляция водно-солевого гомеостаза непосредственно зависит от функции почек [5] как органа мишени для альдостерона, с одной стороны, и для мочегонных препаратов – с другой.
В физиологических условиях одновременное повышение секреции предсердных пептидов и ренина исключается разнонаправленностью их действия [15]. Однако при ХСН отмечается повышенная активность сразу обеих систем, а парадоксальный на первый взгляд феномен объясняется тем, что при снижении ФВЛЖ активируется одновременно и система натрийуретических пептидов, и РААС, ведя при этом не только к развитию транзиторной дисфункции почек, но и к повреждению почечной паренхимы как таковой [15].
Использование в лечении диуретиков лежит в основе схем для ведения пациентов с ХСН и перегрузкой сердца объемом циркулирующей крови [6]. Петлевые диуретики ассоциируются с компенсаторным увеличением уровня альдостерона, который опосредует повышение экскреции калия, магния, что ведет сначала к появлению гипомагниемии и уже затем к гипокалиемии [5]. Mentz R.J. и соавт. (2016) считают, что предпочтительнее будет выбор, сделанный в пользу торасемида, который, по сравнению с фуросемидом, способствует меньшей активации РААС и опосредует меньшее выведение калия из организма [16]. Ингибиторы АПФ, в-блокаторы, антагонисты рецепторов АПФ и антагонисты альдостерона способствуют повышению уровня калия [5]. Дигоксин напрямую ограничивает реабсорбцию магния в почечных канальцах, способствуя, как следствие, его выделению, а низкие концентрации магния и калия повышают токсичность сердечных гликозидов [17].

Однако проведенный в данной работе корреляционный анализ амбулаторно принимаемой терапии (основной и сопутствующей) показал отсутствие триггерного влияния терапии в генезе формирования нарушений водно-солевого гомеостаза у пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA. Корреляционный анализ с амбулаторно принимаемой основной терапией представлен на рис 3 и 4.
Сывороточный уровень натрия у пациентов с ХСН зависит одновременно от принимаемой диуретической терапии, с одной стороны, и от нейрогормональной активации, а также тяжести течения самой ХСН, с другой стороны [6, 9]. Активация высвобождения антидиуретического гормона (АДГ) в конечном итоге неизбежно приводит к появлению гипонатриемии [18]. Повышение уровня АДГ патогенетически ведет к миокардиальному фиброзу, гипертрофии и вазоконстрикции [19], а также к увеличению реабсорбции свободной воды в собирательных трубочках нефронов [18], несмотря на уже присутствующую перегрузку сердца объемом циркулирующей крови в виде растяжения ткани предсердий и низкой плазменной осмоляльности [6].
Гипонатриемия диагностируется при снижении плазменной концентрации натрия ниже 135 ммоль/л [20], проявляется как накопление в организме осмотически не связанной воды [18]. Сообщается о 13–24% частоте встречаемости гипонатриемии у пациентов с декомпенсацией ХСН [18, 21]. Прямые затраты, связанные с гипонатриемией, составляют в США от 1,6 до 3,6 млрд долл. в год [22].
В данной работе была выявлена 17,1% частота встречаемости гипонатриемии, что не противоречит литературным данным.
Сывороточный уровень калия. В физиологических условиях более 90% поступающего с пищей калия активно выводится дистальными трубочками нефронов [5], в то время как проксимальные трубочки его активно реабсорбируют. Тем не менее активация экскреции в дистальных трубочках под действием диуретиков добавляет лишь малую толику к его пассивной экскреции [5].
Гипокалиемия известна как предиктор неблагоприятного прогноза для пациентов с ХСН [23], даже несмотря на использование ингибиторов РААС [24]. Она диагностируется при уровне калия ниже 3,5 или 4,0 ммоль/л [9], с распространенностью 4–11% среди пациентов с ХСН [23, 25].
Патофизиологически гипокалиемия является результатом повышения уровня натрия в собирательных трубочках нефронов с последующей его реабсорбцией и увеличением экскреции калия для подержания электронейтральности [26].
Гиперкалиемия диагностируется при уровне выше 5,0 мЕкв/л [27] (что соответствует 5,0 ммоль/л [14]), распространенность гиперкалиемии среди пациентов с ХСН соответствует 4–7% [23, 25]. Риск развития гиперкалиемии у госпитализированных пациентов с ОДХСН ассоциируется с такими клиническими характеристиками пациентов, как сахарный диабет и более низкая СКФ [24].
Патофизиология гиперкалиемии обычно многофакторна и у пациентов с застойной ХСН складывается из дисбаланса двух контролирующих процессов: изменений в трансцеллюлярном распределении калия и аномалий внешнего баланса (как в случае резкого снижения почечного клиренса) [28].
В данном исследовании общая смертность составляла 19,8% (22 пациента) к концу года наблюдения. По данным монофакторного регрессионного анализа было выявлено статистически значимое возрастание относительного риска годичной летальности с уровнем моноцитов в 2,3 раза и с уровнем мочевины в 4,7 раза.
По данным многофакторного регрессионного анализа нарушения водно-солевого гомеостаза при поступлении в стационар ассоциировались возрастанием относительного риска годичной летальности в 2,33 раза.
Регистры по нарушениям водно-солевого гомеостаза у пациентов с ХСН. Ретроспективный анализ данных 51 710 пациентов, госпитализированных по поводу декомпенсации ХСН (включенных в Premier Hospital Database, среди которых 25 855 пациентов имели гипонатриемию), показал, что гипонатриемия ассоциировалась с увеличением затрат на лечение и уровня 30 дневной регоспитализации пациентов, представляя в конечном итоге потенциальную мишень терапевтического вмешательства для сокращения расходов на здравоохранение [29].
Legrand M. и соавт. (2018) [10] проанализировали данные 15 954 пациентов из исследования GREAT (Global Research and Acute Conditions Team), госпитализированных по поводу острой сердечной недостаточности. По их данным, относительный риск 90-дневной летальности возрастал на 22 и 46% для гипо- и гиперкалиемии соответственно (РО 1,22; ДИ 1,06–1,40 и РО 1,46; ДИ 1,34–1,58) по сравнению с пациентами, имевшими нормальный уровень калия сыворотки крови (3,5–4,5 ммоль/л). При этом многофакторная регрессионная модель показала увеличение относительного риска 90-дневной летальности на 3% при повышении уровня калия выше на каждые 0,1 ммоль/л выше 4,5 ммоль/л (РО 1,03; ДИ 1,02–1,04).
Метаанализ (проведенный Meta-Analysis Global Group in Chronic heart failure (MAGGIC) [11], включавший в общей сложности 14 766 пациентов с ХСН из 22 исследований, показал, что гипонатриемия является предиктором общей смерти в течение 3 лет, с линейным возрастанием уровня смерти при сывороточной концентрации натрия ниже 140 ммоль/л вне зависимости от ФВЛЖ.
Датское популяционное исследование когорты пациентов с застойной ХСН (n = 33 281) (Thomsen R.W. и соавт. (2017) [12]) сообщает, что гиперкалиемия отмечалась в 31,8% случаев течение 2,5 лет (что соответствует 125 пациентам на 1000 человеко-лет), ассоциируясь с большим возрастом и ХБП. Пациенты с застойной ХСН имели по крайней мере одну экстренную госпитализацию в 46% случаев за 6 мес до эпизода гиперкалиемии, причем после эпизода гиперкалиемии в течение 6 мес экстренную госпитализацию имели уже 75,5% пациентов (ОШ 1,8; 95% ДИ 1,7–1,9).
Hoss S. и соавт. (2016) [23] на большой когорте 6073 пациентов с ХСН со средней продолжительностью наблюдения 576 дней показали, что гипокалиемия ассоциируется с наихудшей выживаемостью пациентов (РО 2,62; 95% ДИ 1,84–3,75; p <0,001). При проведении многофакторного регрессионного анализа, в том числе и с уровнем сывороточного натрия (РО 0,96; 95% ДИ 0,94–0,97; p=0,001), наиболее благоприятным был уровень сывороточного калия (5,0–5,5 ммоль/л, считавшийся нормально высоким), со статистически значимым снижением летальности (РО 0,79; 95% ДИ 0,65–0,96; p=0,02) по сравнению с пациентами, имевшими референтный уровень сывороточного калия (3,5–5,5 ммоль/л).
ЗАКЛЮЧЕНИЕ
Таким образом, на сегодняшний день сформировались условия для переоценки роли электролитных сдвигов у пациентов с декомпенсацией ХСН с целью использования их в качестве маркеров-предикторов неблагоприятного прогноза. Такой подход способствует своевременному выявлению приоритетных групп больных, требующих, возможно, более агрессивного подхода к проводимой терапии, тем самым уменьшая количество повторных госпитализаций пациентов, в свою очередь, опосредованно снижая экономическое бремя.
ВЫВОДЫ
- Пациенты с нарушением водно-солевого гомеостаза при поступлении в стационар, госпитализированные по поводу декомпенсации ХСН, III–IV ФК по NYHA имеют особо специфичный, неблагоприятный патофизиологический профиль по сравнению с пациентами, имевшими нормальный водно-солевой гомеостаз при поступлении в стационар.
- Амбулаторно принимаемая терапия не является триггерным фактором для нарушений водно-солевого гомеостаза у пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA.
- Нарушения водно-солевого гомеостаза при поступлении в стационар являются сильным и независимым предиктором неблагоприятного отдаленного прогноза у пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA.
- По данным монофакторного регрессионного анализа с уровнем моноцитов и мочевины было выявлено статистически значимое возрастание относительного риска летальности к концу года наблюдения соответственно [РО 2,27; ДИ 95% 1,07–2,37; p=0,023] и [РО 4,68; ДИ 95% 1,10–1,25; p <0,01].
По данным многофакторного регрессионного анализа годичной выживаемости пациентов, госпитализированных по поводу декомпенсации ХСН, III–IV ФК по NYHA с поправкой на пол, возраст, ФК, уровень гемоглобина, лейкоцитов и групповой статус водно-солевого гомеостаза, при поступлении в стационар было выявлено статистически значимая корреляция с ФК, групповым статусом водно-солевого гомеостаза, уровнем гемоглобина и лейкоцитов.
ОГРАНИЧЕНИЯ
Данное исследование базируется на малом числе включенных пациентов. При измерении сывороточного и плазменного уровня калия могут быть различия даже референтных значений [14; 30], особенно при попеременном использовании обоих образцов для выполнения теста [14] (референтные значения плазменного уровня калия ниже на 0,5 мEкв/л) [30].
Также для определения почечного повреждения использовалось только определение уровня креатинина и расчет СКФ — суррогатный, но и самый точный маркер для пациентов с сердечной недостаточностью по данным литературы [5].
БЛАГОДАРНОСТИ
Авторы выражают благодарность в адрес всего коллектива ГБУЗ ГКБ № 24 ДЗМ, а именно администрации больницы, врачам и персоналу кардиологического отделения, а также пациентам и членам их семей за то понимание и сотрудничество, с каким они отнеслись к проводимой работе.



