Актуальность
Кашель – один из ведущих симптомов, причиняющих наибольшее беспокойство пациентам с острыми респираторными инфекциями (ОРИ) [10, 13]. Этот симптом может существенно нарушать дневную активность и ночной сон, сохраняться дольше других признаков воспаления [8, 10, 13, 16]. По данным литературы, примерно у 20% детей острый кашель на фоне ОРИ принимает затяжной характер [18]. Адекватная терапия кашля для уменьшения его продолжительности и интенсивности имеет целью не только борьбу с симптомом, но и предотвращение осложнений и развития хронических заболеваний респираторной системы. В последнее время наряду с термином «лечение» все чаще используются термины «управление кашлем», «менеджмент кашля», подразумевающие сбалансированное использование средств, подавляющих кашель, и средств, направленных на оптимизацию кашля (в частности, отхаркивающих и муколитических препаратов) [10, 13]. В рамках терапии ОРИ как у детей, так и у взрослых применение нескольких препаратов для лечения кашля может быть ограничено проблемами возможных лекарственных взаимодействий, приверженности назначенной терапии. В связи с этим в повседневной общетерапевтической практике существует потребность в препаратах, которые позволили бы облегчить кашель, сократить его продолжительность и ускорить выздоровление пациента.
Перечисленным критериям соответствует препарат Ренгалин (ООО «НПФ «Материа Медика Холдинг»), содержащий антитела к брадикинину, гистамину и морфину в сверхвысоких разведениях. Препарат является релиз-активным, т.е. обладает особой активностью, высвобождающейся в результате технологической обработки исходных антител, и вызывает конформационные изменения в молекулах-мишенях, против которых данные антитела образованы [11]. Модифицируя функцию опиоидных рецепторов, гистамин-зависимую активацию Н1-рецепторов и брадикинин-зависимую активацию В1-рецепторов, Ренгалин избирательно снижает возбудимость кашлевого центра продолговатого мозга, оказывает противоаллергическое действие, препятствует развитию бронхоспазма, а также ингибирует поток периферической болевой импульсации вследствие уменьшения высвобождения тканевых и плазменных альгогенов (гистамин, брадикинин, простагландины) и взаимодействие их с рецепторами [5].
Эффективность и безопасность препарата Ренгалин доказаны в ряде рандомизированных сравнительных клинических исследований [1, 3, 4, 6, 9]. В частности, показано, что Ренгалин обладает высокой эффективностью в отношении снижения тяжести и продолжительности кашля, потребности в дополнительной симптоматической терапии у взрослых и детей, не уступая наиболее распространенным современным противокашлевым препаратам [1, 3]. Важнейшей составляющей является также факт хорошей переносимости препарата [1, 3, 4, 6, 9].
 Следует отметить, что в рамках изучения лекарственных препаратов, назначаемых при респираторных инфекциях, действуют ограничения клинических исследований с «традиционным» дизайном. Основное из них – терапевтическая интервенция, т.е. вмешательство в клиническую практику врача-исследователя путем регламентирования обследований, процедур и режимов лечения в ограниченных критериями включения и исключения группах пациентов, что сужает возможности оценки эффективности и безопасности в общей популяции. Таким образом, при проведении наблюдательных программ создается возможность максимального приближения к условиям реальной клинической практики. В 2016–2017 гг. на территории РФ была проведена Всероссийская неинтервенционная ретроспективная наблюдательная программа изучения применения РЕнгалина в Амбулаторном Лечении кашля (РЕАЛ), основные результаты которой изложены в настоящей статье.
Следует отметить, что в рамках изучения лекарственных препаратов, назначаемых при респираторных инфекциях, действуют ограничения клинических исследований с «традиционным» дизайном. Основное из них – терапевтическая интервенция, т.е. вмешательство в клиническую практику врача-исследователя путем регламентирования обследований, процедур и режимов лечения в ограниченных критериями включения и исключения группах пациентов, что сужает возможности оценки эффективности и безопасности в общей популяции. Таким образом, при проведении наблюдательных программ создается возможность максимального приближения к условиям реальной клинической практики. В 2016–2017 гг. на территории РФ была проведена Всероссийская неинтервенционная ретроспективная наблюдательная программа изучения применения РЕнгалина в Амбулаторном Лечении кашля (РЕАЛ), основные результаты которой изложены в настоящей статье.
Материалы и методы
Целью программы РЕАЛ являлось изучение практики применения Ренгалина в амбулаторных условиях у пациентов с кашлем при ОРИ. Научную поддержку программы по педиатрии оказывало МОО «Педиатрическое респираторное общество». Программа получила одобрение Независимого междисциплинарного комитета по этической экспертизе клинических исследований.
Дизайн программы предполагал, что данные пациентов, наблюдавшихся у врачей в период с октября по декабрь 2016 г., переносились в индивидуальные регистрационные карты (ИРК), на основании которых в дальнейшем производился статистический анализ. В программу включили 2 возрастные категории пациентов: дети в возрасте от 3 до 18 лет (нижнее возрастное ограничение обусловлено зарегистрированной инструкцией по медицинскому применению) и взрослые пациенты (старше 18 лет) с ОРИ, сопровождающейся кашлем длительностью от 12 ч до 3 сут, которым был назначен препарат Ренгалин. Схема терапии Ренгалином определялась зарегистрированной в России инструкцией по медицинскому применению, выбор других препаратов производился врачом в соответствии с индивидуальным опытом, стандартами и клиническими рекомендациями. ИРК пациентов были предоставлены 681 терапевтом и 778 педиатрами амбулаторных лечебных учреждений. География программы охватывала более половины субъектов РФ.
 Критерии оценки эффективности рассчитывались отдельно для детей и взрослых пациентов и включали продолжительность и динамику тяжести кашля от начала терапии Ренгалином, динамику характера кашля, динамику аускультативных признаков поражения дыхательных путей, частоту и характер побочных эффектов во время применения Ренгалина.
Критерии оценки эффективности рассчитывались отдельно для детей и взрослых пациентов и включали продолжительность и динамику тяжести кашля от начала терапии Ренгалином, динамику характера кашля, динамику аускультативных признаков поражения дыхательных путей, частоту и характер побочных эффектов во время применения Ренгалина.
Длительность кашля оценивалась как разница между датой завершения кашля (по оценке врача) и датой начала терапии в днях. Динамика тяжести кашля оценивалась на основании заполненной врачом шкалы тяжести кашля, адаптированной из Hsu и соавт. [15] (табл. 1).
Аускультативные признаки патологии дыхательных путей регистрировались в ходе физикального обследования по их выраженности по условно принятой шкале в баллах: 0 – везикулярное дыхание, 1 – жесткое дыхание, 2 – единичные сухие хрипы, 3 – диффузные сухие или влажные хрипы. Характер кашля оценивался врачами на основании принятой клинической практики как «сухой», «влажный» или «остаточный». «Остаточным» считался кашель не более 1 балла по шкале тяжести, не нарушающий дневную активность и сон, сохраняющийся после разрешения других симптомов ОРИ. Сроки трансформации различных видов кашля оценивались как длительность периодов кашля определенного характера от первого визита. Так как неинтервенционный ретроспективный дизайн программы предусматривал различные сроки посещения врача, для упрощения интерпретации результатов была принята условная группировка дней по визитам, соответствующая периодам максимально частых посещений: дни терапии со 2-го по 4-й (3±1 день) были объединены в «визит 2», «визит 3» соответствовал 5-му – 7-му дню терапии (6±1 день), посещения врача в дни 8 и далее расценивались как «визит 4».
Данные по частоте и тяжести побочных эффектов были проанализированы на всей популяции исследования (n=34 920), в то время как оценка эффективности и демографических характеристик проводилась на основании результатов, полученных в рамках анализа 779 ИРК, отобранных случайным образом. Для анализа данных применялся набор статистических методов, включая анализ выживаемости (метод Каплана – Майера) для расчета показателей длительности, регрессию Кокса с оценкой функции выживаемости по методу Каплана – Майера с целью установления вероятности сохранения симптома, статистический бутстреп для определения динамики симптомов, а также методы описательной статистики. Средние числовые значения представлены в виде: М±δ (среднее и стандартное отклонение) или M [95% ДИ] (среднее и 95% доверительный интервал). Расчеты производились в программных средах R 3.3.2 и SAS 9.4.
Результаты исследования
Характеристика популяции
Из 779 пациентов, включенных в анализ, 369 (47,4%) составили дети, 340 (43,6%) – взрослые, возраст не был указан у 70 (9,0%) пациентов. Возраст колебался от 3 до 17 лет у детей (в среднем 8,7±4,0 года), от 18 до 83 лет у взрослых (в среднем 41,9±15,3 года). В педиатрическую популяцию вошли 165 (44,7%) девочек, 188 (51,0%) мальчиков, у 16 (4,3%) детей пол не был указан; во взрослую – 206 (60,6%) женщин, 131 (38,5%) мужчина, у 3 (0,9%) пациентов пол не был указан (табл. 2).
Пациенты обращались к врачу на 1–2-й день от начала кашля (средняя продолжительность кашля к моменту обращения составляла 1,3±0,7 дней).

Анализ эффективности
Анализ эффективности проводился по ряду параметров на основании выборки из 779 пациентов. Из данного количества отбирались ИРК, имевшие необходимые для конкретного анализа данные.
Длительность кашля. Из 779 пациентов в анализ длительности кашля вошел 561 пациент, в документацию которого были внесены все необходимые данные для расчета данного показателя. Средняя продолжительность кашля от начала приема Ренгалина составила 7,6 [7,3, 7,8] дня у детей и 6,8 [6,5, 7,1] дня у взрослых.
Тяжесть кашля. Для анализа тяжести кашля были доступны данные 562 пациентов (273 детей и 289 взрослых), в ИРК которых была внесена вся необходимая информация. Средний балл тяжести кашля у детей на первом визите (до лечения, день 0) составил 2,9±0,9 балла, медиана тяжести кашля – 3 балла (на основании доступных данных 273 пациентов). На 3±1 день средний балл тяжести кашля составил 2,2±1,0 балла, медиана тяжести − 2 балла (на основании данных 248 пациентов, совершивших визит в эти дни). К 6±1 дню (n=240) отмечался средний балл тяжести кашля 0,6±0,9 балла, медиана – 0 баллов. На 8-й день и далее среднее значение составило 0,9±1,1 балла, медиана – 0,5 балла (n=152).
У взрослых на 1-м визите (до лечения, день 0) средний балл тяжести кашля, оцениваемый врачом по шкале тяжести, составил 3,0±1,1 балла, медиана – 3 балла (на основании данных 289 пациентов). На 3±1 день данные показатели составили соответственно 1,9±1,0 балл и 2 балла, на 6±1 день – 0,8±1,0 балл и 1 балл. В дни 8 и далее тяжесть кашля составила 0,2±0,5 балла, медиана 0 баллов.
Таким образом, уже к 3-му дню лечения средняя тяжесть кашля у детей снизилась в 1,3 раза, у взрослых – в 1,6 раза. На рис. 1 представлены показатели средней тяжести кашля у детей и взрослых на протяжении программы.
При анализе накопительного процента пациентов с определенным баллом тяжести кашля по дням терапии проводилась оценка процента пациентов с баллами 0–1 по шкале тяжести (отсутствие кашля или единичные покашливания). Если до лечения в педиатрической популяции было отмечено 5,9% (n=16) пациентов с тяжестью кашля 1 балл, то на 3±1 день лечения тяжесть кашля 0–1 баллов была отмечена у 66 (24,2%) детей, на 6±1 день – у 197 (72,2%) детей, на 8-й день и далее – у 269 (98,5%) детей. Лишь у 4 (1,5%) детей кашель сохранялся, и требовалось усиление терапии и/или дополнительные диагностические процедуры.
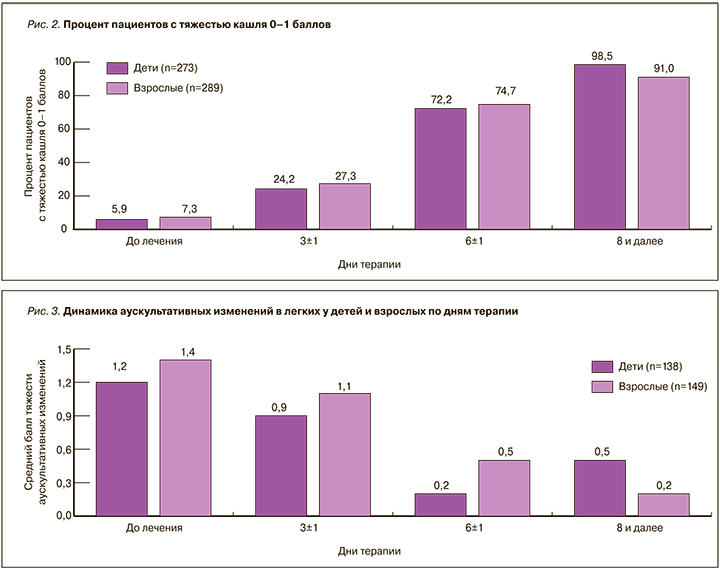
У 21 (7,3%) взрослых пациентов была отмечена тяжесть кашля 1 балл до начала лечения, в дальнейшем тяжесть кашля 0–1 баллов в дни терапии по условно принятым визитам (дни 3±1, 6±1, 8 и далее) регистрировалась у 79 (27,3%), 216 (74,7%) и 263 (91,0%) пациентов соответственно (рис. 2). У 26 (9,0%) пациентов снижения тяжести до 0–1 баллов зарегистрировано не было.
Всего было отмечено 29 (10,6%) детей и 10 (3,5%) взрослых, у которых кашель сохранялся до последнего визита (т.е. врач не отметил дату завершения кашля и регистрировал балл тяжести кашля, отличный от 0). У взрослых пациентов все описанные случаи были ассоциированы с изначально высокой тяжестью кашля (3–4 балла по шкале оценки). Детская популяция была представлена пациентами с изначально высоким баллом тяжести (23 ребенка с исходным баллом тяжести 3–4), пациентами с усилением кашля до уровня 3–4 баллов на визите 2 (n=4), а также пациентами, состояние которых было расценено как выздоровление при сохраняющихся единичных кашлевых эпизодах (n=2).
Аускультативные признаки. Для анализа динамики аускультативных признаков поражения бронхиального дерева были доступны данные 287 пациентов: 138 детей и 149 взрослых. К аускультативным изменениям врачи относили жесткое дыхание, наличие сухих или влажных хрипов над поверхностью легких. Длительность сохранения аускультативных патологических признаков составляла в среднем 6,7 [6,1, 7,2] дня у детей и 7,4 [6,9, 7,9] дня у взрослых.
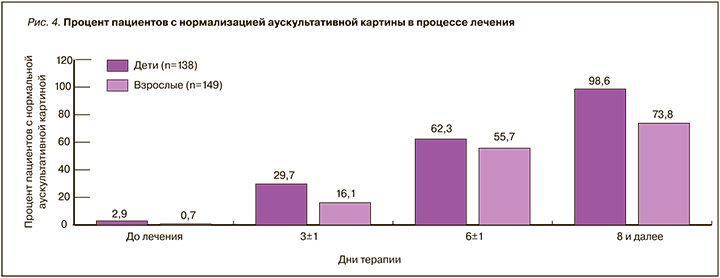
Выраженность аускультативных изменений в легких, оцениваемая в баллах, на 1-м визите составила 1,2±0,5 балла у детей, 1,4±0,5 балла у взрослых. В дни терапии 3±1 у детей этот показатель составил 0,9±0,8 балла, у взрослых – 1,1±0,7 балла, в дни терапии 6±1 – 0,2±0,4 балла и 0,5±0,6 балла соответственно, в дни 8 и далее – 0,5±0,8 балла и 0,2±0,6 балла соответственно (рис. 3).
В детской популяции в 1-й день терапии отмечались какие-либо изменения при аускультации легких у 134 (97,1%), у 4 (2,9%) пациентов выслушивалось везикулярное дыхание. На 3±1 день терапии доля пациентов с везикулярным дыханием составила 29,7% (n=41), на 6±1 день – 62,3% (n=86), на 8-й день и далее – 98,6% (n=136). У 2 (1,5%) детей до конца терапии сохранялось жесткое дыхание.
У 149 взрослых на 1-м визите какие-либо изменения при аускультации выявлялись у 148 (99,3%), везикулярное дыхание регистрировалось в 1 (0,7%) случае. На 3±1 день лечения доля пациентов с нормальной аускультативной картиной составила 16,1% (n=24), на 6±1 день – 55,7% (n=83), на 8-й день и далее – 73,8% (n=110). Аускультативные изменения, представленные в основном жестким дыханием, сохранялись до конца лечения у 39 (26,2%) пациентов. Данные представлены на рис. 4.
Характер кашля. Для анализа характера кашля были доступны данные 273 детей и 289 взрослых пациентов. У детей на 1-м визите сухой кашель отмечался в 204 (74,7%) случаях, кашель с отделением мокроты – в 69 (25,3%). У взрослых сухой кашель регистрировался у 219 (75,8%) пациентов, влажный – у 70 (24,2%) пациентов.
Анализ продолжительности различных фаз кашля показал, что средний срок перехода сухого кашля во влажный составил у детей 3,9 [3,6, 4,2] дня, у взрослых – 4,1 [3,5, 4,6] дня (на основании данных 145 и 85 пациентов соответственно, у которых была зарегистрирована трансформация сухого кашля во влажный). Трансформация влажного кашля в остаточный, которая отмечалась у 205 детей и 146 взрослых, происходила в среднем в сроки 5,8 [5,4, 6,1] и 6,1 [5,7, 6,4] дня соответственно. Сухой кашель трансформировался в остаточный без развития влажного кашля в среднем в сроки 6,2 [5,7, 6,7] дня у детей и 6,2 [5,9, 6,5] дня у взрослых (по данным соответственно 68 и 140 пациентов с зафиксированным переходом сухого кашля в остаточный).
Было рассчитано процентное соотношение пациентов, у которых сухой кашель трансформировался в другие типы или не изменял характера. Так, в детской популяции сухой кашель регистрировался у 204 пациентов до лечения, из них у 136 (66,6%) кашель трансформировался во влажный, у 34 (16,7%) пациентов – в остаточный, у 2 (1,0%) кашель сохранялся до конца лечения без изменения характера и у 32 (14,6%) пациентов купировался, не изменяя характера. Из 219 взрослых пациентов, изначально имеющих сухой кашель, у 76 (34,7%) пациентов регистрировалась трансформация кашля во влажный, у 97 (44,3%) – в остаточный, у 1 (0,5%) кашель не менял характера, сохраняясь до конца лечения, и у 45 (20,5%) сухой кашель исчезал на фоне терапии без изменения характера. Соответственно, можно отметить, что 64,8% взрослых и 31,3% детей в процессе лечения миновали фазу продуктивного кашля.
Сопутствующая антибактериальная терапия. В процессе терапии 53 (6,8%) пациентам, в числе которых были 36 детей и 17 взрослых, были назначены антибактериальные препараты (J01). Наиболее часто в обеих популяциях применялись полусинтетические пенициллины, в том числе в комбинации с ингибиторами бета-лактамаз, макролиды, цефалоспорины. Врачи назначали антибактериальные препараты, исходя из собственного опыта ведения пациентов с ОРИ, с учетом клинических данных пациентов, факторов риска развития бактериальных осложнений, наличия сопутствующих заболеваний.
Безопасность.
В ходе проведения программы безопасность анализировалась у всех включенных пациентов (n=34 920). Среди них было зарегистрировано 107 (0,3%) нежелательных явлений (НЯ). Нежелательные явления со стороны органов дыхания и пищеварения (по 27 случаев, «редкие» по классификации ВОЗ, 25,2% в структуре выявленных НЯ), по мнению врачей, в большинстве были связаны с характером течения ОРИ: усиление кашля (n=18), повышенное отделение мокроты (n=5), а также тошнота (n=10), диарея (n=4), диспепсия (n=4). С меньшей частотой отмечались болезни кожи и подкожной клетчатки (в том числе аллергический дерматит – 6, сыпь – 3, крапивница –5 и системы кровообращения – по 16 случаев, «редкие» по классификации ВОЗ, 15,0% в структуре выявленных НЯ). Реже регистрировались общие расстройства (лихорадка, слабость) в процессе заболевания, обусловленные течением ОРИ (n=9, 8,4% в структуре выявленных НЯ, «редкие» по классификации ВОЗ), лабораторные отклонения (n=6, «редкие» по классификации ВОЗ, 5,6% в структуре выявленных НЯ), болезни нервной системы, болезни крови и лимфатической системы, инфекционные заболевания были зарегистрированы с равной частотой (по 3 случая, «очень редкие» по классификации ВОЗ, 2,8% в структуре НЯ). В единичных случаях регистрировались хирургические процедуры (n=2, «очень редкие» по классификации ВОЗ, 1,9% в структуре НЯ), болезни глаза и нарушения поведения (по 1 случаю, «очень редкие» по классификации ВОЗ, 0,9% в структуре НЯ). Серьезных НЯ за период исследования выявлено не было. По оценке исследователей ни одно из зарегистрированных НЯ не имело связи с применением препарата Ренгалин. Данных о том, что какое-либо НЯ потребовало отмены терапии Ренгалином, получено не было.
Обсуждение
На территории РФ была проведена крупномасштабная неинтервенционная ретроспективная наблюдательная программа изучения применения РЕнгалина в Амбулаторном Лечении кашля (РЕАЛ), позволившая получить обширные данные о существующей практике применения препарата Ренгалин для лечения кашля при ОРИ у детей и взрослых. В программе участвовали 34 920 пациентов (детей и взрослых) с диагнозом ОРИ, сопровождающейся кашлем длительностью не более 3 сут до момента обращения к врачу, которым был назначен препарат Ренгалин в виде монотерапии или в составе комплексной терапии, определяемой врачом. Средний возраст пациентов в педиатрической популяции составил 8,7±4,0 года, в популяции взрослых – 41,9±15,3 года.
Средняя продолжительность кашля от начала приема Ренгалина составила 7,6 [7,3, 7,8] дня у детей и 6,8 [6,5, 7,1] дня у взрослых. Большей длительности кашлевого периода в детском возрасте могут способствовать анатомо-физиологические особенности респираторной системы у детей: повышенная способность к гиперсекреции вязкой слизи, недостаточная эффективность мукоцилиарного транспорта, недостаточность факторов местной иммунной защиты, неадекватный кашлевой дренаж, функциональная незрелость дыхательных мышц [8]. По данным отечественных и зарубежных исследователей, кашель на фоне ОРИ в детском возрасте имеет среднюю продолжительность от 1 до 3 нед [7, 14, 17, 19]. Так, по данным крупного метаанализа M. Thompson и соавт., посвященного изучению длительности симптомов ОРВИ у детей, медиана продолжительности кашля в исследованиях составляла от 7,3 дня при неосложненном остром кашле до 15 дней при бронхиолите [17]. В целом на продолжительность кашля при ОРИ оказывают влияние этиология основного заболевания (затяжной кашель часто встречается при инфекциях, вызванных микоплазмами и хламидиями, при коклюше, РС-вирусной инфекции), иммунный статус пациента, наличие сопутствующей патологии (в том числе аллергической) [11, 18].
Тяжесть кашля, оцениваемая по соответствующей шкале, на момент обращения к врачу у детей составила 2,9±1,9 балла, у взрослых – 3,0±1,1 балла. Уже на 3±1 день лечения средняя тяжесть кашля снижалась в 1,3 раза у детей и в 1,6 раза у взрослых, а процент пациентов с кашлем минимальной интенсивности составил 24,2 и 27,3% соответственно. В литературе описаны сроки разрешения кашля у детей: у 7–17% к 3-му дню лечения на фоне различных вариантов терапии (M. Thompson и соавт., 2013), у 13,3% на 4±1 день терапии фенспиридом (Н.А. Геппе и соавт., 2005) [2, 18]. Можно предположить, что полученная в настоящей программе сравнительно быстрая положительная динамика тяжести кашля является следствием комбинированного механизма действия препарата Ренгалин, включающего в том числе противокашлевой компонент.
Динамика аускультативной картины у взрослых и детей демонстрировала аналогичные изменения. Уже через сутки лечения у части пациентов как в детской, так и во взрослой популяциях было отмечено исчезновение патологических аускультативных феноменов. На 3±1 день лечения таких пациентов было 29,7% в педиатрической популяции и 16,1% среди взрослых. У части взрослых пациентов сохранялись аускультативные изменения (жесткое дыхание) на всем протяжении наблюдения, в том числе после исчезновения кашля. Для оценки полученной динамики аускультативной картины был проведен поиск сходных данных литературы. Так, в исследовании Г.Л. Игнатовой и соавт. было показано, что средний процент пациентов с аускультативными изменениями на фоне ОРИ составляет 86% на 4±1 день лечения фенспиридом [4]. По результатам настоящей программы, к 4-му дню лечения изменения при аускультации определялись у 70,3% детей и 83,9% взрослых. Таким образом, при сопоставлении с другими схемами лечения ОРИ, в том числе содержащими противовоспалительные препараты, можно расценивать наблюдаемую тенденцию разрешения аускультативных изменений в легких как благоприятную, что может быть следствием бронхолитического и противовоспалительного действий Ренгалина.
При анализе характера кашля, как у детей, так и у взрослых в 1-й день лечения примерно четверть случаев приходилась на влажный кашель, у остальных пациентов регистрировался сухой кашель. Это соотношение принципиально изменялось уже на 3±1 день, когда в половине случаев развивался влажный кашель, у части пациентов отмечался остаточный кашель. В обеих популяциях средние сроки перехода сухого кашля в остаточный соответствовали 4-му дню, сухого или влажного кашля в остаточный – 6-му дню. В процессе лечения сухой кашель подвергался обратному развитию (включая фазу остаточного кашля или без нее), минуя фазу продуктивного кашля, у 64,8% взрослых пациентов и 31,3% детей. Трансформация сухого кашля во влажный имеет клиническое значение преимущественно в педиатрической практике как показатель адекватной реализации воспалительного ответа [8]. У взрослых за счет менее выраженного экссудативного компонента воспаления в большей степени может быть значимой быстрая трансформация кашля в остаточный, в том числе без развития фазы влажного кашля, что может свидетельствовать о более легком течении ОРИ [10]. Выявленная динамика соотношения сухого, влажного и остаточного кашля на различных стадиях инфекционного процесса демонстрирует эффекты Ренгалина, обусловленные различными его компонентами.
В процессе проведения программы 6,8% пациентов врачи назначали антибактериальные препараты по показаниям, связанными с характером течения основного заболевания или наличием сопутствующей патологии. Выявленная потребность в антибактериальной терапии у пациентов, принимавших Ренгалин, сопоставима с таковой в исследованиях схожего дизайна. Так, на фоне приема фенспирида потребность в антибиотиках была отмечена у 6,6% пациентов, на фоне стандартной терапии ОРИ – у 13,4% [2]. Такие данные позволяют говорить о снижении потребности в антибактериальной терапии при лечении ОРИ препаратами с противовоспалительным действием.
У пациентов, принимавших Ренгалин, НЯ регистрировались в 0,3% случаев. Самыми частыми были НЯ со стороны дыхательной системы (по оценкам врача, предположительно связанные с естественным течением основного заболевания: усиление кашля, повышенное отделение мокроты), пищеварительной системы (тошнота, диарея), кожи и подкожной клетчатки (в том числе аллергический дерматит, сыпь, крапивница). В соответствии с классификацией ВОЗ отмеченные НЯ относились к категории редких или очень редких, что свидетельствует о благоприятной переносимости препарата.
Заключение
По итогам проведенной Всероссийской неинтервенционной ретроспективной наблюдательной программы изучения применения комплексного противокашлевого препарата РЕнгалин в Амбулаторном Лечении кашля (РЕАЛ) было показано, что у большинства пациентов с ОРИ отмечается положительная динамика тяжести кашля в среднем с 3-го дня лечения. В эти же сроки как у детей, так и у взрослых наблюдается улучшение аускультативной картины поражения бронхиального дерева. Применение Ренгалина у детей способствует трансформации сухого кашля во влажный. У большинства взрослых в процессе лечения отмечается трансформация сухого кашля в остаточный или его купирование без развития продуктивного кашля. Терапия Ренгалином в условиях повседневной клинической практики амбулаторного врача хорошо переносится пациентами как взрослого, так и детского возраста. Таким образом, результаты, полученные в наблюдательной программе, подтверждают целесообразность применения релиз-активного препарата Ренгалин в условиях повседневной клинической практики для лечения кашля у взрослых и детей с 3 лет.



