В настоящее время эндоваскулярные методы лечения (чрескожное коронарное вмешательство, в том числе со стентированием) являются ведущими в лечении острого коронарного синдрома (ОКС), что позволяет значительно улучшить исходы [1]. Однако увеличение частоты использования селективной коронарографии (СКГ) и чрескожного коронарного вмешательства (ЧКВ) сопровождалось и увеличением случаев контраст-индуцированной нефропатии (КИН) [2]. По данным ряда авторов, ее частота варьируется от 1–3 до 19–20% и более [3].
КИН диагностируют согласно рекомендациям KDIGO (2012) по острому повреждению почек (ОПП) [4, 5].
Известно, что определение сывороточного креатинина (сКр), служащего диагностическим критерием ОПП, имеет ряд ограничений; в частности, сКр повышается на фоне уже развившегося повреждения. Это привело к поиску новых биомаркеров ОПП, диагностические и прогностические возможности которых превосходят сКр: липокалина, ассоциированного с желатиназой нейтрофилов (NGAL), цистатина С (Cys C), молекулы повреждения почек – 1 (KIM-1), интерлейкина-18 (ИЛ-18), белка, связывающего печеночные жирные кислоты L типа (L-FABP) [6]. Наиболее изученным биомаркером ОПП является NGAL [7, 8].
Цель исследования – оценить возможность использования NGAL в качестве биомаркера КИН у больных ОКС.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 113 больных ОКС (81 мужчина и 32 женщины, средний возраст 59,5±9,6 года) с подъемом сегмента ST (ОКСпST) у 58 (52,3%) и без подъема сегмента ST (ОКСбпST) у 53 (47,7%) пациентов. У 30 (26,5%) участников в период госпитализации диагностировали нестабильную стенокардию, у 83 (73,5%) – инфаркт миокарда (ИМ), в том числе ИМ с подъемом сегмента ST у 59 (71,1%) и без подъема сегмента ST у 24 (28,9%) больных.
Диагноз «ИМ и нестабильная стенокардия» устанавливали в соответствии с Национальными рекомендациями. Обследование и лечение больных проводили согласно действующим рекомендациям и стандартам.
Диагностику ОПП, в том числе КИН, осуществляли по действующим рекомендациям [4, 5, 7]. При этом ОПП по уровню сывороточного креатинина (сКр) диагностировали следующим образом:
- с помощью базального (расчетного) сКр, соответствующего скорости клубочковой фильтрации (СКФ) 75 мл/мин/1,73 м2, и сравнивали его с сКр при поступлении (сКр1). У подавляющего большинства пациентов данные об уровне сКр в течение последних 7 дней отсутствовали, потому для диагностики ОПП использовали базальный сКр;
- за исходный принимали сКр в момент госпитализации с дальнейшей его оценкой в динамике через 24–72 ч (сКр2).
Риск развития КИН при СКГ и/или ЧКВ оценивали по шкале R. Mehran и соавт. (2004) в модификации B.J. Barrett, P.S. Parfrey (2006) [9, 10].
СКГ проводили на цифровом ангиографическом комплексе в комплекте со столом и инъектором Innova 3 100 IQ (GE Medical Systems, 2011) в рентгенохирургическом отделении ГКБ № 5 по методике Judkin (феморальный доступ). Анализ данных СКГ проводили в соответствии с Европейскими рекомендациями по реваскуляризации миокарда (2014) [1]. Гемодинамически значимым стенозом (ГЗС) коронарной артерии (КА) считали стеноз более 50%. Осложнений при проведении СКГ и ЧКВ не отмечено.
СКГ в период госпитализации (в среднем на 5-е сутки) была выполнена у 59 (52,2%) из 113 больных ОКС: 44 (74,6%) пациентам в остром, 15 (25,4%) в подостром периоде ИМ и нестабильной стенокардии. При выполнении СКГ и ЧКВ использовали контрастные вещества (в объеме от 50 до 250 мл): йогексол – у 46 (78,0%), йодиксанол – у 6 (10,2%), йопромид – у 6 (10,2%), йопамидол – у 1 (1,6%) пациента. При этом 39 (66,1%) больным было проведено ЧКВ (коронарная баллонная ангиопластика и/или стентирование) [28] (71,8%) в остром, а 11 (28,2%) – в подостром периоде; среднее число использованных стентов – 1,7±0,43; 10 (16,9%) пациентам рекомендовано проведение коронарного шунтирования (КШ). Первичное ЧКВ выполнено лишь у 3 (5,1%) пациентов с ОКСпST.
 У всех пациентов на 1–3-й день госпитализации определяли содержание s-NGAL и u-NGAL (нг/мл) иммуноферментным методом (Human Lipocalin-2/NGAL Quantikine ELISA, R&D Systems, США). В эти же сроки в крови определяли концентрацию сКр. Уровни отсечения (верхние границы референсных значений), указанные в инструкции фирмой производителем реактивов, для s-NGAL и u-NGAL составляли 177 и 72 нг/мл соответственно; нормальное содержание сКр составляло у мужчин 64–104, у женщин 49–90 мкмоль/л.
У всех пациентов на 1–3-й день госпитализации определяли содержание s-NGAL и u-NGAL (нг/мл) иммуноферментным методом (Human Lipocalin-2/NGAL Quantikine ELISA, R&D Systems, США). В эти же сроки в крови определяли концентрацию сКр. Уровни отсечения (верхние границы референсных значений), указанные в инструкции фирмой производителем реактивов, для s-NGAL и u-NGAL составляли 177 и 72 нг/мл соответственно; нормальное содержание сКр составляло у мужчин 64–104, у женщин 49–90 мкмоль/л.
В исследование не включали лиц старше 75 лет, а также имеющих тяжелую сопутствующую патологию.
Статистический анализ полученных результатов проводили с использованием специализированного пакета прикладных программ Statistica v. 10.0 (StatSoft. Ins., 2011). При приближенно нормальном распределении данные представлены в виде среднего арифметического (М) и стандартного отклонения (±SD). При распределении, отличном от нормального, результаты представлены в виде медианы (Ме) и квартилей (Р25; Р75 ), в процентах. Для сравнения количественных данных использовали U-тест Манна–Уитни. Для сравнения качественных данных использовали точный критерий Фишера. Оценку силы связи между признаками проводили с помощью рангового коэффициента корреляции (τ) тау Кендалла. Различия считали статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ
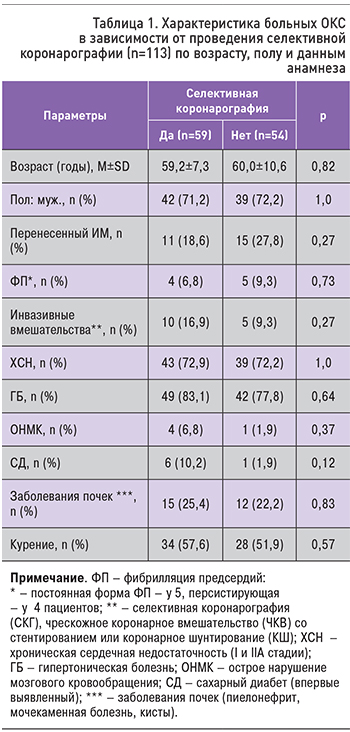
Характеристика больных ОКС, в зависимости от проведения (да/нет) СКГ (n=113) по возрасту, полу и данным анамнеза, представлена в табл. 1.
Больные ОКС были сопоставимы по возрасту, полу и данным анамнеза.
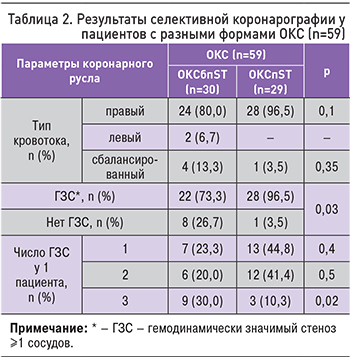
Проведен сравнительный анализ результатов СКГ у пациентов с разными формами ОКС (табл. 2).
При ОКСпST по сравнению с ОКСбпST достоверно чаще выявляли ГЗС коронарных артерий. Однако при ОКСбпST чаще диагностировали трехсосудистое поражение коронарного русла.
24 (58,5%) из 59 больных ИМпST СКГ проведена после тромболитической терапии (на 1,14±0,62 сут). При этом 21 (51,2%) пациенту (19 в остром, 2 в подостром периоде) в день проведения СКГ выполнено ЧКВ, а 3 (7,3%) рекомендовано проведение КШ в плановом порядке.
Риск развития КИН у больных ОКС (n=59) при СКГ и/или ЧКВ по шкале R. Mehran составил: низкий у 23 (39%), средний у 33 (55,9%), высокий у 3 (5,1%) пациентов. Следует отметить, что среди 3 пациентов с высоким риском развития КИН у 2 диагностировано ОПП (у одного в дальнейшем развилась КИН). При этом у всех больных с высоким риском развития КИН течение ОКС осложнилось развитием различных кардиоваскулярных осложнений.
 ОПП (1-я стадия) было диагностировано у 11 (9,7%) больных ОКС (у 7 – по базальному сКр, у 4 – по динамике сКр). Отмечена тенденция к более высоким значениям s-NGAL и u-NGAL у пациентов с ОКС и развитием ОПП (n=11) [422,04 (166,82–768,92) и 21,8 (2,31–64,74) соответственно] по сравнению с больными без ОПП (n=102) [194,61 (133,15–338,35) и 3,9 (1,8–8,6); р=0,06 и р=0,09 соответственно].
ОПП (1-я стадия) было диагностировано у 11 (9,7%) больных ОКС (у 7 – по базальному сКр, у 4 – по динамике сКр). Отмечена тенденция к более высоким значениям s-NGAL и u-NGAL у пациентов с ОКС и развитием ОПП (n=11) [422,04 (166,82–768,92) и 21,8 (2,31–64,74) соответственно] по сравнению с больными без ОПП (n=102) [194,61 (133,15–338,35) и 3,9 (1,8–8,6); р=0,06 и р=0,09 соответственно].
Выявлены положительные корреляции риска развития КИН (баллы) с возрастом (τ=0,28; р=0,03), женским полом (τ=0,32; р <0,001), величиной баллов по шкале GRACE (τ=0,28; р=0,04) и отрицательная – со СКФ (по формуле CKD-EPI) (τ=-0,5; р <0,001).
Только у 1 пациента из 11 ОПП было верифицировано как КИН.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Больной К., 47 лет, находился на стационарном лечении с 25.04 по 15.05.2013. Доставлен в стационар экстренно с клиникой ОКСбпST (через 10 ч от начала затяжного ангинозного приступа) на фоне повышения артериального давления (АД) до 180/120 мм рт.ст. (в анамнезе ГБ). Характеристика пациента при поступлении: состояние тяжелое, кожные покровы обычной окраски, чистые, влажные. В легких дыхание везикулярное, хрипов нет, частота дыхания 20 в минуту. Тоны сердца приглушены ритмичные, частота сердечных сокращений 68 уд./мин, АД – 170/120 мм рт.ст. На электрокардиограмме (ЭКГ) – элевация сегмента ST в II, III, aVF, V3,4 на 1 мм; отрицательный зубец Т в II, aVF, V5,6 на 2–3 мм; политопная желудочковая экстрасистолия. Тропонин I – 0,28 нг/мл (норма до 0,1 нг/мл); КФК-МВ (креатинфосфокиназа-МВ) – 3,48 нг/мл (норма 0,97–4,94 нг/мл), сКр – 95,1 мкмоль/л. Лечение проводили в соответствии с действующими рекомендациями. По шкале GRACE при поступлении определен низкий риск смерти и/или повторного ИМ в госпитальном периоде (101 балл). Уровень s-NGAL составил 249,0 нг/мл, u-NGAL – 96,53 нг/мл. При эхокардиографии (проведена в 1-е сутки) выявлен гипокинез задних, заднебоковых сегментов на уровне базальной и средней третей, фракция выброса – 51%. Таким образом, у больного диагностирован острый заднебоковой верхушечный с переходом на перегородку не-Q ИМ.
В динамике болевой синдром рецидивировал при обычных физических нагрузках, возрастала потребность в коротко действующих нитратах. В анализах: КФК-МВ – 30 Ед./л (норма до 25 Ед./л). На ЭКГ в динамике: сегмент ST в отведениях II, III, aVF, V3,4 на изолинии, появление отрицательного зубца Т в отведениях III, V3,4; увеличилась глубина отрицательного зубца Т в отведениях II, V5,6 (на 2–4 мм), что свидетельствовало о развитии ранней постинфарктной стенокардии и являлось показанием для проведения СКГ.
Риск КИН по шкале R. Mehran был средним (10,5 балла); 07.05.2013 проведена СКГ. Выявлены признаки двухсосудистого органического поражения КА. Выполнено ЧКВ со стентированием передней нисходящей артерии. При проведении СКГ и ЧКВ использовали йогексол в объеме 150 мл. Профилактику КИН до и после СКГ и ЧКВ не проводили.
Динамика уровня сКр до проведения ЧКВ и после нее была следующей: 95,1 (25.04.13), 201,6 (07.05.2013), после СКГ и ЧКВ – 246,3 (08.05.2013), 192,1 (13.05.2013) мкмоль/л.
Таким образом, у больного через сутки после проведения ЧКВ развилась КИН. Уровни s-NGAL и u-NGAL при поступлении (25.04.2013) у пациента были выше референсных значений, что указывает на прогностическую значимость NGAL в отношении риска развития КИН.
ОБСУЖДЕНИЕ
КИН – серьезное осложнение СКГ и ЧКВ. В отечественных рекомендациях для диагностики КИН рекомендуется использовать критерии KDIGO (2012) [4]. Однако ввиду существующих ограничений диагностических возможностей критериев ОПП (сКр и диурез) до сих пор сохраняются сложности при проведении доклинической диагностики и профилактики ОПП в клинической практике [6–8]. По данным литературы, наиболее изученными биомаркерами ОПП/КИН служат NGAL, Cys C, KIM-1, ИЛ-18, L-FABP. Некоторые исследователи отмечают, что повышенные уровни u-NGAL через 24 и 48 ч после СКГ или ЧКВ могут быть использованы в качестве надежного маркера ранней диагностики КИН [11]. Так, при сравнении ряда биомаркеров в моче в отношении диагностики КИН у пациентов с ОКС после СКГ величина площади под кривой (AUC) для KIM-1, NGAL, ИЛ-18 и L-FABP составила соответственно 0,713; 0,958; 0,72 и 0,642, т.е. статистические показатели диагностической значимости u-NGAL в отношении КИН превосходили другие исследуемые биомаркеры [7, 12]. При этом статистические параметры NGAL в крови (AUC=0,73) в диагностике КИН несколько уступали NGAL в моче [10]. Уровень u-NGAL более 94,4 нг/ мг через 2 ч после ЧКВ был значимым предиктором развития КИН (чувствительность 74%, специфичность 82%) [13]. Результаты метаанализа (n=1520, 14 исследований) также показывают, что уровни NGAL в моче и сыворотке/плазме, определенные в течение 4 ч после использования контраста, являются перспективными биомаркерами для раннего выявления КИН после СКГ или ЧКВ [14].
В то же время результаты ряда исследований указывают на неоднозначность роли NGAL для диагностики КИН. Так, в небольшой работе диагностическая и прогностическая роль NGAL как в крови, так и в моче не подтвердилась [15]. В исследовании ANTI-CI-AKI (2017) также не установлено предикторной значимости u-NGAL в отношении КИН у больных ХБП [16].
ПРОФИЛАКТИКА КИН
Для предупреждения развития КИН перед проведением СКГ следует обязательно оценить факторы риска ее развития. Наличие модифицируемых факторов риска необходимо своевременно устранить. При наличии немодифицируемых факторов риска используют фармакологические методы профилактики.
Профилактика КИН осуществляется и при выборе рентгеноконтрастного препарата (РКП). Безопаснее йодосодержащие РКП (не гадолинийсодержащие), водорастворимые, неионные, низко-/изоосмолярные. Риск развития КИН ниже при использовании минимального количества РКП и непродолжительной экспозиции [17].
C.M. Erley и соавт. (1994) обсуждали клинические преимущества теофиллина в профилактике КИН [18]. J. Matejka и соавт. (2010) не обнаружили защитного действия теофиллина на функцию почек [19]. В настоящее время не рекомендуется использовать метилксантины для профилактики КИН [5].
Наиболее простым и эффективным методом профилактики является адекватная гидратация. В отечественных рекомендациях у больных с высоким риском КИН предлагается проведение внутривенной гидратации 0,9% раствором хлорида натрия (NaCl) со скоростью 1,0–1,5 мл/кг/ч в течение 6–12 ч до и после рентгеноконтрастного исследования, в то время как у пациентов с низким риском КИН следует использовать пероральный путь гидратации [5]. В этом плане интересно исследование AMACING (2017), включавшее пациентов (n=660) со СКФ 30–59 мл/мин/1,73 м2, которым выполняли рентгеноконтрастное исследование. Больные были рандомизированы в соотношении 1:1 для получения внутривенно 0,9% раствора NaCl или отсутствия ее введения перед процедурой. КИН диагностировали по повышению уровня сКр более чем на 25% или на 44 ммоль/л в течение 2–6 дней после введения контрастного вещества. КИН развилась у 2,7% пациентов, получавших профилактически солевой раствор по сравнению с 2,6% лиц, которым раствор не вводили. Кроме этого, лица, получившие профилактическую гидратационную терапию, дольше находились в стационаре. Таким образом, по результатам исследования AMACING не получено преимуществ профилактической гидратационной терапии в отношении частоты развития КИН по сравнению с лицами, которым ее не назначали [20].
Для профилактики развития КИН при ее высоком риске назначают инфузию 1,26% раствора бикарбоната натрия (со скоростью 3 мл/кг/ч за 1 ч до и 1 мл/кг/ч в течение 6 ч после процедуры), а при низком риске КИН – пероральный прием N-ацетилцистеина (600 мг 2 раза/сут) до и в день СКГ или же внутривенное введение этого лекарственного средства в дозе 150 мг/кг за 30 мин до исследования и 50 мг/кг в течение 4 ч после него [5]. Однако результаты исследования PRESERVE (2017) не подтверждают положительных эффектов применения указанных препаратов. Это исследование включало почти 5000 пациентов высокого риска развития КИН: 2511 пациентов были рандомизированы на применение внутривенного 1,26% раствора бикарбоната натрия и 2482 – на внутривенное введение 0,9% раствора NaCl. Каждая группа также получала капсулы N-ацетилцистеина по 1200 мг 2 раза/сут в течение 5 дней (n=2495) либо плацебо (n=2498). Исследование было досрочно прекращено, поскольку при предварительном промежуточном анализе не было получено каких-либо существенных преимуществ ни от одного из исследуемых агентов в отношении как первичной (смерть, потребность в диализе или увеличение сКр по сравнению с исходным уровнем, по меньшей мере на 50% в течение 90 дней после ангиографии), так и вторичной (КИН и стойкое нарушение функции почек до 90 дней) конечных точек [21].
В ряде исследований показан положительный профилактический эффект краткосрочного использования аторвастатина в дозе 80 мг за 12 ч до СКГ и в дозе 40 мг после нее [22].
ЗАКЛЮЧЕНИЕ
- Частота ОПП и КИН, в частности, в исследуемой выборке, составила 9,7 и 1,7%.
- Уровни (Ме) s-NGAL u-NGAL были выше референсных значений у лиц с ОПП и КИН в 2,4 и 1,3 раза.
- Профилактика КИН по-прежнему дискутабельный вопрос. Исследование PRESERVE показало правильность стандартной тактики с внутривенным введением NaCl в отношении профилактики контраст-ассоциированного ОПП и неблагоприятных исходов. Также высказывались мнения о необходимости разработки либо новых контрастных препаратов, не влияющих на функцию почек, либо новых способов профилактики и лечения ОПП при использовании обычных йодсодержащих контрастных веществ.



