При артериальной гипертензии (АГ) основная роль эхокардиографии (ЭхоКГ) заключается в оценке массы миокарда (ММ) и диастолической функции левого желудочка (ДФЛЖ). Определение взаимосвязи между ММЛЖ и АГ сопряжено с определенными трудностями, поскольку на величину ММЛЖ оказывают влияние возраст, конституциональные особенности телосложения, наследственные и этнические факторы, наличие ожирения, сахарного диабета и многие другие факторы [1]. При АГ выявление гипертрофии ЛЖ важно, так как она служит основной причиной нарушения ДФ, дилатации левого предсердия и развития «гипертонического сердца» [2]. ГЛЖ и тип ремоделирования являются независимыми предикторами сердечно-сосудистой и общей смертности [3, 4]. Помимо определения ММЛЖ, оценка ДФ дает дополнительную информацию о прогнозе больных при АГ и хронической сердечной недостаточности (ХСН) независимо от фракции выброса (ФВ) ЛЖ [5]. Известно, что функциональные показатели ЛЖ зависят от цифр артериального давления (АД), следовательно, нарушение ДФ возможно и без гипертрофии миокарда.
Целью данного исследования стала оценка функционального состояния ЛЖ у больных с неконтролиремой АГ в зависимости от наличия или отсутствия гипертрофии ЛЖ.
МАТЕРИАЛ И МЕТОДЫ
Были обследованы 157 больных с АГ: 97 (61,8%) женщин и 60 (38,2%) мужчин. Средний возраст участников исследования составил 53,4±8,1 лет, средняя длительность АГ – 8 (4,5–10) лет. На момент включения, по данным офисного АД, АГ 1 степени имели 29 (18,5%) пациентов, АГ 2 степени – 80 (50,1%), АГ 3 степени – 48 (30,6%). Курили 38 (24,2%) больных, дислипидемия была выявлена у 59 (37,6%), сахарный диабет – у 12 (7,6%), ожирение – у 49 (31,2%) пациентов. Отягощенную наследственность по сердечно-сосудистым заболеваниям имели 98 (62,4%) обследуемых.
Контрольную группу составили 35 сопоставимых по возрасту и полу практически здоровых лиц (средний возраст 52,4±6,9 лет): 21 (60,0%) женщина и 14 (40,0%) мужчин с нормальными показателями АД в офисе (систолическое АД 121,3±5,4 мм рт. ст. и диастолическое АД 78,1±3,9 мм рт.ст.) и нормальным суточным профилем АД по данным суточного мониторирования АД (СМАД).
Критериями невключения в исследование были наличие инфаркта миокарда в анамнезе, значимой клапанной патологии, в том числе митральной недостаточности умеренной или тяжелой степени, выраженного кальциноза митрального кольца, фибрилляции предсердий.
Всем больным проводили электрокардиографию (ЭКГ), СМАД, ЭхоКГ на ультразвуковом приборе Vivid 7 (GE Healthcare). Двухмерную ЭхоКГ, допплер-ЭхоКГ трансмитрального и транстрикуспидального кровотоков, фиброзного кольца митрального клапана в режиме тканевой допплерографии проводили в соответствии с рекомендациями по количественной оценке структуры и функции камер сердца, ДФ [6, 7]. Рассчитывали ММЛЖ, показатели внутрисердечной гемодинамики и ДФЛЖ.
Статистическая обработка данных проводилась с помощью пакета программ Statistica 10. При выборе метода сравнения данных учитывалась нормальность распределения признака в подгруппах с учетом критерия Шапиро–Уилка. В случае отклонения распределения от нормального при описании использовались медиана, а также 25 и 75% процентили, а при нормальном распределении – среднее значение и стандартное отклонение. При множественных сравнениях использовался критерий Краскелла–Уоллиса с последующим применением скорректированного критерия Манна–Уитни или непарного t-критерия. При сравнении зависимых групп использовался критерий Вилкоксона или парный t-критерий. Взаимосвязь между двумя признаками оценивалась с помощью рангового коэффициента корреляции Спирмана.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из 157 больных АГ развитие гипертрофии ЛЖ было выявлено у 129 (82,2%); лишь у 28 (17,8%) пациентов индексированная ММЛЖ была в пределах нормативных значений. Индексированная ММЛЖ у больных без гипертрофии ЛЖ составила 90,2 (86,0; 94,9) против 122,2 (110; 139) г/м2 в группе больных с гипертрофией ЛЖ.
АГ 1 степени имела место у 14 (50,0%) больных без гипертрофии ЛЖ против 15 (11,6%) в группе с гипертрофией ЛЖ (р=0,03). АГ 2 степени была выявлена у 9 (32,1%) больных без гипертрофии ЛЖ и у 71 (55,0%) больного с гипертрофией ЛЖ (p >0,05), распространенность 3 степени АГ составила соответственно 5 (17,9%) против 43 (33,3%) (р=0,009).
Не было установлено достоверного влияния на развитие гипертрофии ЛЖ пола и возраста пациентов, тогда как отсутствие гипертрофии ЛЖ ассоциировалось с более низкими значениями АД по данным СМАД. Корреляционный анализ между индексированной ММЛЖ и цифрами офисного АД не выявил достоверных взаимосвязей. Это свидетельствует о том, что офисное АД – не лучший предиктор развития гипертрофии ЛЖ. По сравнению с ним показатели СМАД и домашнего мониторирования АД (ДМАД) являются лучшими предикторами поражения органов, в частности, развития ГЛЖ [8].
При анализе корреляционных взаимосвязей между индексированной ММЛЖ и показателями СМАД были обнаружены следующие особенности:
- индексированная ММЛЖ достоверно коррелировала со всеми показателями СМАД, за исключением пульсового АД;
- наиболее тесная корреляционная взаимосвязь выявлена с максимальными величинами систолического АД за день (r=0,40; p=0,0001) и сутки (r=0,40; p=0,0001), средними покзателями диастолического АД за день (r=0,40; p=0,0001), нагрузкой систолического (r=0,40; p=0,0001) и диастолического АД (r=0,40; p=0,0001) ночью.
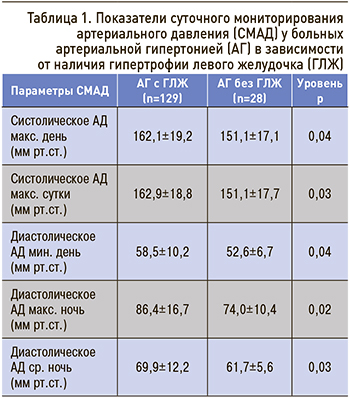 По результатам нашего исследования, максимальное влияние на индексированный показатель ММЛЖ оказывает дневная нагрузка диастолического АД (r=0,45; p=0,0001). Средние показатели систолического АД и диастолического АД, которые оказывали достоверное влияние на развитие гипертрофии ЛЖ, представлены в таблице 1.
По результатам нашего исследования, максимальное влияние на индексированный показатель ММЛЖ оказывает дневная нагрузка диастолического АД (r=0,45; p=0,0001). Средние показатели систолического АД и диастолического АД, которые оказывали достоверное влияние на развитие гипертрофии ЛЖ, представлены в таблице 1.
Таким образом, СМАД является лучшим предиктором развития гипертрофии ЛЖ, чем офисное АД. По данным СМАД, с гипертрофией ЛЖ в равной степени ассоциируются систолическое и диастолическое АД в течение суток.
Известно, что при АГ гемодинамическая нагрузка влияет на показатели систолической и диастолической функции ЛЖ. Так, по сравнению с контрольной группой отсутствие гипертрофии ЛЖ сопровождается достоверным уменьшением объемных показателей ЛЖ, включая ударный объем (табл. 2). Это связано с тем, что уровень АД во многом определяет характер ремоделирования ЛЖ. Отсутствие гипертрофии ЛЖ было связано с более низкими значениями АД, хотя у 10 (35,7%) больных повышение постнагрузки способствовало развитию концентрического ремоделирования как компенсаторного механизма на повышение напряжения стенки ЛЖ.
Согласно данным, полученным в исследовании The LIFE Study [9], на концентрическое ремоделирование ЛЖ в большей степени влияет жесткость артерий. Было установлено, что при сопоставимых цифрах АД сосудистая жесткость у больных с концентрическим ремоделированием на 47% выше, чем в контрольной группе, и на 15% выше, чем в группе с эксцентрической гипертрофией ЛЖ. В нашем исследовании мы не оценивали жесткость сосудов, однако сохранение у 18 (64,3%) больных нормальной геометрии ЛЖ и развитие концентрического ремоделирования у 36% при сопоставимых показателях АД свидетельствует о наличии других факторов, определяющих фенотип ремоделирования ЛЖ. Между индексом относительной толщины стенки ЛЖ и ударным объемом существует обратная взаимосвязь, поэтому у больных без гипертрофии ЛЖ наблюдалось уменьшение объемных показателей ЛЖ. Прогностическое значение концентрического ремоделирования ЛЖ изучается недостаточно, хотя согласно данным метаанализа [10], который включал 6 исследований, при концентрическом ремоделировании по сравнению с нормальной геометрией ЛЖ скорректированный ЧСС составил 1,36 (95% ДИ 1,03–1,78; р <0,03), общий сердечно-сосудистый риск был значительно выше, особенно при АГ у лиц белой расы.
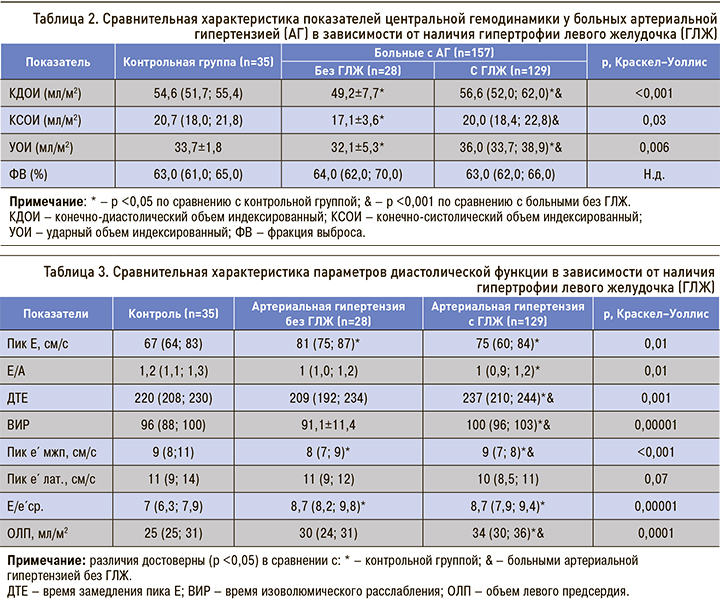
Развитие гипертрофии ЛЖ, напротив, сопровождается более высокими показателями ударного объема по сравнению с контрольной группой и больными без гипертрофии ЛЖ (см. табл. 2). Во-первых, это свидетельствует о прямой взаимосвязи между ММЛЖ и его объемными показателями, во-вторых, учитывая обратную зависимость между индексом относительной толщины стенки ЛЖ и ударным объемом, это свидетельствует о высокой распространенности гипертрофии с дилатацией полости ЛЖ. Действительно, эксцентрическая гипертрофия ЛЖ выявлена у 64 (49,6%) больных, концентрическая гипертрофия ЛЖ – у 65 (50,4%). Эти данные показывают, что на развитие гипертрофии ЛЖ оказывали влияние не только показатели АД, но и нагрузка объемом. Отсутствие достоверных различий в показателе ФВ свидетельствует о том, что глобальная ФВ не отражает истинного состояния систолической функции при АГ.
Отсутствие гипертрофии ЛЖ сопровождалось достоверным увеличением пиковой скорости Е трансмитрального кровотока по сравнению с контрольной группой (табл. 3). При этом показатели отношения Е/А, времени замедления пика Е (ДТЕ) и изоволюмического расслабления (ВИР) не исключают нарушения ДФ с псевдонормальным наполнением ЛЖ, так как они достоверно ниже, чем в группе с гипертрофией ЛЖ, но не отличаются от аналогичных показателей в контрольной группе. Ограничением оценки ДФЛЖ по данным трансмитрального кровотока является зависимость его параметров от состояния нагрузки, поэтому выявление псевдонормального наполнения ЛЖ невозможно без дополнительных параметров [1].
В таких ситуациях оценка скорости движения митрального кольца позволяет с высокой надежностью определить тип наполнения ЛЖ. В нашем исследовании пиковая скорость е´ в области межжелудочковой перегородки (МЖП) снижена по сравнению с контрольной группой и больными с гипертрофией ЛЖ, однако ее абсолютное значение остается на нижней границе нормы, что исключает псевдонормальное наполнение ЛЖ. Разнонаправленная динамика ранних пиковых скоростей Е трансмитрального кровотока и движения фиброзного кольца е´ на стороне МЖП привела к увеличению показателя Е/е´ср. до серой зоны. Е/е’ ср. <8 свидетельствует о нормальном давлении наполнения ЛЖ и выявлено только у 7 (25%) больных без гипертрофии ЛЖ и у 44 (34,1%) больных с гипертрофией ЛЖ. У 21 (75,0%) больного без гипертрофии ЛЖ и 85 (65,9%) больных с гипертрофией ЛЖ этот показатель находился в серой зоне, что не позволяет определить давление наполнения ЛЖ.
Данные EPIPorto Study [11] свидетельствуют, что показатели е´ и Е/е´ находятся в прямой зависимости от величин АД. Было установлено, что по мере увеличения АД от оптимальных значений до гипертонии отмечается снижение пиковой скорости е´ и возрастание Е/е´ср., что подтверждают результаты нашего исследования. По результатам мультивариантного анализа установлено, что повышение АД служит независимым предиктором снижения скорости е´ (β = -0,56, p=0,035 для предгипертонии и β = -1,08, р <0,001 для гипертонии). Следует отметить, что, в отличие от пиковой скорости Е трансмитрального кровотока, показатель е´ в значительно меньшей степени зависит от нагрузки, давления наполнения ЛЖ и более тесно связан с временной константой расслабления (τ) [7]. Отношение Е/е´ср. используется для оценки давления наполнения ЛЖ и рассматривается как мощный независимый предиктор первых сердечно-сосудистых событий в общей популяции и при контролируемой АГ [12, 13]. Так, в исследовании ASCOT [13] у больных АГ с умеренным риском (5-летний сердечно-сосудистый риск 5%) и хорошим контролем над АД по мере повышения показателя Е/е´ср. число первых сердечных событий увеличивалось на 15. У пациентов с Е/е´ср. в самом верхнем квартиле (>9,18) коэффициент риска в 2,4 раза превышал риск пациентов в низшем квартиле (<6,43). Результаты этого исследования впервые продемонстрировали, что значения Е/е´ср., которые ранее считались нормальными, могут быть связаны с повышенным риском сердечно-сосудистых событий именно у этой категории больных, тогда как индексированная ММЛЖ предсказывает сердечно-сосудистые события только в группе высокого и очень высокого риска [3]. Поэтому при отсутствии гипертрофии ЛЖ увеличение Е/е´ср. до серой зоны может свидетельствовать о неблагоприятном течении АГ.
Объем левого предсердия отражает накопленное влияние повышенного давления наполнения ЛЖ. Увеличение левого предсердия более 34 мл/м2 является независимым предиктором смерти, ХСН, мерцательной аритмии и ишемического инсульта [1, 14]. В нашем исследовании только при гипертрофии ЛЖ отмечалось достоверное увеличение объема левого предсердия (рис.).

Более того, оценка левого предсердия, в зависимости от типа геометрии ЛЖ, выявила, что увеличение объема отмечается при любой гипертрофии ЛЖ. При нормальной геометрии ЛЖ или концентрическом ремоделировании объем левого предсердия достоверно не отличался от показателя в контрольной группе и был достоверно ниже, чем в группе с эксцентрической или концентрической гипертрофией ЛЖ. Следовательно, объемные показатели левого предсердия тесно связаны с гипертрофией ЛЖ и не являются ранними предикторами сердечно-сосудистых событий в отличие от параметров ДФ.
 Учитывая, что при отсутствии гипертрофии ЛЖ у части больных в нашей выборке имело место концентрическое ремоделирование ЛЖ, которое сопровождается не только снижением ударного объема, но и, возможно, нарушением ДФ, мы провели оценку пиковой скорости е´ в зависимости от геометрии ЛЖ (табл. 4).
Учитывая, что при отсутствии гипертрофии ЛЖ у части больных в нашей выборке имело место концентрическое ремоделирование ЛЖ, которое сопровождается не только снижением ударного объема, но и, возможно, нарушением ДФ, мы провели оценку пиковой скорости е´ в зависимости от геометрии ЛЖ (табл. 4).
Согласно представленным данным, скорость раннего диастолического пика е´ снижается не только при ремоделировании ЛЖ, но и при нормальной геометрии, что подтверждает тесную связь пиковой скорости е´ с цифрами АД [11]. Так, по сравнению с контрольной группой, у больных АГ с нормальной геометрией полости ЛЖ и при концентрическом ремоделировании достоверное снижение скорости е’ выявляется на медиальной стороне фиброзного кольца. Снижение скорости е’ на латеральной стороне отмечалось только при развитии гипертрофии ЛЖ, особенно концентрической. Однако следует отметить, что снижение скорости е’ на латеральной стороне менее 10 см/с всего было выявлено у 106 больных АГ, в том числе при нормальной геометрии ЛЖ – у 11 (10,4%), при концентрическом ремоделировании – у 7 (6,6%).
К гемодинамическим факторам, оказывающим влияние на скорость e’, относятся расслабление ЛЖ и давление наполнения. Давление наполнения ЛЖ лучше отражает показатель Е/е’ ср. Если значение Е/е´ср. >14, то нарушение ДФ с высокой достоверностью сопровождается повышением конечно-диастолического давления в ЛЖ более 15 мм рт.ст. [7]. Пациентов с Е/е´ср. >14 в нашем исследовании не было. Возможно, это связано с относительно молодым возрастом больных и непродолжительным анамнезом АГ. Также ни один пациент из нашей выборки не имел повышения комбинированного показателя Е/е´ >15 в области МЖП и >13 на боковой стороне митрального кольца ЛЖ. Нормальные значения Е/е´ср. <8 имели 42 (26,9%) пациента, у 114 (73,1%) этот показатель находился в серой зоне.
Для суждения о состоянии ДФЛЖ не рекомендуется использовать отдельные допплеровские показатели изолированно, а следует оценивать 4–5 параметров [7]. Используя рекомендуемые показатели и их границы нормы в отношении нарушения ДФ (Е/е’ ср. >14, е’ медиальная <7 или e’ латеральная <10, скорость трикуспидальной регургитации >2,8 м/с, индексированный объем левого предсердия >34 мл/м2), нами выявлено, что признаки диастолической дисфункции ЛЖ имелись у 37 (23,6%), тогда как у остальных больных нельзя было сделать окончательный вывод о состоянии ДФЛЖ, поскольку половина показателей не выходила за границы нормы. При этом е’ <7 см/с в области МЖП имело место у 19 (12,1%) больных АГ, е´ <10 см/с в области латеральной стенки – у 106 (67,5%), объем левого предсердия >34 мл/м2 – у 74 (47,1%), пиковая скорость трикуспидальной регургитации >2,8 см/с – у 49 (31,2%). При нормальной геометрии ЛЖ нарушение ДФЛЖ выявлено у 2 (11,1%) пациентов, состояние ДФЛЖ не удалось оценить у 4 (22,2%), нормальное состояние ДФ имели 12 (66,7%) больных. При концентрическом ремоделировании ЛЖ состояние ДФЛЖ не удалось оценить у 5 (50%) пациентов, нарушение ДФ 1 степени имели 5 (50%) больных.
ЗАКЛЮЧЕНИЕ
При АГ нарушение ДФ 1 степени и снижение ударного объема ЛЖ предшествуют гипертрофии миокарда и дилатации левого предсердия, которые служат традиционными маркерами поражения сердца вследствие АГ. Более ранними маркерами нарушения ДФЛЖ являются снижение пиковой скорости е´ в области МЖП и увеличение E\е´ до серой зоны, свидетельствующие о начальных проявлениях диастолической дисфункции. У больных АГ определение этих показателей должно быть стандартным компонентом ЭхоКГ-заключения, как и традиционные ЭхоКГ-показатели риска сердечно-сосудистых осложнений.


