МРТ сердца – информативный метод диагностики пациентов с кардиомиопатиями. В настоящее время роль метода в дифференциальной диагностике, стратификации риска внезапной сердечной смерти (ВСС), определении тактики лечения пациентов с кардиомиопатиями возрастает. Мультипараметрические свойства метода позволяют при одном исследовании оценить сердечно-сосудистую анатомию, функцию сердца, перфузию миокарда, охарактеризовать изменения, происходящие в миокарде, лежащие в основе сердечной недостаточности и влияющие на прогноз заболевания [1].
К основным достоинствам МРТ относятся неинвазивность, безвредность (отсутствие лучевой нагрузки), трехмерный характер получения изображений, естественный контраст от движущейся крови, возможность оценки скорости и характера движения крови, отсутствие артефактов от костных тканей, высокий мягкотканный контраст. Результаты метода воспроизводимы, качественные изображения могут быть получены у пациентов различной комплекции [1].
МРТ сердца – признанный метод «золотого стандарта» для измерения объемов, массы миокарда и фракции выброса (ФВ) как левого, так и правого желудочков. Особенно это важно у пациентов с подозрением на аритмогенную дисплазию правого желудочка (ПЖ) [2].
 Для оценки перфузии миокарда, диагностики зон острого инфаркта, воспаления, рубцовых изменений, фиброза, уточнения характера интра- и паракардиальных объемных образований (тромбы, опухоли) необходимо использование гадолиниевых контрастных средств. Большое распространение для выявления зон некроза (инфаркт), рубцов, фиброза и воспаления (миокардиты) получила методика МРТ с отсроченным контрастированием. Хелаты гадолиния являются внеклеточными контрастными агентами, которые по структуре своей инертны и не могут проникать через неповрежденную мембрану миоцитов. В случае повреждения кардиомиоцитов происходит нарушение целостности клеточных мембран, что позволяет контрастному препарату диффундировать в то пространство, которое ранее было внутриклеточным.
Для оценки перфузии миокарда, диагностики зон острого инфаркта, воспаления, рубцовых изменений, фиброза, уточнения характера интра- и паракардиальных объемных образований (тромбы, опухоли) необходимо использование гадолиниевых контрастных средств. Большое распространение для выявления зон некроза (инфаркт), рубцов, фиброза и воспаления (миокардиты) получила методика МРТ с отсроченным контрастированием. Хелаты гадолиния являются внеклеточными контрастными агентами, которые по структуре своей инертны и не могут проникать через неповрежденную мембрану миоцитов. В случае повреждения кардиомиоцитов происходит нарушение целостности клеточных мембран, что позволяет контрастному препарату диффундировать в то пространство, которое ранее было внутриклеточным.
Тип отсроченного контрастирования (рис. 1) играет важную роль в исключении пациентов с постинфарктными рубцовыми изменениями из группы дилатационной кардиомиопатии (ДКМП) [4], определении воспалительной этиологии ДКМП. При синдроме гипертрофической кардиомиопатии (ГКМП) тип отсроченного контрастирования позволяет проводить дифференциальный диагноз патологий, лежащих в основе ГКМП, и выделять различные генотипы этого заболевания [5].
Характеристика миокарда основывается не только на раннем и отсроченном контрастном усилении, но и на других количественных параметрах: Т1-картировании с оценкой фракции внеклеточного объема (extracellular volume – ECV), Т2- и Т2*-картировании, что делает МРТ сердца мультипараметрическим исследованием [6]. Измерение ECV и нативного Т1-картирования на сегодняшний день воспроизводимо для многих заболеваний миокарда, но необходима стандартизация и контроль качества производимых измерений для более широкого применения в клинической практике [6].
Гипертрофическая кардиомиопатия (ГКМП) проявляется гипертрофией миокарда левого желудочка (ЛЖ) при отсутствии явных причин для ее развития (например, артериальной гипертонии или пороков аортального клапана). Это достаточно распространенное заболевание, частота его достигает в популяции 1:500. ГКМП является наиболее изученной группой кардиомиопатий с точки зрения генетики. Выявлено, что в 40–60% случаев причиной развития ГКМП является мутация в генах белков-саркомеров, в 5–10% причиной ГКМП являются болезни накопления (амилоидоз, болезнь Андерсона–Фабри, болезнь Данона и др.).
Невыясненным остается патогенез примерно 25–30% случаев ГКМП [7]. Клинические проявления ГКМП разнообразны и варьируют от полного отсутствия каких-либо симптомов до проявления картины обструкции выходного тракта левого желудочка, ишемии миокарда, диастолической дисфункции и аритмий. Несмотря на зачастую бессимптомное клиническое течение заболевания, ГКМП является наиболее частой причиной внезапной сердечной смерти (ВСС) у молодых людей. В современных рекомендациях Европейского общества кардиологов по диагностике и лечению ГКМП [7] рекомендуется выполнять МРТ сердца с контрастированием всем пациентам для определения наличия и выраженности участков интрамиокардиального фиброза, которые определяются у 65% (33–84%) пациентов с ГКМП в наиболее гипертрофированных сегментах миокарда, а также в местах соединения волокон ЛЖ и ПЖ [5]. Имеются данные, что патологическое накопление контрастного препарата, а точнее объем контрастированного миокарда в отсроченную фазу, является прогностическим фактором прогрессирования дилатации желудочков и соответственно развития сердечной недостаточности, сердечно-сосудистой летальности и имеет тенденцию к увеличению риска ВСС из-за развития нарушений ритма [8, 9].
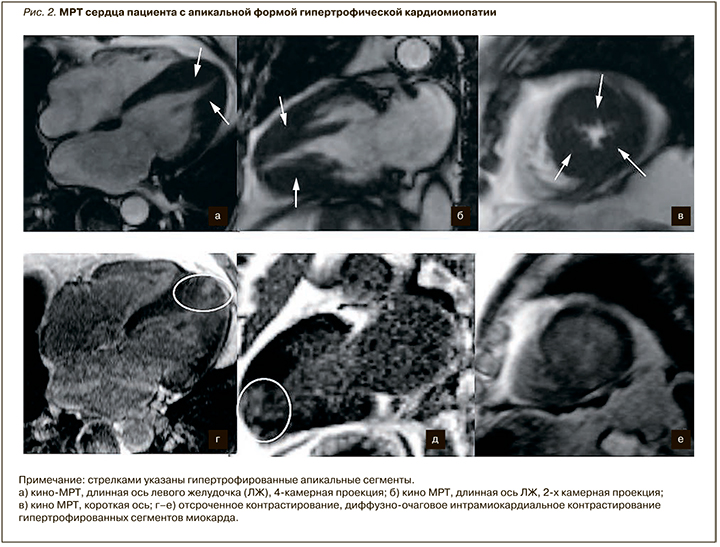
Морфологически выделяют несколько типов ГКМП. Наиболее часто встречается асимметричная гипертрофия ЛЖ, толщина миокарда (обычно МЖП) в конечно-диастолическую фазу при этом составляет более 15 мм. У некоторых пациентов гипертрофия миокарда может достигать крайне высоких цифр – до 45–50 мм. Кроме того, выделяют апикальную (рис. 2) и симметричную формы ГКМП. У 70% пациентов чаще всего в патологический процесс вовлекаются МЖП и передняя стенка ЛЖ. Наиболее выраженные изменения отмечаются, как правило, в базальных сегментах МЖП (предыдущее название этой формы – идиопатический гипертрофический субаортальный стеноз), при этом гипертрофия средних и верхушечных сегментов менее характерна. В некоторых случаях может наблюдаться вовлечение в процесс папиллярных мышц, а также миокарда правого желудочка. По сравнению с эхокардиографией (ЭхоКГ) у метода МРТ выше диагностическая точность в определении апикальной формы ГКМП, гипертрофии переднебоковой стенки, верхушечных аневризм и тромбов ЛЖ; также методика более чувствительна в определении малых аномалий у пациентов с саркомерными мутациями, таких как расщелины клефты (расщелины) миокарда и вариант строения папиллярных мышц [10–12].
Приблизительно у 25% пациентов с ГКМП отмечается обструкция выносящего тракта ЛЖ и патологическое переднесистолическое движение передней створки митрального клапан (рис. 3). Патологическое движение передней створки митрального клапана является причиной вторичной митральной регургитации, наблюдающейся в среднесистолическую фазу. У некоторых пациентов такая регургитация может быть достаточно выраженной, способствовать появлению симптомов сердечной недостаточности [13]. Для определения значимости обструкции выходного тракта ЛЖ рассчитывается градиент давления, который вычисляется по модифицированной формуле Бернулли. Максимальная скорость потока в выносящем тракте ЛЖ определяется с помощью методики фазово-контрастной МРТ.
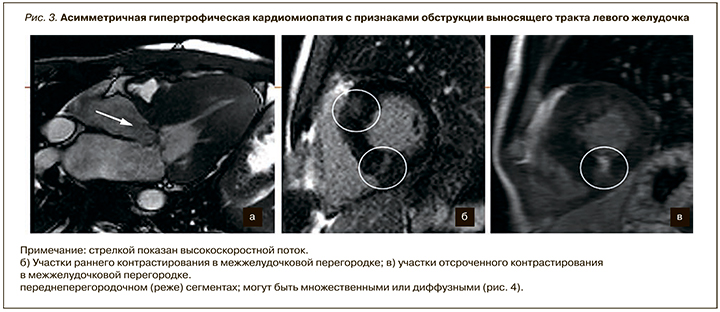
В отдельных случаях при субопитмальном качестве ЭхоКГ результаты МРТ используются для предоперционного планирования хирургической миоэктомии, особенно в случае нескольких уровней обструкции ЛЖ (на уровне выносящего тракта и внутриполостной) и у пациентов с гипертрофией выходного отдела ПЖ [14].
Дилатационная кардиомиопатия (ДКМП) характеризуется увеличением левого (и иногда правого) желудочка и сниженной систолической функцией миокарда. МРТ сердца у пациентов с ДКМП позволяет определить размер полостей желудочков и толщину их стенок, определить снижение фракции выброса одного или обоих желудочков, исключить сопутствующие заболевания перикарда и клапанную патологию, оценить влияние дилатации ЛЖ на функцию клапанов.
Основная задача, которая стоит перед визуализирующими методиками, – определить, что лежит в основе этих изменений: ишемия, воспалительный процесс или идиопатическое заболевание. При исследовании с контрастным усилением при ДКМП часто визуализируются области патологического накопления контрастного препарата, которые являются отражением миокардиальной дегенерации, некроза и последующего фиброза миокарда. Были описаны три различных варианта контрастирования у пациентов с ДКМП: отсутствие зон накопления контрастного препарата; субэндокардиальное или трансмуральное накопление контрастного препарата, не отличимое от контрастирования при ишемическом поражении миокарда; фрагментарное накопление контрастного препарата в средней части миокардиальной стенки, отличное от контрастирования при ишемическом поражении миокарда [15]. Таким образом, подтверждается теория, что пациенты с клиническим диагнозом ДКМП могут представлять собой комбинацию подгрупп больных с истинной кардиомиопатией [16] либо с постмиокардитическим кардиосклерозом [17] или даже с ишемической кардиомиопатией, которые не были распознаны своевременно клинически.
При выявлении субэндокардиальных или трансмуральных участков контрастирования миокарда ЛЖ рекомендуется проводить визуализацию коронарных артерий для подтверждения окклюзионно-стенотического поражения коронарного русла [18].
Кардиомиопатии часто приходится дифференцировать с воспалительными болезнями миокарда (миокардитами, саркоидозом и др.). Уникальная роль МРТ сердца при миокардитах, как и при кардиомиопатиях, состоит в возможности оценки тканевых характеристик миокарда. Для миокардита характерно наличие внутриклеточного и интерстициального отека, капиллярной инфильтрации, гиперемии и в более тяжелых случаях гибели кардиомиоцитов с последующим замещением фиброзной тканью [19].
Были предложены диагностические критерии для диагностики миокардитов с помощью контрастной МРТ сердца – Lake Louise Consensus Criteria (LLC) [20]. При подозрении на миокардит МРТ-исследование считается положительным для воспалительных изменений миокарда при наличии хотя бы 2 критериев:
Локального или глобального повышения интенсивности сигнала на Т2-взвешенных изображениях.
Повышения соотношения между интенсивностью сигнала миокарда и скелетной мускулатурой в раннюю фазу контрастирования.
Пограничное значение для данного соотношения составляет 2,0. Вовлечение скелетной мускулатуры в системный процесс воспаления может ограничить использование данной методики, поэтому необходимо учитывать наличие миозита у пациента или упоминание о мышечных болях в анамнезе заболевания. Наличие отека миокарда при отсутствии участков патологического накопления контрастного препарата в отсроченную фазу отражает обратимые изменения миокарда.
Наличие как минимум одного участка накопления контрастного препарата в отсроченную фазу неишемического характера МРТ сердца подтверждает наличие повреждения миоцитов и/или рубцовых изменений, вызванных воспалительным процессом, если критерий 3 положительный.
Субэндокардиальный характер контрастирования не типичен для миокардита, что позволяет проводить дифференциальный диагноз с постишемическими рубцовыми изменениями миокарда. Участки накопления контрастного препарата могут определяться субэпикардиально или интрамурально в нижнебоковом (наиболее часто) и переднеперегородочном (реже) сегментах; могут быть множественными или диффузными (рис. 4).
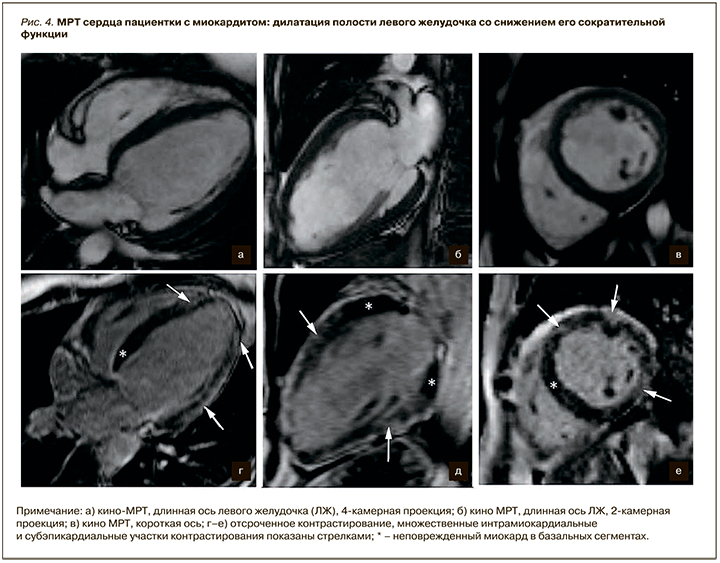
Наличие дисфункции ЛЖ или перикардиального выпота дает дополнительную информацию, позволяющую подтвердить наличие миокардита.
При использовании критериев LLC для диагностики миокардита могут возникнуть сложности, так как эти три маркера (отек, гиперемия, отсроченное контрастирование) не являются специфичными для миокардита, могут встречаться и при других невоспалительных кардиомиопатиях. В первую очередь это касается отсроченного контрастирования; отек и гиперемия также могут наблюдаться и при других патологических состояниях. Новые методики количественной оценки – Т1- и Т2-картирование – с расчетом внеклеточного объема (ECV) были предложены с целью снять ограничения LLC [21].
Рестриктивная кардиомиопатия (РКМП) – группа заболеваний сердечной мышцы, характеризующихся ее первичной диастолической дисфункцией, снижением наполнения желудочков вследствие утолщения и увеличения ригидности эндокарда и миокарда. Морфологически, особенно у пациентов с первичной КМП, размер желудочков и толщина стенок остаются в пределах нормы, однако отмечается диспропорциональное увеличение предсердий вследствие повышения давления наполнения правого и левого желудочков, что в дальнейшем приводит к развитию митральной и трикуспидальной регургитации. Среди всех кардиомиопатий эта группа встречается наиболее редко [22].
В первую очередь необходимо проведение дифференциальной диагностики с констриктивным перикардитом с помощью ЭхоКГ и МСКТ сердца. МР-исследование позволяет детально выявить морфологические аномалии перикарда, оценить движение перикарда и наполнение желудочков. По типу отсроченного контрастирования при МРТ можно дифференцировать амилоидоз, саркоидоз, болезнь Фабри, болезнь Данона и другие причины развития рестрикции [22].
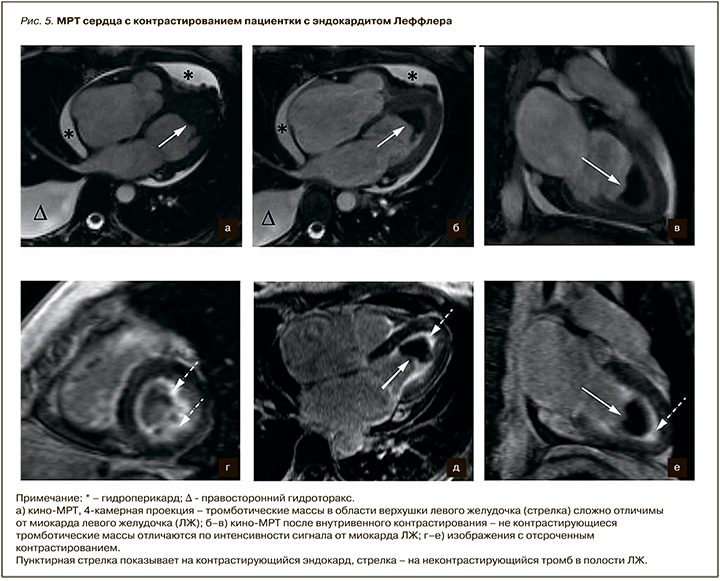
В качестве примера первичной рестриктивной кардиомиопатии можно привести результаты МРТ сердца 42-летней пациентки с эндокардитом Леффлера (рис. 5). У пациентки отмечалась одышка при минимальной физической нагрузке, эпизоды предобморочных состояний, снижение толерантности к физическим нагрузкам. В анализах крови отмечалась эозинофилия (до 16%). При проведении ЭхоКГ был выявлен тромбоз полости ЛЖ, митральная и трикуспидальная регургитация 2 степени, дилатация левого и правого предсердий, умеренное снижение ФВ ЛЖ до 52%, гидроперикард, гидроторакс. При МРТ сердца была подтверждена облитерация верхушки ЛЖ тромбонекротическими массами, признаки эндомиокардиального фиброза ЛЖ.
МРТ сердца также является методом выбора в диагностике правожелудочковой КМП (используется и другое название: аритмогенная дисплазия правого желудочка – АДПЖ). При этом заболевании происходит частичная или полная замена миокарда ПЖ жировой или фиброзной тканью, что ассоциировано с желудочковыми тахиаритмиями (из ПЖ). АДПЖ – редкое генетическое заболевание, частая причина внезапной сердечно-сосудистой смерти у молодых пациентов, является причиной внезапной смерти у атлетов в 3–4% случаев.
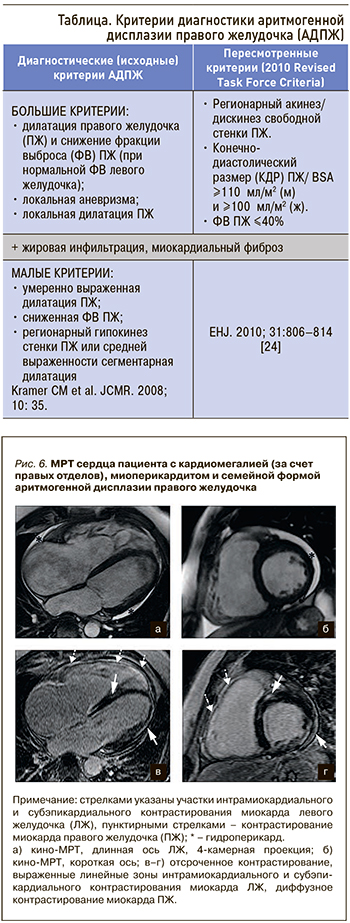 МРТ позволяет выявить основные диагностические признаки этого заболевания. Т1- и Т2-взвешенные изображения, в том числе с подавлением сигнала от жировой ткани, позволяют выявить жировую инфильтрацию миокарда ПЖ. Следует отметить, что жировая инфильтрация миокарда не является исключительным патогномоничным признаком аритмогенной КМП. Она может встречаться у бессимптомных пожилых пациентов без нарушений ритма, а также у лиц, перенесших миокардит или ИМ. Жировое замещение миокардиальной ткани начинается с субэпикардиальных слоев, и на ранних стадиях эти гистологические изменения очень трудно отличить от прилежащего эпикардиального жира. Жир в стенках желудочков встречается и у здоровых людей без аритмий и других проявлений АДПЖ. Поэтому в настоящее время этот признак исключен из критериев диагностики АДПЖ. Более надежным признаком считается сочетание жировой инфильтрации миокарда ПЖ и снижение его сократительной функции. Истончение миокарда ПЖ менее 2 мм также является частой находкой у больных с аритмогенной КМП и, как правило, сочетается с дилатацией полости ПЖ. Кино-МРТ позволяет выявить локальные нарушения сократимости миокарда ПЖ. Существует так называемый треугольник дисплазии: вносящий/выносящий тракт ПЖ, верхушка ПЖ, где чаще всего выявляются изменения. МЖП бывает вовлечена редко, поэтому возможности биопсии ограниченны. Выделяют 3 подкласса АДПЖ: классическая форма (поражен миокард ПЖ), бивентрикулярная, с доминированием ЛЖ. Вовлечение ЛЖ служит независимым фактором возможного возникновения сердечных событий (ВСС, срабатывание установленного кардиовертер-дефибриллятора или успешные реанимационные мероприятия) [23].
МРТ позволяет выявить основные диагностические признаки этого заболевания. Т1- и Т2-взвешенные изображения, в том числе с подавлением сигнала от жировой ткани, позволяют выявить жировую инфильтрацию миокарда ПЖ. Следует отметить, что жировая инфильтрация миокарда не является исключительным патогномоничным признаком аритмогенной КМП. Она может встречаться у бессимптомных пожилых пациентов без нарушений ритма, а также у лиц, перенесших миокардит или ИМ. Жировое замещение миокардиальной ткани начинается с субэпикардиальных слоев, и на ранних стадиях эти гистологические изменения очень трудно отличить от прилежащего эпикардиального жира. Жир в стенках желудочков встречается и у здоровых людей без аритмий и других проявлений АДПЖ. Поэтому в настоящее время этот признак исключен из критериев диагностики АДПЖ. Более надежным признаком считается сочетание жировой инфильтрации миокарда ПЖ и снижение его сократительной функции. Истончение миокарда ПЖ менее 2 мм также является частой находкой у больных с аритмогенной КМП и, как правило, сочетается с дилатацией полости ПЖ. Кино-МРТ позволяет выявить локальные нарушения сократимости миокарда ПЖ. Существует так называемый треугольник дисплазии: вносящий/выносящий тракт ПЖ, верхушка ПЖ, где чаще всего выявляются изменения. МЖП бывает вовлечена редко, поэтому возможности биопсии ограниченны. Выделяют 3 подкласса АДПЖ: классическая форма (поражен миокард ПЖ), бивентрикулярная, с доминированием ЛЖ. Вовлечение ЛЖ служит независимым фактором возможного возникновения сердечных событий (ВСС, срабатывание установленного кардиовертер-дефибриллятора или успешные реанимационные мероприятия) [23].
В 2010 г. были пересмотрены критерии диагностики АДПЖ (Task Force Criteria, 2010), основное значение сейчас уделяется количественным характеристикам – индексированному (нормализованному по площади поверхности тела) объему правого желудочка и фракции выброса ПЖ, изменение которых при наличии участка акинеза или дискинеза свободной стенки ПЖ достаточно для подтверждения диагноза АДПЖ [24]. Применение пересмотренных критериев (табл.) позволило повысить их специфичность в диагностике АДПЖ.
Феномен отсроченного контрастирования миокарда встречается и у пациентов с аритмогенной правожелудочковой КМП. МРТ с гадолинием выявляет участки миокардиального фиброза в стенках левого и правого желудочков (рис. 6).
Определение генетических мутаций у пациентов с аритмогенными кардиомиопатиями доказывает выраженную гетерогенность пациентов этой группы.
К неклассифицируемым КМП относят синдром некомпактного миокарда и синдром «такотсубо», а также ряд еще более редких болезней сердца. Некомпактный миокард левого желудочка (НМЛЖ) характеризуется чрезмерной трабекулярностью миокарда ЛЖ и образованием глубоких межтрабекулярных пространств. В норме массивные мышечные трабекулы могут встречаться в ПЖ, при этом наличие их в ЛЖ считается патологией. НМЛЖ может сочетаться также с рядом врожденных болезней сердца, нарушениями ритма сердца. ЭхоКГ, МРТ и МСКТ являются основными методами диагностики НМЛЖ. Предложены следующие диагностические критерии НМЛЖ: отсутствие сопутствующей патологии сердца, приводящей к изменению структуры миокарда; выявление двухслойной структуры утолщенной стенки левого желудочка – компактного эпикардиального и некомпактного эндокардиального слоев, причем соотношение между ними превышает 1:2, 3 [25]. Специфичность диагностики НМЛЖ повышает применение критерия массы миокарда [26]. При этом масса некомпактного миокарда должная составлять более 20% от массы компактного миокарда ЛЖ. На рисунке 7 представлены Р-изображения пациента с некомпактным миокардом ЛЖ.
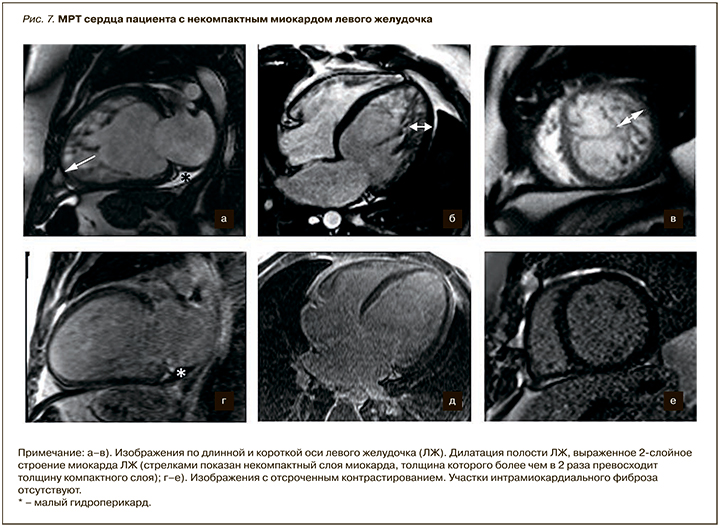
Наиболее часто бывает вовлечена верхушка ЛЖ, миокард боковой и нижней стенок ЛЖ. Данные по результатам исследования с контрастированием противоречивы и варьируют от полного отсутствия участков отсроченного накопления контрастного препарата до наличия очагов субэндокардиального, интрамурального и трансмурального контрастирования.
В ряде научных публикаций описываются изменения в генотипе больных с семейной формой некомпактного миокарда левого желудочка [27], однако гены, ответственные за спорадические формы, еще мало изучены. В научной литературе НМЛЖ относят к кардиомиопатиям, ассоциированным с мутациями генов саркомерных белков. Сочетание НМЛЖ с ГКМП или с ДКМП у группы пациентов, генетическое родство, описания постепенной трансформации ГКМП со сниженной сократимостью в НКМП, сложность дифференциальной диагностики данных кардиомиопатий стирают грань между этими заболеваниями и требуют проведения дополнительных генетических и морфологических исследований с использованием современных визуализирующих методик [28]. Однако стоит отметить, что имеет место и элемент гипердиагностики некомпактного миокарда левого желудочка, что является предметом дополнительного изучения.
ЗАКЛЮЧЕНИЕ
Благодаря развитию визуализирующих методов в настоящее время значительно увеличилось число диагностированных случаев гипертрофической и аритмогенной кардиомиопатии, некомпактного миокарда левого желудочка, что позволяет своевременно поставить правильный диагноз и проводить лечебные мероприятия, направленные на профилактику внезапной сердечной смерти.


