Аритмогенная дисплазия правого желудочка (АДПЖ) представляет собой первичное заболевание миокарда, основным морфологическим проявлением которого является замещение кардиомиоцитов фиброзно-жировой тканью, а клиническим проявлением – развитие аритмий [1, 2]. Считается, что у мужчин она возникает в 4 раза чаще, чем у женщин, однако истинную распространенность заболевания оценить трудно, так как часто первым ее проявлением становится внезапная сердечная смерть без последующего морфологического исследования [3]. В последние годы число описаний клинических случаев АДПЖ у женщин в целом и у беременных в частности продолжает увеличиваться, что связано с особенностями ведения беременности и родов не только при этой патологии, но и на фоне часто используе-мых у этого контингента имплантируемого кардиовертера-дефибриллятора (ИКД) и антиаритмических препаратов [4–22].
В этом материале мы рассмотрим клинический случай беременной с АДПЖ и ИКД на фоне антиаритмической терапии (ААТ) при сохраняющихся коротких пароксизмах желудочковой тахикардии (ЖТ).
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Больная П., 26 лет, первобеременная, первородящая.
С 2014 г. отмечает эпизоды учащенного сердцебиения, возникающие и купирующиеся спонтанно, сопровождающиеся головокружением, продолжительностью до нескольких минут. С 2015 г. при суточном мониторировании ЭКГ по Холтеру (СМ ЭКГ) верифицирована ЖТ. Получала пропафенон 600 мг/сут.
При плановом обследовании в этом же году выявлены изменения на ЭКГ, при повторном СМ ЭКГ отмечено отсутствие эффекта от ААТ; больная переведена на прием препарата Кордарон (амиодарон) по общепринятой схеме. Отмечала отсутствие эффекта от лечения этим препаратом, приступы стали чаще и длительнее. В марте 2017 г. в условиях РКНПК кардиологии им. А.Л. Мясникова проведено магнитно-резонансное исследование сердца с усилением: патологии не выявлено.
В мае 2017 г. больная находилась на обследовании и лечении в НЦ ССХ им. А.Н. Бакулева. На ЭКГ обнаружена желудочковая экстрасистолия IV градации по Lown, патологии при ЭхоКГ не выявлено. Выполнено электрофизиологическое исследование, радиочастотная аблация (РЧА) ЖТ.
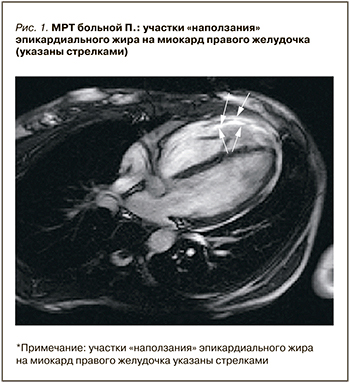 В июне 2017 г. при проведении магнитно-резонансного исследования сердца с усилением годолиниумом в НЦ ССХ им. А.Н. Бакулева у больной было выявлено утолщение перикарда с наличием спаек и сепарация его листков 5–6 мм.
В июне 2017 г. при проведении магнитно-резонансного исследования сердца с усилением годолиниумом в НЦ ССХ им. А.Н. Бакулева у больной было выявлено утолщение перикарда с наличием спаек и сепарация его листков 5–6 мм.
Эпикардиальный жир диффузно утолщен до 4–5 мм, с признаками «наползания» на миокард правого желудочка (рис. 1).
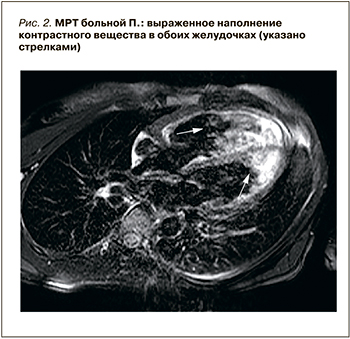
Также отмечается «наползание» эпикардиального жира на миокард левого желудочка по боковой стенке на уровне верхушки. Камеры сердца не расширены. Выводной отдел правого желудочка несколько расширен до 30 мм, передняя стенка правого желудочка прослеживается довольно равномерно на всем протяжении, толщина миокарда в диастолу до 3 мм, с участками гипо- и дискинезии. Верхушка правого желудочка расширена, выбухает. Фракция выброса правого желудочка 39% (норма – более 40%). В раннюю и позднюю отсроченные фазы контрастирования отмечается субэпикардиальное накопление контрастного вещества по боковой стенке левого желудочка на уровне верхушечных сегментов, а также выраженное накопление по передней стенке правого желудочка в трабекулярной части, что отражает изменения неишемического генеза (рис. 2).
 В июне 2017 г. в условиях РНЦХ им. Б.В. Пет-ровского в связи с неэффективностью РЧА и наличием до 34 пробежек ЖТ за сутки при СМ ЭКГ выполнена имплантация однокамерного кардиовертера-дефибриллятора Protecta. При ЭхоКГ выявлено расширение правого предсердия (39×48 мм) и проксимального диаметра выходного тракта правого желудочка до 38 мм (норма – до 33 мм), трикуспидальная регургитация 2–3 степени. Пациентка была выписана без антиаритмической терапии, однако в связи с выявленными эпизодами ЖТ до нескольких минут в дальнейшем ей был рекомендован прием препарата Беталок ЗОК (метопролол пролонгированного высвобождения) в дозировке 25 мг/сут с титрованием дозы до 200 мг/сут.
В июне 2017 г. в условиях РНЦХ им. Б.В. Пет-ровского в связи с неэффективностью РЧА и наличием до 34 пробежек ЖТ за сутки при СМ ЭКГ выполнена имплантация однокамерного кардиовертера-дефибриллятора Protecta. При ЭхоКГ выявлено расширение правого предсердия (39×48 мм) и проксимального диаметра выходного тракта правого желудочка до 38 мм (норма – до 33 мм), трикуспидальная регургитация 2–3 степени. Пациентка была выписана без антиаритмической терапии, однако в связи с выявленными эпизодами ЖТ до нескольких минут в дальнейшем ей был рекомендован прием препарата Беталок ЗОК (метопролол пролонгированного высвобождения) в дозировке 25 мг/сут с титрованием дозы до 200 мг/сут.
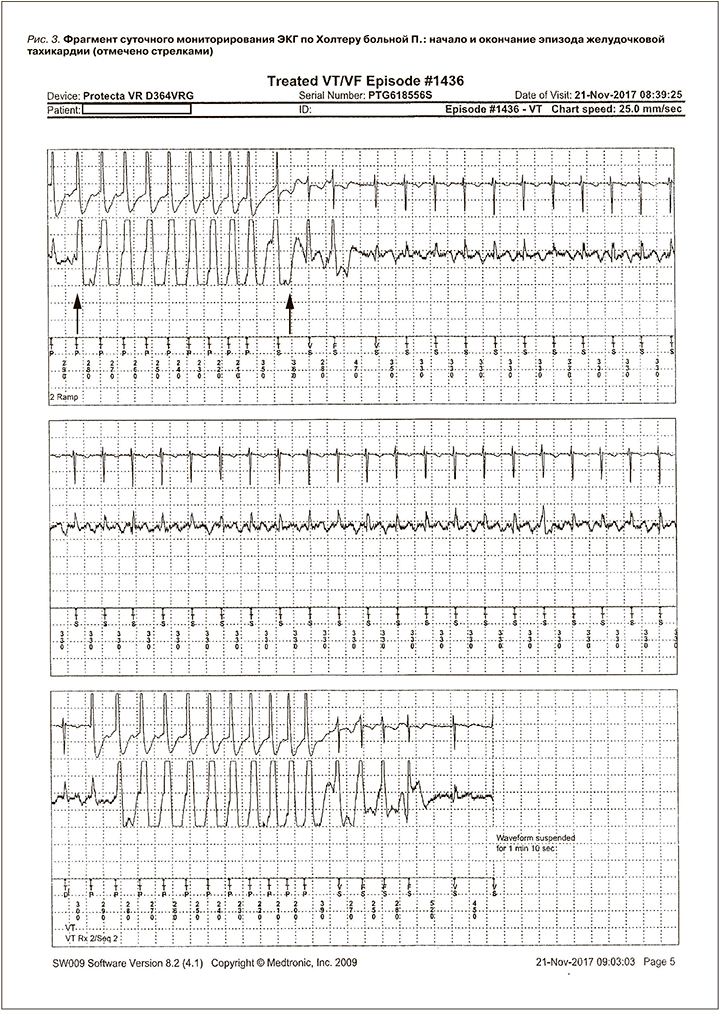
В ноябре 2017 г. в связи с неэффективностью ААТ там же выполнена радиочастотная катетерная аблация желудочковой тахикардии, после которой рекомендован прием препарата Конкор (бисопролол) по 2,5 мг 2 раза/сут. На рисунке 3 представлен фрагмент СМ ЭКГ по Холтеру до проведения РЧА.
На рисунке 4 представлена ЭКГ больной П., 26 лет (RR=0,96 с, PQ=0,14 с, QRS=0,13 с, QT=0,42 с, QTс=0,41c (QT корригированный), угол альфа QRS=+50 град.).
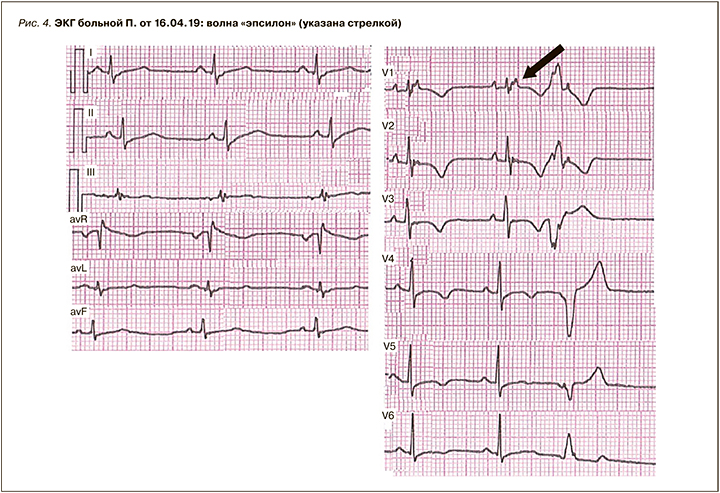
Сегмент STV1–V2 смещен под изолинию. Зубец Т(+) I, II, III, aVL, aVF; зубец T(-) aVR; зубцы Т(-) V1–V6, ассиметричный, максимальная глубина T(-) в правой группе грудных отведенийV2–V4. Определяется волна «эпсилон» в отведении V1.
Предэктопический интервал желудочковой парасистолы – 0,42–0,56 с. Продолжительность QRS в парасистолическом комплексе 0,18 с.
Заключение: синусовый ритм 62 уд./мин. Неопределенное направление электрической оси сердца. Изменение предсердного компонента справа. Политопная желудочковая экстра- и парасистолия. Очаговые изменения в миокарде желудочков некоронарогенного генеза.
Во время беременности пациентка наблюдалась в женской консультации по месту жительства и в поликлиническом отделении МОНИИАГ. Проводился скрининг I и II триместра: патологии не выявлено.
На сроке 15 нед беременности пациентка отметила эпизод сердцебиения с высокой частотой, который сопровождался головокружением, возник во время физической нагрузки (кратковременный бег) и купировался самостоятельно. Конкор был заменен на Сотагексал (соталол по 20 мг 2 раза/сут), с больной проведена беседа о недопустимости физических перегрузок.
26 июля 2018 г. (23–24 нед беременности) при тестировании ИКД выявлено 57 эпизодов коротких (до 4 с) эпизодов ЖТ с максимальной частотой сердечных сокращений до 220 в минуту.
В III триместре беременность осложнилась анемией легкой степени, пациентка получала антианемическую терапию. Во время беременности отмечалась патологическая прибавка веса, которая составила 21 кг. С 36-й недели беременности появились отеки голеней и стоп.
Пациентка была госпитализирована в МОНИИАГ на сроке 38–39 нед беременности. Семейный анамнез в отношении внезапной смерти не осложнен. Состояние удовлетворительное. Шейные вены не набухшие. В легких дыхание везикулярное, хрипов нет. Тоны сердца громкие, аритмичные (аускультативно – экстрасистолия), шумов нет. ЧСС 84/мин. АД 110/70 мм рт.ст. Печень перкуторно не увеличена. Отеков нет. Клинический и биохимический анализы крови, анализ мочи без патологии.
Данные УЗИ плода от 08.10.2018: беременность 38 нед, головное предлежание. Предполагаемая масса плода 3940 г. Гемодинамических нарушений фетоплацентарного комплекса нет. По данным кардиотокографического исследования данных в пользу внутриутробного страдания плода не выявлено.
Данные ЭхоКГ от 09.10.2019: расширение правого желудочка до 3,3 см, отмечается снижение dp/dt правого желудочка – 404 мм рт.ст. ст/с-1 , dp/dt левого желудочка – 1280 мм рт.ст. ст/с-1, трикуспидальная регургитация 2 степени. Определяется множество гиперэхогенных включений в миокарде обоих желудочков, межжелудочковой перегородке. Глобальная сократимость миокарда не снижена.
Результаты холтеровского мониторировании ЭКГ: частая желудочковая экстра- и парасистолия; выявлена одна «пробежка» ЖТ с максимальной частотой до 169/мин. (рис. 5).

Принимая во внимание возможность самопроизвольных родов даже в случаях прогрессирования заболевания с признаками морфологического поражения правого желудочка, достижение в этом клиническом наблюдении на фоне приема соталола относительно положительного антиаритмического эффекта в виде исчезновения устойчивой желудочковой тахикардии, а также наличие у пациентки ИКД, было принято решение о возможности самопроизвольных родов на доношенном сроке под длительной эпидуральной аналгезией наропином с сохранением в дальнейшем лактации.
Пациентке были проведены программированные роды через естественные родовые пути при сроке 38–39 нед беременности, метод родовозбуждения – амниотомия. Роды проходили на фоне эпидуральной аналгезии. С целью укорочения II периода родов выполнялась эпизиотомия; в итоге в переднем виде затылочного предлежания без затруднений родился живой доношенный мальчик массой 3750 г, ростом 52 см с оценкой по шкале Апгар 8/9 баллов. Общая продолжительность родов составила 6 ч 10 мин, продолжительность I периода – 6 ч 00 мин, II – 20 мин, III – 5 мин, безводный промежуток составил 6 ч 30 мин. При мониторном наблюдении в родах сохранялась желудочковая экстрасистолия, пароксизмов желудочковой тахикардии не было. Послеродовый период протекал без осложнений. Лактация сохранена. Родильница вместе с ребенком была выписана на 4-е сутки с рекомендациями применять соталол по 20 мг 2 раза/сут длительно.
ОБСУЖДЕНИЕ
Первое описание АДПЖ, по-видимому, принадлежит Fontaine G. et al. (1978), которые выявили шестерых пациентов с желудочковой тахикардией; причиной ее были необычные участки отложения жира в свободной стенке правого желудочка с патологическим увеличением его размеров и парадоксальным движением стенок [6]. Впрочем, возможно, первенство в описании этой патологии принадлежит врачу Римского Папы Giovanni Maria Lancisi, сделанной в книге De Motu Cordis et Aneurysmatibus и опубликованной в 1736 г. [7, 8].
АДПЖ характеризуется атрофией миокарда с замещением его жировой тканью, фиброзом миокарда, а также истончением стенки правого желудочка с расширением его полости. Основой для возникновения желудочковых нарушений ритма при этой патологии служит атрофия миокарда правого желудочка с его фиброзно-жировым замещением.
Считается, что заболеваемость АДПЖ составляет от 1 до 6 случаев на 10 000 населения, однако эти цифры полностью не отражают распространенность патологии, так как начало ее часто протекает бессимптомно, а дебют проявляется желудочковой тахикардией и внезапной сердечной смертью.
В ряде европейских стран (Германия, Италия) распространенность АДПЖ может составлять 1 на 1000–2000 населения [9]. В 80% случаев АДПЖ выявляется в возрасте до 40 лет, чаще у мужчин.
Генетические исследования у пациентов с АДПЖ выявили аномалии генов, расположенных в 12-й, 14-й, 17-й и 18-й хромосомах. Мутации этих генов наследуются по аутосомно-доминантному типу с низкой пенетрантностью, не превышающей 30–50%. Названные гены ответственны за синтез специфических белков миокарда. Изменения структуры белков вызывают снижение устойчивости клеток миокарда к повреждающему воздействию. Это становится причиной замещения со временем клеток миокарда жировой тканью. Важным диагностическим признаком АДПЖ являются указания на семейный характер заболевания, а также случаи внезапной смерти родственников.
АДПЖ относится к группе кардиомиопатий. Выделяют эталонную или чистую форму (болезнь Наксоса), проявляющуюся злокачественной аритмией в детском возрасте или позже; венецианскую кардиомиопатию с вовлечением в патологический процесс и стенки левого желудочка; редкие аритмогенные формы (болезнь Покури, аномалия Уля) и неаритмогенную форму с развитием застойной сердечной недостаточности.
В диагностике АДПЖ используются критерии в виде сочетания малых и больших признаков [10].
У пациентки в представленном клиническом наблюдении имелось сочетание сразу пяти больших признаков заболевания:
- инвертированный зубец Т в правых прекордиальных отведениях при отсутствии полной блокады правой ножки пучка Гиса;
- наличие волны «эпсилон»;
- дилатация и снижение фракции выброса правого желудочка;
- акинезия/дискинезия стенок правого желудочка;
- неустойчивая желудочковая тахикардия с морфологией блокады левой ножки пучка Гиса с отклонением электрической оси сердца (ЭОС) влево/вверх.
Диагноз АДПЖ вероятен при наличии 2 больших критериев, 1 большого или 2 малых или 4 малых критериев.
В представленном клиническом случае обращает на себя внимание неуклонное прогрессирование заболевания. Так, если при ЭКГ-обследовании в мае 2017 г. патология выявлена не было, то в 2019 г. в отведении V1 уже определялась волна «эпсилон», встречающаяся 7–30% случаев и представляющая собой потенциал малой амплитуды на восходящем сегменте ST, что, как считают, отражает замедленную деполяризацию правого желудочка (механизм, способствующий развитию re-entry-аритмий) [11].
Продолжительность комплекса QRS в желудочковой экстра- или парасистоле также важный прогностический признак. Так, превышение показателя более 0,16 с служит независимым маркером-предиктором жизнеугрожающих нарушений ритма и внезапной сердечной смерти, структурных изменений миокарда, а также связано с частотой «срабатывания» ИКД, что, однако, более характерно для мужчин [12, 13]. У пациентки П. значение этого показателя составило 0,18 с.
Важным критерием в отношении прогноза развития сердечной недостаточности, в том числе при наступившей беременности, является состояние правого желудочка. При обследовании 26 беременных с АДПЖ (39 беременностей) развитие сердечной недостаточности отмечено в 2 случаях (5%), причем только у пациенток с ранее существовавшим поражением обоих желудочков или изолированно правого [14]. У пациентки П. с мая по июнь 2017 г. отмечена отрицательная динамика со стороны размеров правого желудочка и его сократимости, а на доношенном сроке беременности при ЭхоКГ-исследовании выявлены существенное снижение средней скорости сокращения миокарда правого желудочка, множественные участки кардиосклероза в обоих желудочках. Аритмогенная готовность миокарда за все время наблюдения оставалась высокой, постоянно (в том числе во время беременности) регистрировались групповая желудочковая экстрасистолия и эпизоды неустойчивой желудочковой тахикардии, отмечалась неполная эффективность ААТ (Конкор, Сотагексал); однократно отмечено пресинкопальное состояние.
Считается, что беременность может стать фактором, усиливающим проявления АДПЖ, из-за свойственного ей увеличения объема циркулирующей крови и сердечного выброса, а также вследствие увеличения под влиянием эстрадиола и прогестерона возбудимости и чувствительности миокарда к катехоламинам с возрастанием числа адренергических рецепторов [15]. Кроме того, часто наблюдаемая у беременных синусовая тахикардия способна увеличить возбудимость тканей, инициируя механизм re-entry. Описан случай внезапной смерти беременной на 11-й недели гестации без предшествующих клинических проявлений АДПЖ [16].
Медикаментозное лечение аритмий у беременных с АДПЖ включает бета-адреноблокаторы (метопролол, бисопролол) или их комбинацию с амиодароном, а при неэффективности – соталол [2]. Положительный эффект последнего лекарственного средства составляет 68,4 и 82,8% в отношении воспроизводимых и невоспроизводимых желудочковых тахикардий соответственно [17].
Действительно, в нашем случае наиболее эффективным препаратом у данной пациентки оказался именно соталол. Терапия им привела к исчезновению пароксизмов устойчивой желудочковой тахикардии, отсутствию «срабатывания» ИКД, хотя на протяжении всей беременности продолжали отмечаться пароксизмы неустойчивой желудочковой тахикардии (до 4 с) с относительно невысокой частотой желудочковых сокращений в пароксизме (до 169 в 1 минуту).
Выявлено, что терапия бета-адренолокаторами беременных с АДПЖ ассоциирована с более низкой массой тела новорожденных (3,1±0,48 против 3,7±0,57 кг; p=0,002) [14].
Большинство исследователей считает, что даже при наличии эпизодов стойкой желудочковой тахикардии и участков структурной патологии миокарда беременность пациентками переносится хорошо. Тем не менее в 13% случаев беременность осложняется желудочковыми аритмиями, в 10% сопровождается приступами учащенного сердцебиения и головокружением [3, 14]. При всей разнообразности клинико-морфологической картины заболевания частота самопроизвольных родов составляет 94% при отсутствии осложнений в 97% [3, 4]. Частота кесарева сечения по акушерским показаниям может достигать 28% [14].
У женщин с ИКД беременность протекает без осложнений [18, 19]. Потенциально злокачественная аритмия легко распознается устройством и прерывается электрическим разрядом, создающимся между электродом, введенным в полость правого желудочка и корпусом ИКД, находящимся в области левой большой грудной мышцы. Роды ведутся через естественные родовые пути под мониторным контролем частоты сердечных сокращений матери, плода и медикаментозным обезболиванием (промедол). Препарат вводится внутривенно медленно под мониторным контролем. Ограничения или исключение потуг не требуется.
Прогноз беременности у женщин с ИКД вполне благоприятен, тем не менее в 42,9% могут отмечаться осложнения как кардиологические (аритмии, сердечная недостаточность), так и со стороны ИКД (разряды ИКД, перелом электрода, тромбоз в месте фиксации электрода) [18, 20].
Борьба с болью в родах и послеродовом периоде – важная составляющая лечения, так как стимуляция симпатической нервной системы может потенцировать развитие аритмий [21]. В случае сохранения лактации для предотвращения развития аритмий необходим контроль содержания магния в сыворотке крови [22].
ЗАКЛЮЧЕНИЕ
В представленном клиническом наблюдении показано отсутствие кардиологических и акушерских осложнений во время беременности у пациентки с прогрессирующим течением АДПЖ и ИКД, что обусловило возможность проведения самопроизвольных родов под эпидуральной аналгезией. Наиболее эффективным антиаритмическим препаратом, по нашим данным, явился соталол, применение которого позволило купировать устойчивые пароксизмы желудочковой тахикардии и синкопальные состояния, а его длительное применение во время беременности не привело к развитию синдрома задержки роста плода.



