Анализ смертности от 235 причин среди 20 возрастных групп населения земного шара за период 1990–2010 гг., опубликованный в декабре 2012 г. в журнале Lancet, демонстрирует, что к 2010 г. хроническая обструктивная болезнь легких (ХОБЛ) вышла на 4-е место в списке причин смерти в мире [1]. При этом смертность от нее продолжает увеличиваться и, по прогнозам ВОЗ, к 2020 г. ХОБЛ переместится на 3-е место по этому показателю [2, 3].
Данные эпидемиологических исследований свидетельствуют, что пациент с ХОБЛ имеет более высокий риск развития сердечно-сосудистых заболеваний (ССЗ) и внезапной сердечной смерти. Так, у больных с инфарктом миокарда (ИМ) ХОБЛ диагностируется с частотой около 17%, у пациентов с хронической сердечной недостаточностью (ХСН), согласно данным исследования REPOSI, с частотой 20–30%. По данным эпидемиологических исследований установлено, что прогрессирующее снижение функции легких является столь же сильным предиктором сердечно-сосудистой летальности, как и основные кардиоваскулярные факторы риска.
В исследовании The Lung Health Study показано, что уменьшение объема форсированного выдоха за первую секунду (ОФВ1) на 10% увеличивает общую смертность на 14%, сердечно-сосудистую – на 28%, риск развития ишемической болезни сердца (ИБС) – на 20%. Результаты Роттердамского исследования, в которое вошло 14 926 человек, показали, что ХОБЛ увеличивает угрозу внезапной сердечной смерти, особенно высокий риск имеют больные с частыми обострениями. У пациентов с ХОБЛ риск сердечно-сосудистой смерти в 2–3 раза выше, причем ССЗ ответственны приблизительно за 50% всех летальных исходов [4–6]. Это позволило экспертам признать ХОБЛ независимым фактором риска сердечно-сосудистой заболеваемости и смертности [4–10]. Выявлены определенные особенности сердечно-сосудистой коморбидности у больных ХОБЛ в зависимости от фенотипа: развитию таких ССЗ, как ИМ, хроническая сердечная недостаточность (ХСН), нарушения ритма, в большей степени подвержены больные, имеющие преимущественно бронхитический фенотип с частыми обострениями, в то время как у пациентов с эмфиземой чаще развивается диастолическая дисфункция миокарда [11].
Ввиду того что бета-адреноблокаторы (ББ) – одна из основных групп лекарственных средств для лечения заболеваний сердечно-сосудистой системы, вопрос об их применении у больных ХОБЛ крайне актуален. Современные клинические рекомендации по лечению ХОБЛ допускают применение кардиоселективных ББ у этой категории больных [2], но в реальной клинической практике врачи часто не назначают препараты этой группы пациентам с ХОБЛ и ССЗ, опасаясь прогрессирования бронхиальной обструкции и конкурентного взаимодействия с β2-агонистами. В ряде эпидемиологических исследований получены данные о том, что от 30 до 50% больных ХОБЛ не получают ББ, которые абсолютно показаны им для лечения сопутствующих ССЗ. Возможно, это служит одной из причин более тяжелого течения сердечно-сосудистой патологии и высокой частоты неблагоприятных исходов у этой категории пациентов [6, 10, 12, 13].
Опасения врачей, связанные с назначением ББ больным ХОБЛ, объясняются фармакологическими свойствами этой группы препаратов: блокада β2-адренорецепторов может вызывать бронхоконстрикцию и ухудшать функцию внешнего дыхания. В официальных инструкциях по медицинскому применению ББ рекомендовано использовать их у больных ХОБЛ с осторожностью, а в ряде случаев тяжелая ХОБЛ даже рассматривается как противопоказание к применению этих препаратов, включая кардиоселективные [14].
С другой стороны, необходимо помнить о том, что гиперактивация симпатической нервной системы относится к патогенетическим характеристикам больных ХОБЛ и вызывает органоповреждающие эффекты. Среди них снижение тканевой перфузии вследствие вазоспазма, активация ренин-ангиотензин-альдостероновой системы (РААС), повышение частоты сердечных сокращений (ЧСС), гипертрофия и некрозы миокарда, апоптоз кардиомиоцитов, электрическое ремоделирование с проаритмогенными эффектами, структурное ремоделирование с формированием ХСН. Этот механизм может лежать в основе увеличения сердечно-сосудистой заболеваемости и смертности у больных ХОБЛ [15–17]. Известно, например, что для больных ХОБЛ характерна тахикардия в покое, которая в настоящее время считается независимым фактором риска сердечно-сосудистой заболеваемости и смертности в общей популяции [18].
Таким образом, однозначного ответа на вопрос о приеме ББ у больных ХОБЛ и сопутствующей сердечно-сосудистой патологией до настоящего времени нет, что ставит врача перед довольно непростым выбором.
Если рассматривать эту проблему теоретически, то имеются определенные доводы как за, так и против назначения ББ больным ХОБЛ. Среди аргументов contra можно назвать возможное уменьшение ОФВ1 и бронходилатационного ответа на β2-агонисты, снижение эффективности длительно действующих β2-агонистов, тогда как в пользу применения ББ говорят меньшая выраженность кардиотонического действия эндогенных катехоламинов, связанного с активацией симпатической нервной системы и применением β2-агонистов, снижение интенсивности системного воспаления [19].
Все вышеизложенное побудило к пересмотру наших традиционных представлений о месте и роли ББ в терапии пациентов с ХОБЛ.
ПРИМЕНЕНИЕ БЕТА-БЛОКАТОРОВ У БОЛЬНЫХ ХОБЛ: ДОКАЗАТЕЛЬНАЯ БАЗА
Ввиду того что пациенты с ХОБЛ обычно не включались в рандомизированные плацебо-контролируемые исследования эффективности и безопасности ББ у больных с сопутствующими ССЗ, понимание потенциальной пользы их применения у этой категории больных стало приходить после получения результатов ряда ретроспективных исследований, в которых было показано снижение смертности и уменьшение числа госпитализаций у пациентов с ХОБЛ и ССЗ, получавших как кардиоселективные, так и неселективные ББ [20–25].
Значительный интерес представляют результаты ретроспективного когортного исследования применения ББ у больных ХОБЛ и ССЗ, согласно которым после 4,35 лет наблюдения общая смертность в группе больных, получавших ББ, была на 22% ниже при отсутствии значимого влияния на функцию внешнего дыхания. Кроме того, прием ББ позволил снизить дозу системных глюкокортикостероидов (ГКС) и число госпитализаций, связанных с обострением ХОБЛ, при отсутствии влияния на функцию легких независимо от степени тяжести заболевания [26]. С этими результатами согласуются данные метаанализа 9 ретроспективных когортных исследований о снижении общей смертности у больных ХОБЛ при применении ББ для лечения сопутствующей сердечно-сосудистой патологии [27]. Также показано, что при приеме ББ уменьшается выраженность симптомов, снижается частота и тяжесть неинфекционных обострений ХОБЛ, улучшается переносимость физической нагрузки, снижается смертность, и наоборот, после отмены ББ летальность может возрастать [6, 28].
Отчасти объяснение этим фактам было получено в экспериментальных моделях на животных.
В работах Z. Callaerts-Vegh et al. (2004), L.P. Nguyen et al. (2008) показано, что ББ при систематическом использовании могут уменьшать воспаление, секрецию слизи в дыхательных путях, степень бронхиальной обструкции и улучшать легочную гемодинамику [29, 30].
БЕТА-БЛОКАТОРЫ У ПАЦИЕНТОВ С ХОБЛ И ИБС
ББ служат препаратами выбора у больных ИБС, в том числе после перенесенного ИМ. Однако результаты, полученные М. Egred et al. (2005) в ретроспективном исследовании у больных ХОБЛ, госпитализированных по поводу острого коронарного синдрома, свидетельствуют, что лишь 54% больных при выписке из стационара был рекомендован систематический прием ББ [31]. Эти данные подтверждаются результатами анализа данных Датского национального регистра за период 1995–2015 гг. о том, что ББ получали только 53,2% больных ХОБЛ после перенесенного ИМ [32]. При этом известно, что для больных ХОБЛ с сопутствующей ИБС характерны более высокая смертность, тяжелые и длительные обострения ХОБЛ, высокая степень одышки и сниженная толерантность к физической нагрузке по сравнению с больными, не имеющими сопутствующей сердечно-сосудистой патологии. В свою очередь, наличие ХОБЛ у больных ИБС способствует повышению жесткости артерий и уровня маркеров повреждения миокарда, особенно в период инфекционного обострения ХОБЛ, а хроническая гипоксемия и применение β2-агонистов могут потенцировать снижение кислородного резерва миокарда [33–37].
В исследовании, проведенном J. Сhen et al. (2001), было показано, что прием ББ приводит к снижению смертности в течение первого года после перенесенного ИМ у больных ХОБЛ легкой или средней тяжести [38]. В когортном исследовании, проведенном в Швеции (4858 пациентов с ХОБЛ после перенесенного ИМ), смертность была ниже на 13% в группе, получавшей ББ, по сравнению с больными, не получавшими эти препараты [39]. В другом популяционном когортном исследовании были проанализированы данные 28 097 больных ХОБЛ, госпитализированных с ИМ за период с января 2004 по декабрь 2013 г. Было показано, что в группе пациентов, получавших ББ после перенесенного ИМ, были ниже общая смертность, частота госпитализаций по поводу обострений ХОБЛ и других респираторных заболеваний в течение первого года после выписки из стационара. В результате был сделан вывод о том, что прием ББ ассоциируется со снижением смертности и не увеличивает риск обострений ХОБЛ у пациентом после перенесенного острого ИМ [40].
БЕТА-БЛОКАТОРЫ У БОЛЬНЫХ ХОБЛ И ХСН
В ряде клинических исследований показано снижение смертности в общей популяции пациентов с ХСН, получавших метопролола сукцинат, карведилол, небиволол или бисопролол в комбинации с ингибитором ангиотензинпревращающего фермента (АПФ). ББ предотвращают развитие эффектов, связанных с избыточной адренергической стимуляцией, улучшают систолическую и диастолическую функцию левого желудочка, снижают риск внезапной сердечной смерти. Применение ББ при ХСН со сниженной фракцией выброса (ФВ) в настоящее время является «золотым стандартом» терапии, приводящей к улучшению прогноза [41].
В конце 2018 г. были опубликованы результаты популяционного когортного исследования, проведенного в Италии. В него было включено 51 214 больных с ХСН и обструктивными заболеваниями легких, из которых 11 844 больных (23,1%) получали карведилол и 39 370 (76,9%) – один из кардиоселективных ББ (метопролол/бисопролол/небиволол). Период наблюдения составил 5 лет. Согласно полученным данным, в группе пациентов, получавших карведилол, было статистически достоверно выше число госпитализаций в связи с декомпенсацией ХСН и случаев отмены ББ по сравнению с группой больных, получавших метопролол/бисопролол/небиволол [42].
В исследовании CHARM (Кандесартан при сердечной недостаточности: оценка снижения смертности и заболеваемости), в котором были рандомизированы 7599 пациентов, выживаемость оказалась значительно выше у больных, получающих ББ, независимо от проводимой бронхолитической терапии [43].
Согласно современным клиническим рекомендациям, ББ можно рекомендовать большинству пациентов с ХСН и сопутствующей ХОБЛ. На наш взгляд, учитывая фактор отягощенного течения и повышения риска смертности у этой категории коморбидных пациентов, ББ должны быть рекомендованы всем больным при отсутствии абсолютных противопоказаний к их применению, однако предпочтение следует отдавать препаратам с максимально выраженной β1-селективностью.
БЕТА-БЛОКАТОРЫ У БОЛЬНЫХ ХОБЛ И ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ
В настоящее время ХОБЛ признается фактором риска развития фибрилляции предсердий (ФП) [44]. ФП чаще встречается у больных ХОБЛ, чем в общей популяции, и взаимосвязана с тяжестью бронхообструкции и проаритмогенными эффектами ингаляционной терапии ХОБЛ [45]. Наличие ФП у больных ХОБЛ негативно влияет на исходы, учитывая высокий риск тромбоэмболических осложнений и ремоделирование сердца с развитием сердечной недостаточности.
ББ широко используются при ФП, особенно при постоянной форме, с целью контроля ЧСС.
В рекомендациях Европейского общества кардиологов (ESC) по ведению ФП сделан вывод об эффективности и безопасности применения селективных ББ у больных ХОБЛ и ФП [44].
ВЛИЯНИЕ БЕТА-БЛОКАТОРОВ НА ФУНКЦИОНАЛЬНЫЕ ПОКАЗАТЕЛИ ЛЕГКИХ И ТЕЧЕНИЕ ХОБЛ
Как уже было сказано выше, основной причиной, по которой ББ не назначаются пациентам с ХОБЛ и ССЗ, являются опасения врачей, связанные с безопасностью применения этой группы препаратов при бронхообструктивных заболеваниях.
С 80–90-х гг. ХХ в. проведено большое число исследований, свидетельствующих о хорошем профиле безопасности ББ в этой группе больных. В связи с этим большой интерес представляют результаты немногочисленных проспективных рандомизированных контролируемых исследований.
В исследовании, проведенном A. Camsari et al. (2003), не выявлено значимого снижения ОФВ1 у 50 пациентов с артериальной гипертензией (АГ) и ХОБЛ разной степени тяжести, среди которых был 21 пациент с тяжелой ХОБЛ, при применении максимальных доз метопролола [46]. При сравнительной оценке безопасности неселективных и кардиоселективных ББ в исследовании эффективности и безопасности метопролола, бисопролола и карведилола у больных ХОБЛ и ХСН было показано, что наиболее выраженное угнетение функции внешнего дыхания (ФВД) вызывает карведилол [47]. В исследованиях пожилых больных ХОБЛ и ХСН частота неблагоприятных побочных реакций, таких как снижение ОФВ1 и бронхоспазм, также была выше при приеме карведилола по сравнению с бисопрололом. Использование бисопролола в этих исследованиях сопровождалось не только меньшей частотой неблагоприятных побочных реакций, но и значимым повышением ОФВ1 [48]. В то же время есть противоположные данные о том, что у пожилых пациентов с ХСН и ХОБЛ, а также у больных с тяжелой ХОБЛ прием бисопролола может приводить к снижению ОФВ1 в сравнении с плацебо [49].
В проспективном исследовании, проведенном S.P. Bhatt et al. (2016), оценивалась частота всех обострений и тяжелых обострений у 3464 пациентов с ХОБЛ, получавших ББ (средний период наблюдения – 2,1 лет). В нем были получены данные о статистически значимом снижении общей частоты обострений (IRR 0,73; 95% CI 0,60 to 0,90; p=0,003) и тяжелых обострений (IRR 0,67, 95%CI 0,48 to 0,93; p=0,016) в этой группе пациентов. Особенно интересно, что аналогичные результаты были получены в подгруппах пациентов с тяжелой ХОБЛ, получавших длительную кислородную терапию (GOLD III–IV) [50]. Эти результаты согласуются с полученными ранее результатами исследования применения ББ у больных ХОБЛ и ХСН или ИБС [51].
В отличие от этих данных, в исследовании N.M. Hawkins et al. (2009) бисопролол не влиял на частоту обострений ХОБЛ у пожилых больных, но ухудшал показатели ФВД [49]. Показательны результаты исследования влияния приема ББ у больных ХОБЛ и сопутствующими ССЗ в период госпитализации по поводу обострения ХОБЛ, в котором было показано, что ББ не влияют на госпитальную летальность и частоту повторных госпитализаций в течение 30 дней после выписки из стационара. Вместе с тем при анализе данных в зависимости от селективности препаратов оказалось, что прием неселективных ББ чаще приводит к повторным госпитализациям [13].
СОЧЕТАННОЕ ПРИМЕНЕНИЕ БЕТА1-БЛОКАТОРОВ И БЕТА2-АГОНИСТОВ У БОЛЬНЫХ ХОБЛ И ССЗ
Именно проблема сочетанного применения препаратов с заведомо противоположными эффектами у одного и того же пациента и представляла до последнего времени камень преткновения для широкого использования ББ у больных ХОБЛ.
В этом контексте важен вопрос о влиянии одновременного применения ББ и β2-агонистов на течение как ХОБЛ, так и ССЗ.
Длительно действующие β2-агонисты (ДДБА) и длительно действующие антихолинергические препараты (ДДАХ) в режиме моно- или комбинированной терапии служат основными лекарственными средствами базисной терапии ХОБЛ [2]. Однако необходимо помнить, что ДДБА не обладают абсолютной селективностью в отношении β2-адренорецепторов бронхов и могут влиять на работу сердца, повышая силу, частоту сердечных сокращений и соответственно потребность миокарда в кислороде. В ряде исследований изучались эффекты ДДБА и ДДАХ у больных ХОБЛ с сопутствующими ССЗ. Так, в исследовании FLAME при сравнении влияния двух режимов терапии (индакатерол + гликопирроний и сальметерол + флутиказон) на частоту обострений ХОБЛ не было выявлено значимого влияния исследуемых препаратов на сердечно-сосудистую смертность или сократительную функцию миокарда, что подтверждает данные о хорошем профиле безопасности комбинаций ДДБА + ДДАХ [52].
В 2015–2016 гг. были опубликованы результаты нескольких систематических обзоров и метаанализов, посвященных данной проблеме. При оценке профиля безопасности моно- или комбинированной терапии ДДБА и ДДАХ у больных с сопутствующей сердечно-сосудистой патологией не было выявлено статистически достоверных различий профиля безопасности между применением ДДБА/ДДАХ в режиме моно- или комбинированной терапии, показана эффективность и безопасность двойной бронходилатации у данной категории пациентов [53–55]. Однако, анализируя эти данные, нужно обязательно помнить, что в большинстве исследований формировалась достаточно селективная популяция пациентов, не включавшая больных с тяжелым течением сопутствующей сердечно-сосудистой патологии, а это может не отражать в достаточной степени ситуацию в реальной клинической практике.
В метаанализе, проведенном V. Petta et al. (2017), показано, что прием кардиоселективных ББ и ДДБА у больных ХОБЛ и ССЗ снижает смертность и частоту обострений [56].
Согласно M.T. Dransfield et al. (2018), анализ данных 16 485 пациентов из исследования SUMMIT, получавших ББ и ингаляции флутиказона фуроата, вилантерола, комбинации флутиказон + вилантерол или плацебо, позволяет говорить об отсутствии неблагоприятного влияния на течение ХОБЛ или повышения сердечно-сосудистых рисков у пациентов, получавших одновременно ББ и ДДБА [57].
СИНЕРГИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ БЕТА1-БЛОКАТОРОВ И БЕТА2-АГОНИСТОВ
В работе B. Rinaldi et al. на модели мышей с сердечной недостаточностью показано, что повышенные уровни плазменного адреналина стимулируют десенсибилизацию β2-адренорецепторов через GPRK2 (G-белок, связывающий рецептор киназы 2 путем фосфорилирования). Это ведет к аресту и интернализации β2-адренорецептора и значительному ослаблению релаксации дыхательных путей – эффекту, который восстанавливался при лечении метопрололом [58]. Те же исследователи подтвердили, что совместное введение β2-агониста и β1-блокатора может влиять на ремоделирование сердца. Так, лечение индакатеролом или метопрололом значительно уменьшало размер инфаркта у крыс с сердечной недостаточностью по сравнению с нелеченой контрольной группой. Комбинация индакатерола и метопролола приводила к снижению артериального давления, ЧСС, улучшала фракцию выброса, нормализовала систолический и диастолический размеры левого желудочка [59].
Эти данные хорошо вписываются в гипотезу М. Khan et al., согласно которой одновременная синергетическая стимуляция β2-адреноцептора и блокада β1-адреноцептора может быть эффективной для увеличения прогениторных клеток сердца при пораженном сердце. Это потенциально прокладывает путь для нового терапевтического подхода к лечению ХСН [60].
Также высказывается предположение, что снижение симпатического тонуса и up-регуляция β2-адренорецепторов в легких могут быть теми механизмами, с помощью которых ББ проявляют положительные легочные эффекты у больных ХОБЛ в долгосрочной перспективе [61]. Длительное применение ББ позволяет увеличить количество β2-адренорецепторов в легких и тем самым снизить потребность в β2-агонистах [62].
Метаанализ S. Salpeter et al. (2005) показал, что неселективные ББ уменьшают, а кардиоселективные улучшают эффект бронходилатации β2-агонистов вследствие сверхрегуляции β2-рецепторов [63]. Постоянное использование ББ повышает чувствительность β2-адренорецепторов к дальнейшей стимуляции посредством увеличения их плотности в целевых тканях. В результате ББ могут даже улучшать эффективность β2-агонистов во время обострения посредством потенцирования бронходилатационных эффектов. Этот парадоксальный терапевтический механизм еще широко не исследован [56 64]. Механизмы синергического взаимодействия ББ и β2-агонистов представлены на рисунке.
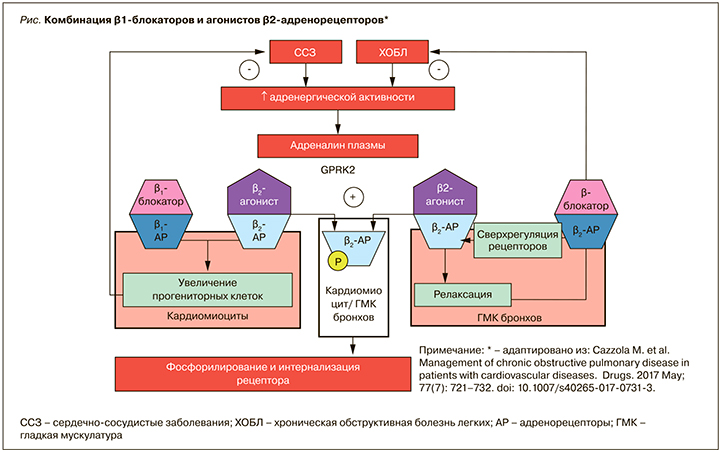
Таким образом, баланс положительных и отрицательных эффектов ББ у больных ХОБЛ явно смещается в пользу применения препаратов этой группы. Однако до настоящего времени большой проблемой остается недостаточное число данных, полученных в проспективных рандомизированных исследованиях: в большинстве случаев это непродолжительные исследования с использование малой выборки.
ЗАКЛЮЧЕНИЕ
Согласно GOLD-2019, больные ХОБЛ с сопутствующими ССЗ должны получать лечение в соответствии с рекомендациями по терапии ССЗ вне зависимости от степени тяжести ХОБЛ. Это касается и назначения ББ. Однако, учитывая, что влияние ББ на течение ХОБЛ до конца не изучено, мы считаем необходимым придерживаться определенных правил применения этой группы препаратов в лечении коморбидных пациентов.
Наиболее безопасным является применение кардиоселективных ББ без внутренней симпатомиметической активности – метопролола, бисопролола, небиволола. Стартовую терапию следует начинать с минимальной эффективной дозы препарата, далее проводить медленное титрование дозировки до оптимальной с точки зрения эффективности и безопасности. Основными критериями оценки безопасности следует считать выраженность одышки, кашля, переносимость физической нагрузки, потребность в бронхолитиках короткого действия, а также результаты исследования ФВД в динамике. Предпочтительным, на наш взгляд, является временной шаг титрования 7–14 дней [65–68].
В целом можно обозначить следующие принципы использования ББ при ХОБЛ:
- селективные β1-блокаторы (метопролол, бисопролол, небиволол) демонстрируют дозозависимую способность блокировать β2-адренорецепторы;
- неселективный ББ карведилол чаще вызывает бронхоспазм, чем селективные β1-блокаторы;
- оправданна медленная титрация дозы β1-блокаторов с 1–2-недельным интервалом до достижения поддерживающей дозы;
- медленный темп титрации с мониторированием потенциальных побочных эффектов особенно актуален для пожилых пациентов с коморбидной патологией и во время обострений;
- использование ДДАХ может предупреждать потенциальные бронхоспастические реакции.
Для окончательного решения вопроса эффективности и безопасности применения ББ у пациентов с ХОБЛ и ССЗ необходимо проведение хорошо спланированных проспективных рандомизированных клинических исследований.


