Важная тенденция современности – растущий интерес к фоновой патологии, влекущей за собой особенности разрушения кости, а также регенерации костной ткани в различных условиях. При остеопорозе сроки регенерации костной ткани значительно превышают сроки реабилитации без патологии кости. По мнению ряда исследователей, остеопороз приобрел характер безмолвной эпидемии. Реального учета остеопороза, а также установленной его классификации нет, притом что эта патология затрагивает 75 млн граждан Европы, США и Японии. К 2050 г. ожидается рост количества остеопоротических переломов шейки бедренной кости с 500 тыс. до 1 млн случаев ежегодно. Это объясняется преобладанием деструктивных процессов на фоне ослабленной остеобластической реакции при остеопорозе, сохранением воспалительной реакции и разрастанием соединительной ткани [1, 5, 9, 11].
Здесь можно выявить второй тренд последнего времени: наряду со стандартными вопросами механизма и давности образования перелома появились вопросы, касающиеся медицинской помощи, а именно качества оказанных медицинских услуг. Неудовлетворительные результаты лечения, с одной стороны, могут приводить к костной нестабильности с формированием ложного сустава, с другой – к формированию остеогенной контрактуры [2, 3, 8, 12]. В таких случаях к уже установленному временному нарушению функции – длительному расстройству здоровья – присоединяется стойкая утрата общей трудоспособности [4, 8].
Отмечается стремительное увеличение экспертиз, в которых оценивается ухудшение состояния здоровья человека, обусловленное дефектом оказания медицинской помощи, а также вызванное, помимо характера и тяжести травмы, возрастом и сопутствующей патологией (пп. 25 и 24 Медицинских критериев соответственно) [4, 6, 7, 10].
Исходя из этого, целью нашего исследования стало изучение характера и динамики процессов деструкции и регенерации костной ткани при повреждениях в различных условиях с последующей судебно-медицинской оценкой.
С учетом цели были определены главные задачи исследования:
- определить особенности репарации костной ткани на фоне сопутствующей патологии;
- изучить характер патологических процессов при длительной статической фиксации в области перелома.
МАТЕРИАЛ И МЕТОДЫ
Для решения первой задачи нами были исследованы 46 случаев смерти лиц, пострадавших при ДТП, находящихся на стационарном лечении и погибших в разные сроки от момента получения травмы. При этом во всех случаях погибшие были старше 60 лет и имели явные признаки остеопороза возрастного типа.
Полученный секционный материал фиксировался в 10% формалине и 5% растворе трихлоруксусной кислоты. Раствор трихлоруксусной кислоты использовали как фиксатор и декальцинирующую жидкость, при этом учитывались некоторые изменения, возникающие в тканях, т.е. резкое набухание коллагеновых структур. Декальцинация проводилась 0,1% нормальным раствором соляной кислоты на физиологическом растворе. Проверка на готовность определялась, когда под воздействием пальцев кусочек легко гнулся. После декальцинации кусочек отмывался от кислоты, и проводилась нейтрализация остаточной кислоты.
Парафиновые срезы, приготовленные по стандартной методике, окрашивались гематоксилином и эозином.
Во второй части исследования исследовался биопсийный материал от 72 пациентов, которым после комплексного клинико-инструментального исследования с учетом степени дегенарции были проведены декомпрессивно-стабилизирующие вмешательства на поясничном отделе позвоночника. В процессе оперативного доступа проводилась полная и частичная фасетэктомия на уровне поражения. Критериями включения в группы исследования служили неэффективная консервативная терапия, длительный рецидивирующий болевой синдром, стойкий неврологический дефицит, отсутствие признаков сегментарной нестабильности, одноуровневая и двухуровневая дегенерация дисков II–V степени (Pfirrmann) по данным нейровизуализации.
Парафиновые среды окрашивались гематоксилином и эозином, пикрофуксином по Вангизон, отдельные среды окрашивались ШИК-методом и альциановым синим. Препараты просматривались в световом микроскопе, в необходимых случаях осуществлялось цифровое микрофотографирование. Проводилась стандартная морфометрия.
Статистическая обработка полученных данных проводилась методами вариационной статистики с использованием стандартных пакетов Microsoft Excel 2008, Statistica 12.0, Biostat. При создании базы данных использовался редактор электронных таблиц MS Exel, 1С. В случае отличного от нормального типа распределения использовались непараметрические критерии. Статистическое измерение связи (силы и направления) между признаками проводились с помощью вычисления коэффициента корреляции рангов Спирмена (rs) с последующей оценкой диагностической значимости (критерии информативности: чувствительность (Se) и специфичность (Sp)).
Расчет объема выборки проводился по формуле Лера для мощности 80% и двухстороннего уровня значимости 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
 Как правило, процесс регенерации костной ткани проходит определенные фазы.
Как правило, процесс регенерации костной ткани проходит определенные фазы.
В группе лиц старше 60 лет с рентгенологическими признаками остеопороза процесс регенерации проходит определенные основные фазы, однако сопровождается рядом особенностей.
Так, в первую фазу регенерации наблюдаются явления воспалительной реакции с диффузным распределением лейкоцитов. Начальные этапы восстановительного процесса выражаются в костеобразовании на границе сохранившихся структур. Остальная часть дефекта в этот период заполнена соединительной тканью. Большое количество расположенных здесь сосудов микроциркуляторного русла обеспечивает проникновение периваскулярных клеток, способных дифференцироваться в клетки остеобластического дифферона.
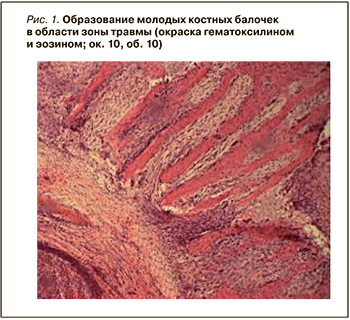
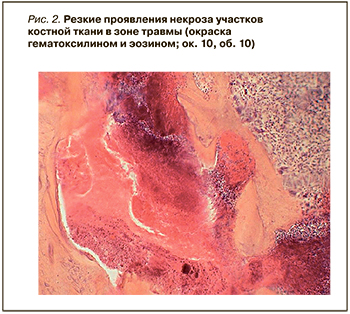 В интервале 12–17 сут видно образование молодых костных балочек в области зоны травмы, а промежутки между ними заполнены рыхлой тканью, богатой разнообразными клеточными элементами (рис. 1). Дефект, заживающий под кровяным сгустком, полностью не заполнялся регенерирующей костной тканью в течение 30 сут. Регенерация шла медленнее. Сохранялся некроз участков костной ткани в зоне травмы, а также изменения тинкториальных свойств сохранившейся кости. В некоторых участках наблюдалась резкая базофилия, также заметно скопление лейкоцитов в центре зоны травмы, что говорит о сохраняющихся явлениях воспаления (рис. 2).
В интервале 12–17 сут видно образование молодых костных балочек в области зоны травмы, а промежутки между ними заполнены рыхлой тканью, богатой разнообразными клеточными элементами (рис. 1). Дефект, заживающий под кровяным сгустком, полностью не заполнялся регенерирующей костной тканью в течение 30 сут. Регенерация шла медленнее. Сохранялся некроз участков костной ткани в зоне травмы, а также изменения тинкториальных свойств сохранившейся кости. В некоторых участках наблюдалась резкая базофилия, также заметно скопление лейкоцитов в центре зоны травмы, что говорит о сохраняющихся явлениях воспаления (рис. 2).
Даже на 30 сут сохраняются деструктивные процессы и ослабленная остеобластическая реакция на фоне снижения интенсивности развития сосудов. Нередко видны многоядерные остеокласты в участках кости, расположенных вблизи зоны воспаления.
Вторая фаза регенерации, характеризующаяся активным процессом построения костной ткани в зоне дефекта, в норме наблюдается в интервале 26–34 сут. В зоне дефекта костные балочки располагаются на сохранившихся костных структурах и окружены остеобластами с резко базофильной цитоплазмой. На фоне сопутствующей патологии эта фаза наблюдается позже (в интервале 54–65 сут) и пересекается с 3-й фазой репаративного процесса, когда начинает снижаться содержание в межбалочковых промежутках кровеносных сосудов. По ходу балок новообразованной кости встречаются многоядерные остеокласты, лежащие в лакунах, что говорит о перестройке костной ткани одновременно с ее формированием.
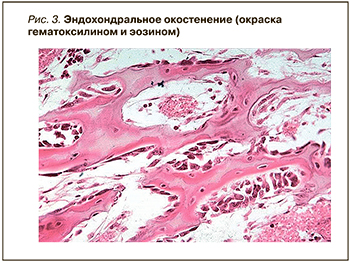 В этот период формируется эндостальная мозоль с функционально неполноценной связью и наличием небольшого количества грубоволокнистых костных структур. В участках, где отломки были соединены кровяным сгустком значительной величины, срок образования костной мозоли удлиняется, и соединение отломков происходит за этот период времени только за счет остеогенной клеточно-волокнистой ткани. В последующем в ней формируются и костные структуры (рис. 3).
В этот период формируется эндостальная мозоль с функционально неполноценной связью и наличием небольшого количества грубоволокнистых костных структур. В участках, где отломки были соединены кровяным сгустком значительной величины, срок образования костной мозоли удлиняется, и соединение отломков происходит за этот период времени только за счет остеогенной клеточно-волокнистой ткани. В последующем в ней формируются и костные структуры (рис. 3).
Сформировавшаяся через 6 нед провизорная грубоволокнистая костная мозоль перестраивается, т.е. рассасывается, и на ее месте появляются зрелые пластинчатые костные структуры соответственно линиям натяжения и давления.
В таких условиях формирование провизорной грубоволокнистой костной мозоли проходит очень медленно, либо она полностью не формируется, что приводит к нестабильности кости и высокому риску повторной травматизации при незначительной внешней силе либо к формированию ложного сустава.
Вторая часть исследования включала изучение особенностей репарации при статической фиксации.
В ранние сроки при гистологическом исследовании биоптатов была обнаружена сохранность зональной структуры хряща; исключение составила бесклеточная пластинка, разрушенная на части поверхности хряща. В двух случаях бесклеточная пластинка была разрушена, и края хряща представлены фибриллярными участками. Вытянутые эллиптической формы лакуны содержали 1–3 хондроцита с крупными гиперхромными ядрами. Морфологический анализ выявил статистически достоверное увеличение объемного содержания хондроцитов в поверхностной зоне. Увеличение плотности происходило за счет существенного увеличения 3- и 4-клеточных лакун при одновременном снижении числе одноклеточных лакун (рис. 4).
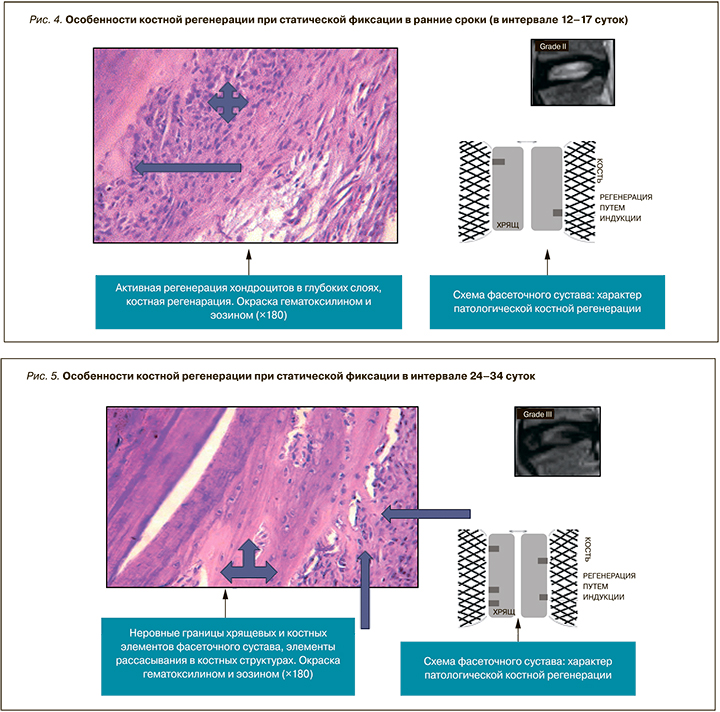
На следующем этапе выявлены полное разрушение бесклеточной пластинки и очаги поверхностного расщепления матрикса. Большинство лакун содержало 1–2 хондроцита. Морфологически обнаружено статистически достоверное уменьшение объемной плотности клеток.
В некоторых случаях узуры и очаги разволокнения захватывали всю поверхностную зону, которая сохранялась на небольших участках. Большинство хондроцитов сохранившейся поверхностной зоны имело пикнотичные ядра.
Большинство хондроцитов располагалось в лакунах округлой формы по 1–2. При морфологическом исследовании установлено существенное увеличение объемного содержания хондроцитов в промежуточной зоне как за счет увеличения числа 2- и 3-клеточных лакун, так и вследствие появления клонов (рис. 5).
В позднем периоде морфологические исследования выявили стертость зональности хрящевой ткани. В остальных участках промежуточной зоны определялись лакуны, содержащие 1–3 хондроцита и скопления из 4–6 клеток. Половина клеток имела пикнотичные ядра. Объемное содержание хондроцитов в остатках промежуточной зоны существенно снижалось. Увеличение клеточной плотности связано с увеличением доли 3- и 4-клеточных лакун и появлением 4–6-клеточных скоплений (рис. 6).
У этой категории пациентов костные балки в одних местах становились деформированными и неровными, в других местах истонченными. Местами отмечалось появление разрушения и лизиса твердой костной ткани в виде дефекта и просветления костных балок. В толще костных балок увеличились очаги базофильного окрашивания за счет неравномерного распределения кальция, а также хондроматозного перерождения.
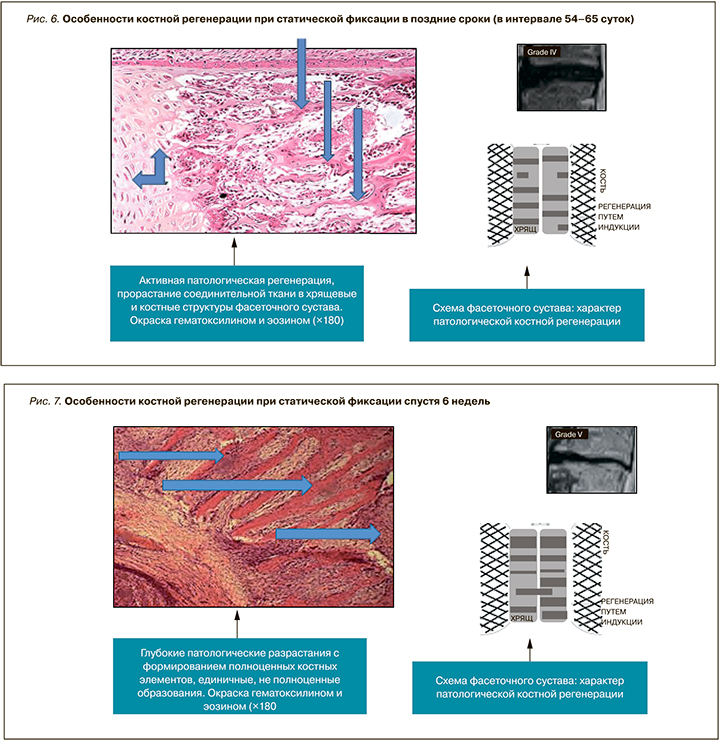
В дальнейшем отмечалось развитие в костной ткани атрофических и деструктивных изменений. При этом дистрофические и атрофические изменения распространялись со стороны проксимального отдела в сторону дистального. Компактные костные пластинки были неравномерно обызвествленные, особенно в краевых зонах, более слабые, иногда с остеокластами на поверхности. Встречались балочки с наслоениями остеоида. Наблюдались также участки, заполненные рыхловолокнистой тканью, иногда очаги миксоматозного характера (рис. 7).
По ходу всех костных пластинок появились очаги бесклеточного просветления с наличием отрывков костной ткани и кальцинатов. Между компактными костными пластинками большая площадь захвачена рыхлой волокнистой соединительной тканью. Единичные клетки, находящие в толще соединительной ткани, были хондробластического или макрофагального вида, волокнистые структуры расположены хаотично и между собой переплетены, формируя относительно толстые волокнистые пучки.
ЗАКЛЮЧЕНИЕ
В исследовании установлены критерии фоновой патологии, такой как остеопороз, на которые можно опираться при оценке переломов в рамках проведения судебно-медицинских экспертиз по материалам дел. Результаты исследования костной ткани в случаях с различным фоновым состоянием показали развитие последовательных дистрофических, деструктивных и атрофических изменений с расширением гаверсовых каналов, развитием в них грануляционной ткани и появлением воспалительной инфильтрации, изменений в виде хондроматозного перерождения и неравномерного кальциноза. Со стороны гаверсовых каналов нарастало разрастание волокнистой соединительной ткани в виде фиброзной дисплазии кости.
Таким образом, на фоне сопутствующей патологии значительно увеличиваются сроки регенерации костной ткани с одной стороны. Возможно формирование ложного сустава в зоне перелома. Это объясняется преобладанием деструктивных процессов на фоне ослабленной остеобластической реакции при остеопорозе, сохранением воспалительной реакции и разрастанием соединительной ткани.
При этом сопутствующая фоновая патология, наряду с некачественно оказанными медицинскими услугами, может привести к усилению отложения ионов кальция, оссификации и формированию контрактуры.
Одна из задач судебно-медицинской экспертизы – оценка причиненного вреда здоровью. И в части случаев судебно-медицинские эксперты определяют вред здоровью при переломах костей на фоне системного остеопороза как средний и даже тяжкий, что, на наш взгляд, глубоко сомнительно и может повлечь за собой судебную ошибку.
Дефекты оказания медицинской помощи отражаются на сроках репарации, могут влиять на длительность реабилитации, приводить к стойкой утрате трудоспособности, что также может сказаться на выводах судебно-медицинской экспертизы.
Фактически остеопороз никогда не подвергался оценке при производстве судебно-медицинских экспертиз и остается заболеванием, не оцененным в юридических аспектах (судебные приговоры, решения и т.п.). Мы полагаем, что верифицированный системный остеопороз, обязательно подтвержденный рентгенологическим исследованием, на фоне которого произошел перелом, по сути своей являющийся патологическим переломом, в соответствии с п. 24 Приказа № 194н «Об утверждении медицинских критериев определения степени тяжести вреда, причиненного здоровью человека» не должен рассматриваться как причинение вреда здоровью в полной мере.


