Среди болезней костно-мышечной системы остеоартрит (ОА) занимает лидирующее место по распространенности, поражая около 10% мужчин и 18% женщин во всем мире, являясь одной из основных причин ухудшения качества жизни, боли и инвалидности среди населения старшего возраста [1–3]. В России его частота составляет 3646,3 на 100 тыс. взрослого населения, при этом уровень заболеваемости неуклонно возрастает [4].
К сожалению, ОА чаще всего диагностируется только при наличии клинических проявлений, характерных для выраженных морфологических изменений в хряще, тогда как раннее выявление деструктивно-дистрофических поражений сустава остается большой проблемой. В связи с этим необходимы новые подходы к диагностике заболевания; особое значение имеет поиск предиктивных маркеров, которые позволят выявить предрасположенность к заболеванию, возможно, на самых ранних этапах жизни человека.
Роль генетической предрасположенности к ОА начала исследоваться сравнительно недавно. Близнецовые и семейные исследования показали, что распространенность наследственного компонента ОА варьирует от 40 до 70% в зависимости от локализации пораженного сустава [4]. Однако на сегодня в исследовании генетической предрасположенности ОА существует ряд методологических проблем, связанных с неоднородностью данных, малым количеством репликативных исследований, низкой статистической мощностью и проблемой классификации эндофенотипов ОА, которые не позволяют получить достоверно значимые воспроизводимые ассоциации на независимых выборках.
Существует много факторов, предрасполагающих к развитию ОА, включая возраст, женский пол, этническую принадлежность, травмы, высокий индекс массы тела. При этом ни один из них не определяет 100%-ную вероятность развития заболевания, в связи с чем большой интерес представляет изучение молекулярно-генетических механизмов развития ОА и выявление прогностически значимых генетических маркеров заболевания с целью ранней пресимптоматической диагностики.
К числу факторов риска развития ОА, вероятно, относится недифференцированная дисплазия соединительной ткани (нДСТ) – полиорганная патология, которая характеризуется нарушением строения и функций межклеточного вещества соединительной ткани, что патогенетически сближает ее с ОА [5, 6].
Частота встречаемости ДСТ, по разным данным, колеблется от 10 до 22,5% [7]. НДСТ может рассматриваться как фоновое состояние, способствующее развитию ОА, так как в основе патогенеза ОА и нДСТ лежат изменения деструктивного характера в структуре соединительной ткани, в том числе и в суставном хряще. Считается, что у 10–22,5% населения мира встречаются фенотипические признаки нДСТ различной выраженности, не укладывающиеся в структуру наследственных синдромов [8], которые, как правило, носят прогрессирующий характер и лежат в основе формирования значительного числа соматической патологии, ухудшая прогноз основного заболевания [9].
Благодаря технологии полногеномного анализа ассоциаций (GWAS) сегодня выявлено 56 полиморфных локусов, локализованных в 50 генах и ассоциированных с ОА в европейских и азиатских популяциях. Их вклад в развитие патологи варьируется в зависимости от тяжести заболевания, локализации патологического процесса, гендерных различий и этнического фактора [10].
Нами проведено изучение локусов с наибольшим уровнем значимости, отобранных по результатам анализа GWAS-исследований, которые включают генетические варианты вблизи генов с неизвестной ролью в патогенезе артрозов и хромосомные участки с неизвестными генами для репликативных исследований у женщин Республики Башкортостан. Среди них локусы:
- rs4836732 (ASTN2, р=6,11*10–10);
- rs1298744 и rs2302061 в гене гистоновой метилтрансферазы (DOT1L, р=1,1*10–11);
- rs3204689 гена альдегиддегидрогеназы (ALDH1A, р=21,1*10–11/8,6*10–11);
- rs6976 в гене гликозилтрансферазы-8 (GLT8D1, р=7,24*10–11);
- rs11177 в гене нуклеостемина (GNL3, р=1,25*10–10);
- rs6094710 в гене коактиватора ядерного рецептора (NCOA3, р=7,9*10–9);
- rs11841874 фактор обмена гуанина (MCF2L, р=2*10–8);
- rs7639618 в гене, кодирующем домен фактора фон Виллебранда (DVWA, р=7,3*10–8) [11–15].
Несмотря на полученные ассоциации указанных локусов с ОА на выборках европейских и/или азиатских популяций, остается открытым вопрос о прогностической значимости этих ассоциаций для популяций Волго-Уральского региона со сложной генетической структурой, в генофонде которых имеются как европеоидный, так и монголоидный компонент. Также требует изучения их роль в проявлении признаков нДСТ как в сочетании с ОА, так и без него.
Цель исследования – изучить ассоциации полиморфных вариантов rs4836732 (ASTN2), rs1298744 и rs2302061 (DOT1L), rs3204689 (ALDH1A2), rs6976 (GLT8D1), rs11177 (GNL3), rs6094710 (NCOA3), rs11841874 (MCF2L), rs7639618 (DVWA) с формированием предрасположенности к ОА у женщин из Республики Башкортостан, учитывая локализацию патологического процесса, возраст дебюта заболевания и наличие признаков нДСТ как в коморбидном, так и изолированном состояниях.
МАТЕРИАЛ И МЕТОДЫ
Материалами для исследования послужили образцы ДНК 317 женщин в возрасте от 18 до 86 лет (средний возраст 51,67±11,5 лет), обследованных на наличие признаков нДСТ и ОА в терапевтическом отделении Городской клинической больницы № 18, а также в поликлиниках № 2, 18, 38 г. Уфы. Группу женщин с ОА составили 156 женщин, среди них гонартроз был диагностирован у 81 пациентки (51,9%), полиартроз – у 38 (24,4%) и коксартроз – у 37 (23,7%). Исследование было одобрено биоэтическими комитетами Башкирского государственного медицинского университета и Института биохимии и генетики УФИЦ РАН, все пациенты подписали информированное согласие на участие в исследовании в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения медицинских исследований с участием человека в качестве субъекта».
Симптомокомплекс нДСТ был выявлен у 228 человек: у 149 (65,4 %) – легкой степени, у 67 (29,4 %) – выраженной степени. НДСТ оценивалась в баллах по критериям Т.И. Кадуриной (2007). Критериями исключения из исследования были онкологическая патология, системные заболевания соединительной ткани, признаки активного воспалительного процесса как инфекционной, так и неинфекционной этиологии. Этнический состав выборки был следующим: 44% – женщины русского, 34% – татарского, 8% – башкирского происхождения, 14% – метисы и представители других этносов.
Для валидации полученных нами ассоциаций была сформирована независимая выборка женщин из 100 человек в возрасте от 37 до 68 лет (средний возраст 57,02±7,3 лет) с диагнозом ОА, среди которых 53 страдали гонартрозом, 16 – коксартрозом, 21 – полиартрозом. НДСТ была диагностирована у 77 человек: у 38 женщин – легкой степени, у 39 – выраженной степени. По этнической принадлежности выборку составили башкиры (3%), татары (37%), русские (27%) и другие этносы (33%).
ДНК выделяли из периферической крови методом фенольно-хлороформной экстракции. Генотипирование осуществлялось с использованием технологии конкурентной аллель-специфичной ПЦР – KASP® (LGC-Genomics) и системы для проведения ПЦР в режиме реального времени QuantStudio 12K Flex Real-Time PCR System (Thermo Fisher Scientific). Статистическая обработка полученных данных проводилась на основании общепринятых методов описательной и вариационной статистики с использованием стандартных пакетов Microsoft Excel 2007 и Statistica 6.0. Степень ассоциаций оценивали в значениях показателя отношения шансов (odds ratio, OR).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам сравнительного анализа распределения частот аллелей и генотипов исследованных полиморфных локусов нами был получен ряд ассоциаций (табл.).
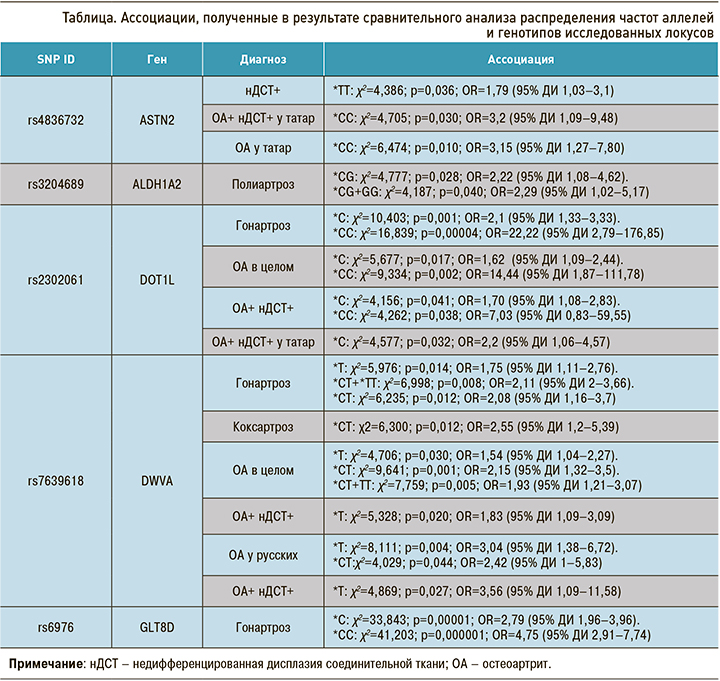
Полученные нами результаты показывают, что локусы, наиболее значимые для развития ОА, по данным GWAS-исследований, также значимы для формирования фенотипа ОА различных локализаций (в том числе в сочетании с признаками нДСТ), однако в этом аспекте есть ряд особенностей.
В исследованной нами выборке генотип *СС локуса rs4836732 гена ASTN2, минорный аллель *С которого был ассоциирован с тотальной заменой тазобедренного сустава у европейских женщин [12], статистически значимо преобладал в выборке женщин с ОА (0,608), а также у пациенток татарской этнической принадлежности, имеющих ОА в сочетании с признаками нДСТ (0,632), по сравнению с группой контроля (0,393 и 0,400) соответствующей этнической категории. Однако противоположный аллель *Т данного локуса rs4836732 был ассоциирован с нДСТ в общей выборке. Установлено, что продукт гена ASTN2 представляет собой регуляторный белок, осуществляющий транспорт синаптических молекул, и экспрессруется главным образом в мозге, в связи с чем его функцию в биологии хрящевой ткани еще только предстоит выяснить [16].
По результатам анализа локуса rs3204689 гена ALDH1A2, кодирующего альдегиддегидрогеназу (фермент, участвующий метаболизме ретиноевой кислоты [17]), выявлена ассоциация генотипа *CG с полиартрозом у женщин в общей выборке, что также сопоставимо с полногеномными данными, где аллель *С ассоциирован с ОА рук у женщин [12]. C. Shepherd et al. (2018) продемонстрировали, что нокаут гена ALDH1A2 in vivo понижал экспрессию ряда генов хондрогенеза, среди которых ген транскрипционного фактора-9 (SOX9; р=0,002), аггреканазы-5 (ADAMTS5) и аггрекана ACAN; это свидетельствует о значимости этого гена в регуляции гомеостаза хрящевой и костной ткани [18].
Также нами исследовано два полиморфных локуса rs2302061 и rs12982744, локализованных в гене гистоновой метилтрансферазы (DOT1L), продукт которого экспрессируется в зрелых хондроцитах человека и, вероятно, играет роль в их дифференцировке [13]. Локус rs2302061 этого гена показал ассоциации с ОА в целом, а также с гонартрозом, однако неизвестно об ассоциациях этого локуса в других популяциях. При этом распределение частот аллелей и генотипов полиморфного локуса rs12982744 оказалось сопоставимым в группах больных и контроля.
Другой исследованный локус rs7639618 локализован в гене DVWA, детерминирующем образование домена фактора фон Виллебранда. Продукт этого гена связывается с β-тубулином [14] и экспрессируется в суставной ткани независимо от наличия патологического процесса, что подтверждает функциональную роль белкового продукта в внутриклеточном транспорте хондроцитов [19]. По результатам анализа этого локуса аллель *Т продемонстрировал ассоциацию с ОА в целом, гонартрозом и коксартрозом, тогда как, по данным GWAS, определена ассоциация аллеля *G с ОА коленного сустава (p=7,3×10−11) у азиатов. Полученные нами данные могут свидетельствовать о различиях в генетической структуре изученных популяций и разнонаправленной адаптации к различающимся средовым факторам.
По результатам полногеномных исследований, у лиц европейского происхождения аллель *Т локуса rs6976 (GLT8D1) ассоциирован как с коксартрозом, так и с гонартрозом (p=7,2×10−11) [19, 12], однако, по результатам наших исследований, противоположный аллель *С показал ассоциацию с гонартрозом (см. табл.). Это также отражает необходимость изучения генетических маркеров с учетом этнической структуры популяций.
При рассмотрении локусов rs6094710 (NCOA3), rs11177 (GNL3), rs11841874 (MCF2L) не было получено статистически значимых различий в распределении частот аллелей и генотипов между пациентками с ОА в целом, пациентками с различными локализациями ОА и группой контроля у женщин из Республики Башкортостан, и мы не подтвердили полученные ранее ассоциации.
Для подтверждения полученных нами закономерностей мы сформировали независимую выборку женщин с ОА и подтвердили следующие полученные нами ассоциации:
- ассоциацию генотипа *СС локуса rs2302061 (DOT1L) с ОА позднего начала (50–65 лет) (χ2=7,128; p=0,000001; OR=4,27; 95% ДИ 2,7-7,03);
- ассоциацию генотипов *TT+*CT локуса rs7639618 (DVWA) с ОА у женщин в общей выборке (χ2=6,816; p=0,009; OR=2,27; 95% ДИ 1,22–4,22), с коксартрозом (p=0,0007; OR=6,9), гонартрозом (p=0,00005; OR=5,92) и полиартрозом (p=0,0013; OR=6,27), а также с ОА в сочетании с признаками нДСТ (χ2=5,571; p=0,018, OR=2,52; 95% ДИ 1,15–5,49);
- генотипа *CG полиморфного локуса rs3204689 гена ALDH1A2 с ОА в сочетании с нДСТ у женщин татарской этнической принадлежности (χ2=9,548, p=0,002, OR=3,84; 95% ДИ 1,6–9,18).
ЗАКЛЮЧЕНИЕ
Таким образом, нами проведен анализ ассоциаций полиморфных вариантов rs4836732 (ASTN2), rs1298744 и rs2302061 (DOT1L), rs3204689 (ALDH1A2), rs6976 (GLT8D1), rs11177 (GNL3), rs6094710 (NCOA3), rs11841874 (MCF2L), rs7639618 (DVWA) в выборке женщин с ОА из Республики Башкортостан с учетом наличия признаков нДСТ, возраста, дебюта заболевания и локализации патологического процесса. Полученные нами ассоциации были подтверждены на независимой выборке женщин для локуса rs2302061 (DOT1L) и rs7639618 (DVWA), rs4836732 (ASTN2), что позволяет рассматривать их в качестве маркеров риска развития ОА в целом, а также его различных локализаций с учетом наличия признаков нДСТ.
Приведенные результаты исследования имеют определенное значение для изучения генетических факторов ОА как в изолированном, так и в коморбидном с нДСТ вариантах, однако из-за противоречивости полученных данных необходима дальнейшая их валидация на независимых выборках.


