Многие современные исследования, опубликованные в научной литературе, посвящены выявлению клинико-генетических маркеров, ответственных за предрасположенность к различным сердечно-сосудистым заболеваниям (ССЗ) и их факторам риска [1–3]. Так, синдром Вольфа–Паркинсона–Уайта (ВПУ) встречается во всех возрастных группах и выявляется у 1–30 на 10 000 человек, его манифестация приходится в основном на молодой трудоспособный возраст (в среднем 20 лет), а риск возникновения внезапной сердечной смерти выше общепопуляционного [4–7].
Следует отметить, что сочетание клинико-генетических особенностей нарушения ритма и проводимости при синдроме ВПУ остается одним из наименее изученных аспектов ССЗ. При синдроме ВПУ могут быть выявлены фенотипические признаки, которые в сочетании с генетическими предикторами дадут более полную информацию для профилактики манифестации нарушений ритма при этом заболевании. Синдром ВПУ не связан со структурной патологией сердца. Тем не менее, у пациентов могут выявляться врожденные аномалии развития сердца, такие как синдром соединительнотканной дисплазии. В ряде случаев синдром ВПУ сочетается с врожденными и приобретенными аномалиями [4, 6]. Дисплазия соединительной ткани (ДСТ) определяет не только фенотип пациентов, но и предрасположенность к различным заболеваниям. Так, при ДСТ в 64,4% случаев выявляется аритмический синдром. Доказано, что такие фенотипические признаки, как астенический тип конституции, сколиоз, гипермобильность суставов, сочетание пролапса митрального клапана (ПМК) и аномально расположенных хорд, служат маркерами аритмического синдрома у молодых пациентов. И такие пациенты должны быть целенаправленно обследованы [8–11].
Среди генов, которые могут принимать участие в манифестации нарушений сердечного ритма при синдроме ВПУ, нами был выбран ген эндотелиальной NO-синтазы 3 типа (NOS3). Непосредственно функцией гена NOS3 является выработка оксида азота, который участвует в расслаблении гладкомышечных волокон сосудов, передаче нервных импульсов. Доказано, что наличие полиморфизмов гена эндотелиальной синтазы окиси азота выступает предиктором развития таких заболеваний, как эссенциальная гипертония, ишемическая болезнь сердца и инфаркт миокарда [2, 3, 12].
При латентном течении заболевания клинико-генетическое тестирование дает возможность выявить существующую предрасположенность к развитию болезней, и, используя современные медицинские знания и технологии, принять превентивные меры, дать необходимые рекомендации пациенту, организовать плановое наблюдение.
Выявление признаков ДСТ и генотипов генов-предикторов нарушений сердечного ритма при синдроме ВПУ в нашем исследовании направлено на определение генетических и фенотипических сочетаний, позволяющих определить риск наличия и развития симптомов этого заболевания.
Таким образом, целью нашего исследования стало установление роли полиморфных аллельных вариантов гена NOS3 в сочетании с признаками ДСТ в развитии проявлений синдрома ВПУ для осуществления клинико-генетического прогноза и первичной профилактики манифестации нарушений ритма сердца.
МАТЕРИАЛ И МЕТОДЫ
В основную группу исследования вошли 72 пациента: 19 (26,4%) человек с манифестным синдромом ВПУ, 22 (30,6%) – с интермиттирующим синдромом ВПУ, 27 (37,5%) – со скрытым синдромом ВПУ, 4 (5,5%) – с феноменом ВПУ. Соотношение мужчин и женщин составило 42 (58,3%) против 30 (41,7%). Средний возраст мужчин равнялся 31,9±15,9 лет, женщин – 38,9±20,0 лет.
В ходе исследования использовлись следующие методы функциональные диагностики: электрокардиограмма (ЭКГ), эхокардиография (ЭхоКГ), суточное мониторирование ЭКГ по Холтеру, велоэргометрия, чреспищеводная стимуляция левого предсердия.
Пациенты были обследованы на следующие признаки ДСТ: варикозное расширение вен, высокое нёбо, неправильный прикус, эпикант, hallux valgus, кифоз, плоскостопие, 3 тип мочки уха, миопия, воронкообразная грудная клетка, пролапс митрального клапана.
Молекулярно-генетическое исследование проводилось в НИИ терапии и профилактической медицины Сибирского отделения РАМН г. Новосибирска. Выделение геномной ДНК проводили из лейкоцитов периферической крови с помощью фенол-хлороформной экстракции.
При оценке полиморфных аллельных вариантов изучаемых генов у больных с синдромом ВПУ в качестве контроля использовали популяционную выборку здоровых лиц – жителей Октябрьского района Новосибирска, обследованных в рамках международных проектов ВОЗ «MONICA» (Мониторинг заболеваемости и смертности от ССЗ) и «HAPPIE». Общая численность этой контрольной группы составила 158 человек (98 мужчин, 60 женщин), средний возраст – 44,96±16,06 лет.
Вторая контрольная группа лиц с отсутствием клинико-электрокардиографических признаков ССЗ и обследованная на дисфункцию соединительной ткани, была набрана в рамках выполнения кандидатской диссертации С.Ю. Никулиной (Красноярск, 1993). В этой группе пациенты были обследованы на варикозное расширение вен, высокое нёбо, неправильный прикус, эпикант, hallux valgus, кифоз, плоскостопие, 3 тип мочки уха, миопию, воронкообразную грудную клетку, пролапс митрального клапана. Всего в контрольную группу по дисфункции соединительной ткани вошли 278 человек (133 мужчины, 145 женщины), средний возраст которых составил 49,20±0,84 лет.
Статистическая обработка материала проводилась с применением набора прикладных программ Statistica for Windows 7.0, Excel и SPSS 19.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для изучения полиморфных аллельных вариантов гена NOS3 у больных с синдромом ВПУ и лиц контрольной группы было проведено молекулярно-генетическое обследование 72 лиц основной группы и 158 лиц контрольной группы.
В подгруппе женщин с синдромом ВПУ распространенность генотипа 4a\4a гена NOS3 составила 80,0%±7,3 (24 человека), генотипа 4a\4b – 20,0%±7,3 (6 человек), генотип 4b\4b не встречался. В группе контроля 55,9%±6,0 (38 человек) женщин являлись носителями генотипа 4a\4a, 32,4%±5,7 (22 человека) женщин – носителями генотипа 4a\4b, 11,8%±3,9 (8 человек) женщин – носителями генотипа 4b\4b. Обнаружено статистически значимое преобладание носителей гомозиготного генотипа 4a\4a среди женщин с синдром ВПУ по сравнению с женщинами группы контроля.
Также было выявлено статистически значимое преобладание гомозиготного генотипа 4b\4b у женщин группы контроля в сравнении с женщинами, имеющими синдром ВПУ. Кроме того, наблюдалось статистически значимое преобладание числа носителей редкого аллеля 4b среди женщин контрольной группы (27,9%±3,8) по сравнению с женщинами с синдромом ВПУ (10,0%±3,9); отношение шансов (ОШ) и доверительный интервал (ДИ) ОШ составили 0,29 и 0,11–0,72 соответственно. Наконец, в контрольной группе значимо преобладала сумма аллелей 4a\4b +4b\4b (ОШ 0,27; ДИ ОШ 0,1–0,74) (табл. 1).
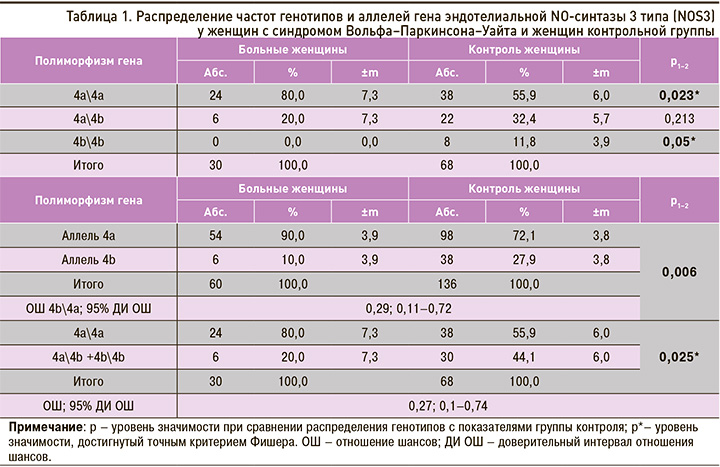
Распределение частот генотипов и аллелей гена eNOS в подгруппе мужчин с синдромом ВПУ и женщин с синдромом ВПУ имело статистически значимые отличия. У мужчин значительно чаще встречался редкий гомозиготный генотип 4b\4b – в 14,3%±5,4 случаев (6 человек), тогда как у женщин этот генотип не встречался. Кроме того, у мужчин было выявлено статистически значимое преобладание аллеля 4b – 25,0%±4,7 (21 человек) случаев против 10,0%±3,9 (6 человек) у женщин. ОШ 4b\4a и ДИ ОШ составили 0,33 и 0,13–0,89 соответственно (табл. 2).
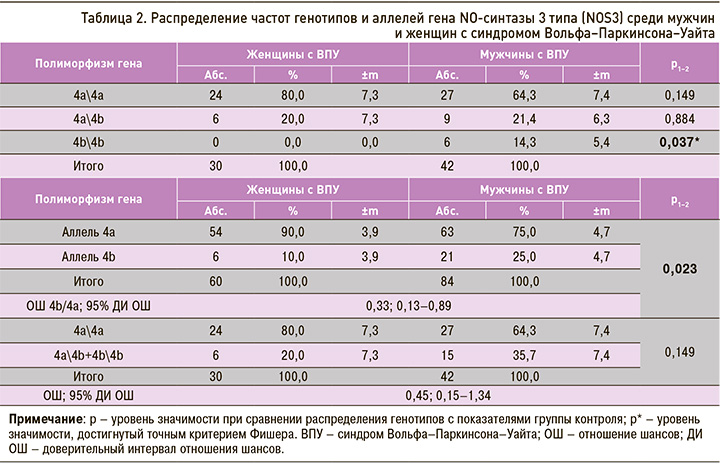
Было проведено обследование на признаки ДСТ 64 пациентам с синдромом ВПУ и 278 лицам контрольной группы (среди последних 237 были обследованы на пролапс митрального клапана).
Установлено, что у женщин основной группы исследования статистически значимо чаще, чем у женщин в группе контроля, имелись hallux valgus и 3 тип мочки уха. Распространенность hallux valgus у женщин с ВПУ составила 22,2%±8,0 (6 человек), с такой же частотой в основной группе встречался 3 тип мочки уха. При этом в контрольной группе женщин hallux valgus наблюдался лишь в 1,38%±0,97 случаев (2 человека), а 3 тип мочки уха не встречался вовсе (табл. 3).
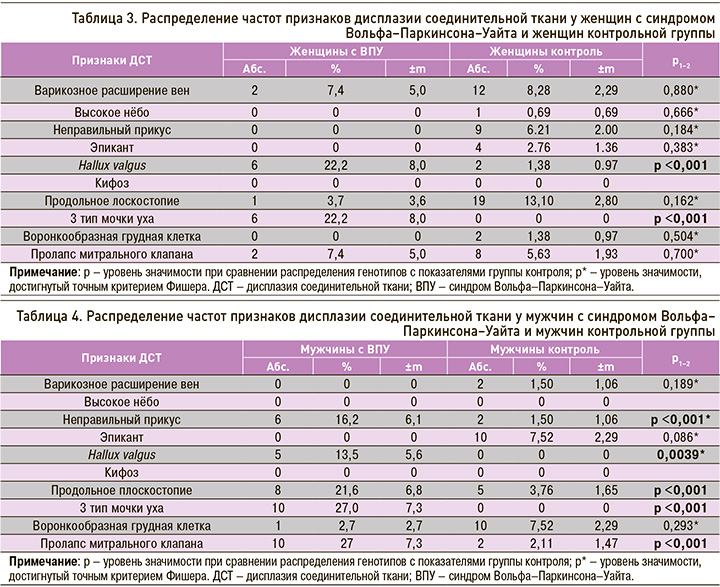
Установлено, что у мужчин в основной группе исследования статистически значимо чаще имелись hallux valgus, 3 тип мочки уха, неправильный прикус, продольное плоскостопие и ПМК, чем у мужчин в группе контроля. Встречаемость hallux valgus у мужчин с ВПУ составила 13,5%±5,6 (5 человек), 3 типа мочки уха – 27,0% ±7,3 (10 человек), неправильного прикуса – 16,2%±6,1 (6 человек), продольного плоскостопия – 21,6%±6,8 (8 человек), ПМК – 27%±7,3 (10 человек). В то же время в контрольной группе мужчин hallux valgus и 3 тип мочки уха не встречались, неправильный прикус наблюдался в 1,50%±1,06 (2 человека), продольное плоскостопие – в 3,76%±1,65 (5 человек), ПМК – 2,11%±1,47 (2 человека) случаев (табл. 4).
Выявлена прямая корреляционная связь между генотипом 4a\4a гена NOS3 и наличием у пациентов такого признака, как 3 тип мочки уха (r=0,266), а также обратная связь между генотипом 4b\4b гена NOS3 и 3 типом мочки уха (r=-0,274), значимая на 0,05 (двусторонняя). Выявлена прямая корреляционная связь между генотипом 4a\4a гена NOS3 и наличием у пациентов ПМК (r=0,277), значимая на 0,05 (двусторонняя). Таким образом, пациенты с генотипом 4a\4a гена NOS3 чаще имеют такие признаки ДСТ, как 3 тип мочки уха и ПМК, тогда как у пациентов с генотипом 4b\4b гена NOS3 3 тип мочки уха встречается реже.
Кроме того, нами был использован метод построения нейронных сетей, который показал хорошие результаты прогнозирования синдрома ВПУ в зависимости от генотипов различных генов, пола и признаков ДСТ. Процент корректных предсказаний для отсутствия синдрома ВПУ составил 89,7%, а для его наличия – 74,3%. Общий процент корректных предсказаний – 92,1%.
Следует подчеркнуть, что, поскольку возникновение заболевания обусловлено комплексом наследственных и триггерных факторов, наличие генетической предрасположенности у индивидуума не служит показателем наличия заболевания. Поэтому лишь комплексный подход прогнозирования позволит осуществить ранний этап выявления патологии.
ОБСУЖДЕНИЕ
Наиболее приоритетным направлением современной медицинской генетики является формирование новых представлений о прогнозировании состояния здоровья человека, профилактике, снижения внезапной смертности. В связи с этим генетико-эпидемиологические и клинико-генетические исследования наследственных заболеваний сердечно-сосудистой системы считаются перспективными направлениями.
В рамках нашего исследования впервые установлены ассоциации признаков ДСТ у пациентов с синдромом ВПУ и полиморфизмов геноа NOS3.
Полученные результаты свидетельствуют о редкой встречаемости гомозиготного генотипа 4b\4b и аллеля 4b гена эндотелиальной синтазы азота NOS3 в группе женщин с синдромом ВПУ по сравнению с женщинами без сердечно-сосудистой патологии и мужчинами с синдромом ВПУ. В то же время генотип 4a\4a и аллель 4a значимо чаще встречаются у женщин с ВПУ по сравнению с женщинами контрольной группы и мужчинами с этим заболеванием.
По нашему предположению, данное явление связано с тем, что аллель b гена NOS3 способствует выработки оксида азота, тогда как генотипы с аллелем а выступают предикторами понижения его выработки и ассоциированы со многими ССЗ. В частности, при идиопатических атриовентрикулярных и желудочковых блокадах сердца, семейных формах синдрома слабости синусового узла достоверно чаще встречается генотип 4a\4b гена эндотелиальной синтазы азота [9, 11]. Оксид азота способствует расслаблению гладкомышечных клеток и кардиомиоцитов. Если брать во внимание, что дополнительные проводящие пути гистологически состоят в основном из клеток рабочего миокарда, то можно предположить, что эффекты оксида азота препятствуют прохождению возбуждения через дополнительные проводящие пути. Следовательно, снижение его содержания при генотипах 4a\4b либо 4a\4a гена эндотелиальной синтазы азота способствует проявлениям синдрома ВПУ и его манифестации. У мужчин с синдромом ВПУ по сравнению с мужчинами группы контроля достоверных различий по генотипам гена NOS3, как это наблюдалось у женщин, не выявлено.
Мы полагаем, что это связано с различием гормонального регулирования у мужчин и женщин. Как известно, до периода менопаузы женские половые гормоны «защищают» сердечно-сосудистую систему. В частности, эстрогены действуют опосредованно через повышение выработки оксида азота. Однако и андрогены в нормальных концентрациях оказывают кардиопротективный эффект, действуя на сердечно-сосудистую систему напрямую, а не опосредованно, как эстрогены, через фермент эндотелиальной синтазы азота.
Кардиопротекторные эффекты мужских половых гормонов были впервые показаны в 1977 г. профессором Jaffe R.B. Вопреки расхожему мнению о том, что андрогены не оказывают благоприятного воздействия на сердце и сосуды подобно женским половым гормонам, замечено, что у мужчин с кардиоваскулярными заболеваниями уровень тестостерона в крови ниже, чем у здоровых мужчин. Хотя андрогены обеспечивают наиболее эффективное реагирование организма при пиковых или внезапных непродолжительных стрессовых ситуациях, уровень тестостерона очень не стабилен и быстро снижается при хроническом или запредельном стрессе. Учитывая современный высокий ритм жизни, как правило, более высокую профессиональную ответственность или работу на вредных производствах, мужчины часто находятся в состоянии затяжного стресса. При этом негативное влияние хронического или запредельного стресса на сердечно-сосудистую систему у мужчин выражено больше, чем у женщин [13]. Следовательно, у мужчин с синдромом ВПУ даже при нормальном распределении генотипов гена NOS3 и наличии протективного гомозиготного генотипа 4b\4b выше вероятность проявления симптомов и манифестации заболевания. Наличие генотипа 4a\4a и аллель 4a гена NOS3 у женщин служат предикторами развития электрофизиологических признаков синдрома ВПУ, тогда как аллель 4b у женщин, напротив, является «протективным».
Согласно результатам нашего исследования, при синдроме ВПУ у пациентов присутствуют признаки ДСТ. Для женщин характерны hallux valgus и 3 тип мочки уха, для мужчин – те же halus valgus и 3 тип мочки уха, а также неправильный прикус, продольное плоскостопие и ПМК. Выявлена обратная корреляционная связь между манифестирующей и скрытой формой синдрома ВПУ и неполной блокадой левой ножки пучка Гиса (НБЛНПГ) (r=-0,422, r=-0,470), обратная корреляционная связь между интермитирующей и скрытой формой синдрома ВПУ и полной блокадой левой ножки пучка Гиса ПБПНПГ (r=-0,422, r=-0,470), значимая на 0,01 (двусторонняя).
Обнаружена прямая корреляционная связь между генотипом 4a\4a гена NOS3 и наличием у пациентов такого признака, как 3 тип мочки уха (r=0,266) и обратная связь между генотипом 4b\4b гена NOS3 и 3 типом мочки уха (r=-0,274), значимая на 0,05 (двусторонняя). Выявлена прямая корреляционная связь между генотипом 4a\4a гена NOS3 и наличием у пациентов ПМК (r=0,277), значимая на 0,05 (двусторонняя). При проведении корреляционного анализа генотипов гена-кандидата и признаков ДСТ, установлено, что пациенты с генотипом 4a\4a гена NOS3 чаще имеются такие признаки ДСТ, как 3 тип мочки уха и ПМК, тогда как у пациентов с генотипом 4b\4b гена NOS3 3 тип мочки уха встречается реже.
ЗАКЛЮЧЕНИЕ
Наше исследование было посвящено клинико-генетическим особенностям синдрома ВПУ. Впервые изучены полиморфизмы гена NOS3 и признаки ДСТ в связи с этим синдром. Полученные данные возможно использовать в практической медицине для своевременного выявления синдрома ВПУ, выявляя характерные признаки дисплазии при осмотре пациента и характерные генотипы при генетическом анализе.
Стоит отметить, что клинический и генетический анализ может проводиться не только для выявления этого заболевания, но и других ССЗ. Как ранее упоминалось, доказано, что многие ССЗ имеют клинические и генетические предикторы, в том числе изучавшиеся в данном исследовании. Использование клинико-генетических исследование по целому комплексу нозологий может быть очень эффективным в диагностике. Однако, синдром ВПУ, как и многие другие ССЗ, не являются моногенными; предикторами болезни может выступать множество генов, их мутаций и полиморфизмов.
В связи с этим необходимо расширять круг исследуемых генов. Кроме того, существующих признаков ДСТ значительно больше, чем было исследовано нами. Для выяснения полного спектра клинических предикторов синдрома ВПУ необходимо расширить спектр изучаемых признаков.



