Фибрилляция предсердий (ФП) является наиболее частой аритмией среди пациентов пожилого и старческого возраста, причем подавляющее большинство случаев приходится на долю неклапанной ФП. С увеличением возраста распространенность ФП значительно возрастает: от 0,1% у лиц моложе 40 лет до 15–20% у тех, кто старше 80 лет [1]. Доля лиц 65–85 лет среди пациентов c ФП достигает 70%, а средний возраст больных составляет 75 лет [2].
У гериатрических пациентов с ФП значительно повышен риск инсульта, развития когнитивных нарушений, усугубления сердечной недостаточности [3].
По мере старения у больных не только нарастает полиморбидность, но и происходит формирование различных гериатрических синдромов, среди которых центральное место занимает синдром «хрупкости».
Хрупкость (англ. frailty), или старческая астения – это гериатрический синдром, характеризующийся возраст-ассоциированным снижением физиологического резерва и функций многих систем организма, сопряженный с повышенной уязвимостью пожилого человека к воздействию эндогенных и экзогенных факторов, а также высоким риском развития неблагоприятных исходов для здоровья, потери автономности и смерти. Клиническими проявлениями синдрома «хрупкости» выступают общая слабость, уменьшение физической и психической активности, медлительность, непреднамеренная потеря веса и развитие зависимости от посторонней помощи [4].
Для выявления синдрома «хрупкости» используются 2 подхода:
- модель накопления дефицитов, предложенная Rockwood K., с оценкой 40–70 показателей и последующим расчетом индекса «хрупкости» [5];
- фенотипическая модель Fried L.P. [6], включающая анализ 5 факторов – снижения веса, утомляемости, низкого уровня физической активности, низкой скорости ходьбы и снижения мышечной силы.
Распространенность синдрома «хрупкости» нарастает с возрастом: по зарубежным данным, среди проживающих дома лиц старше 65 лет она составляет около 10%, а среди лиц старше 85 лет – 25–50% [6]. Сведения о распространенности этого синдрома могут значительно различаться в зависимости от применяемых критериев оценки, возраста и обследуемого контингента. У женщин «хрупкость» встречается значительно чаще по сравнению с мужчинами [4, 7].
ФП и синдром «хрупкости» являются взаимно отягощающими состояниями. Среди больных ФП количество «хрупких» пациентов широко варьируется – от 4,4% до 75,4% [8]; в среднем, по данным анализа, эта величина составляет около 39% [9]. Среди госпитализированных пациентов с ФП старше 80 лет синдром «хрупкости» выявлялся в 40–47% случаев [9, 10]. При анализе заболеваний среди «хрупких» пациентов ФП наблюдалась достаточно часто – в 48,2–75,4% случаев [8]. Установлено, что распространенность ФП нарастает при увеличении степени тяжести «хрупкости». Так, в исследовании Wilkinson C. et al. у «крепких» пациентов и больных с малой, средней и тяжелой степенью «хрупкости» встречаемость ФП составляла 2,9%, 11,2%, 22,2% и 31,5% соответственно [11]. При ФП наличие «хрупкости» ассоциировано с увеличением тяжести симптомов, длительности госпитализаций, возрастанием риска инсульта и общей смертности [5, 11].
С другой стороны, при наличии ФП, особенно ее постоянной формы, у пациентов наблюдается ухудшение гериатрического статуса: прогрессирование когнитивных нарушений, снижение общей двигательной активности и утрата независимости в повседневной жизни [12].
Таким образом, у гериатрических пациентов с синдромом «хрупкости» ФП имеет много отличительных черт, что диктует необходимость специфического подхода к ведению таких больных.
Согласно современным рекомендациям тактика ведения больных с ФП включает 3 основных принципа: A (Avoid stroke – профилактика инсульта), B (Better symptom management – уменьшение симптомов) и С (Сardiovascular and comorbidity risk reduction – снижение сердечно-сосудистого риска и коморбидности) [13]. Эти принципы применяются ко всем пациентам с ФП, но у «хрупких» имеют ряд особенностей.
ПРОФИЛАКТИКА ИНСУЛЬТА
По мере старения риск развития инсульта у больных с ФП значительно возрастает. По данным Фрамингемского исследования, при сравнении пациентов в возрасте 50–59 лет и 80–89 лет отмечено увеличение угрозы инсульта в 15 раз – с 1,5% до 23,5% соответственно [14]. Наличие синдрома «хрупкости» дополнительно увеличивает вероятность инсульта. Выявлена связь между тяжестью этого синдрома и риском тромбоэмболических осложнений (ТЭО) по шкале CHA2DS2-Vasc: в группах пациентов с отсутствием «хрупкости», малой, средней и тяжелой степенью «хрупкостью» количество баллов по указанной шкале составило 2,2, 3,2, 4,0 и 5,0 соответственно [11].
Кроме повышения риска инсульта и ТЭО, с увеличением возраста наблюдается и возрастание опасности кровотечений. Однако ишемический риск нарастает в большей степени, чем геморрагический, и гериатрические пациенты получают большую клиническую выгоду от назначения антитромботической терапии (АТТ), чем пациенты более молодого возраста. Даже у больных ≥90 лет отмечается благоприятное соотношение пользы и риска при приеме антикоагулянтов, и проводимая при ФП антикоагулянтная терапия имеет клиническое преимущество по сравнению с ее отсутствием [15]. Получены данные, что наличие синдрома «хрупкости» не приводит к существенному увеличению риска больших кровотечений по сравнению с «нехрупкими» пациентами [16].
 В соответствии с современными рекомендациями [13] АТТ должна назначаться всем пациентам, имеющим показатели по шкале CHA2DS2-VASc ≥2 (у мужчин) и ≥3 (у женщин) баллов, при отсутствии противопоказаний. Абсолютных противопоказаний к применению антикоагулянтов немного. К ним относят серьезное активное кровотечение, сопутствующие заболевания с повышенным геморрагическим риском (тромбоцитопения <50 × 109/л, тяжелая анемия и др.), кровотечение высокого риска на текущий момент (например, внутричерепное кровоизлияние). Подавляющее большинство пациентов с сочетанием ФП и «хрупкости» имеет показания к назначению АТТ. Следует заметить, что, кроме абсолютных противопоказаний, у пациентов могут встречаться и ряд других состояний, при которых назначать антикоагулянты не следует (табл. 1) [17]. У «хрупких» пациентов указанные состояния встречаются нередко, но могут быть частично скорригированы за счет усиления социальной поддержки и улучшения функционального статуса больного.
В соответствии с современными рекомендациями [13] АТТ должна назначаться всем пациентам, имеющим показатели по шкале CHA2DS2-VASc ≥2 (у мужчин) и ≥3 (у женщин) баллов, при отсутствии противопоказаний. Абсолютных противопоказаний к применению антикоагулянтов немного. К ним относят серьезное активное кровотечение, сопутствующие заболевания с повышенным геморрагическим риском (тромбоцитопения <50 × 109/л, тяжелая анемия и др.), кровотечение высокого риска на текущий момент (например, внутричерепное кровоизлияние). Подавляющее большинство пациентов с сочетанием ФП и «хрупкости» имеет показания к назначению АТТ. Следует заметить, что, кроме абсолютных противопоказаний, у пациентов могут встречаться и ряд других состояний, при которых назначать антикоагулянты не следует (табл. 1) [17]. У «хрупких» пациентов указанные состояния встречаются нередко, но могут быть частично скорригированы за счет усиления социальной поддержки и улучшения функционального статуса больного.
В настоящее время в качестве АТТ при неклапанной ФП рекомендуются антикоагулянты двух групп. К первой относятся антагонисты витамина К (наиболее часто используется варфарин). Условие эффективного применения варфарина – поддержание международного нормализованного отношения (МНО) в терапевтическом диапазоне 2,0–3,0 не менее 70% времени. Вторая группа представлена новыми оральными антикоагулянтами (НОАК) – дабигатрана этексилатом, ривароксабаном, эдоксабаном (в России не зарегистрирован) и апиксабаном. Прием НОАК у больных ФП возможен в стандартной или сниженной дозе (табл. 2) [13].
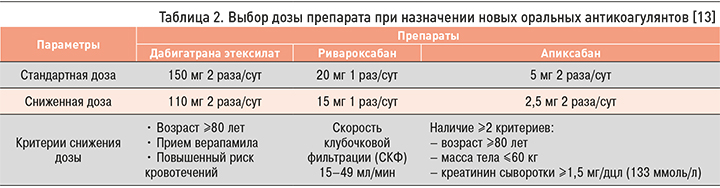
Анализ результатов применения НОАК в ключевых рандомизированных исследованиях (RE-LY, ROCKET-AF, ARISTOTLE) у пациентов старше 75 лет показал, что эффективность этой группы препаратов, оцениваемая по уменьшению риска инсульта/системных эмболий, не ниже или даже выше по сравнению с варфарином. При анализе безопасности выявлено, что количество внутричерепных кровоизлияний на фоне НОАК не больше по сравнению с варфарином, а число больших экстракраниальных кровотечений варьируется при использовании разных препаратов. В целом, дабигатрана этексилат и ривароксабан по суммарному влиянию на риск инсульта и/ или системных эмболий и больших кровотечений (соотношение эффективности и безопасности) не отличались от варфарина. Применение апиксабана в сравнении с варфарином имело преимущество в снижении как ТЭО, так и больших кровотечений [18].
В дальнейшем опыт применения оральных антикоагулянтов у пациентов старческого возраста был обобщен в нескольких метаанализах, в которые были включены данные национальных регистров и наблюдательных исследований реальной клинической практики [19–21]. Проведенный анализ антикоагулянтной терапии среди 660 896 пациентов старческого возраста с ФП продемонстрировал, что НОАК эффективнее варфарина в профилактике ишемического инсульта/ТЭО (снижение риска от 13% до 26%) и внутричерепных кровоизлияний (снижение риска на 50%). Риск больших кровотечений при приеме НОАК у гериатрических пациентов был ниже или сопоставим с варфарином, но существенно варьировал в разных исследованиях и был связан с такими факторами, как выбор конкретного препарата, используемые дозы препаратов, функция почек [22]. В ряде исследований на фоне НОАК было отмечено меньшее количество больших кровотечений по сравнению с антагонистами витамина K [23, 24]. В других исследованиях вероятность больших кровотечений на фоне приема НОАК существенно не отличалась или даже превышала этот показатель при использовании варфарина за счет увеличения желудочно-кишечных кровотечений [20, 21].
Кроме влияния на ТЭО, антикоагулянты у пациентов старших возрастных групп с ФП могут уменьшать угрозу развития когнитивных нарушений даже вне зависимости от развития инсульта [25], однако при неадекватной антикоагуляции варфарином (вне границ терапевтического диапазона) риск развития деменции может даже повышаться [26].
Таким образом, накопленный опыт применения антикоагулянтов свидетельствует о преимуществах НОАК перед варфарином у гериатрических пациентов.
При сопоставлении эффекта различных препаратов из группы НОАК у больных старческого возраста следует отметить, что прямого сравнительного анализа между дабигатрана этексилатом, ривароксабаном и апиксабаном не проводилось. Однако непрямое их сравнение позволило установить, что при одинаковом снижении риска ишемического инсульта и ТЭО апиксабан отличался существенно меньшим риском больших кровотечений относительно дабигатрана этексилата (обеих доз) и ривароксабана [19, 20]. Наиболее благоприятное соотношение эффективности и безопасности апиксабана по сравнению с другими НОАК у гериатрических пациентов было выявлено во многих работах [27–29].
Междисциплинарный совет экспертов FORTA, занимающийся оценкой безопасности и эффективности препаратов в пожилом возрасте, признал апиксабан наиболее безопасным антикоагулянтом у гериатрических пациентов с ФП [30]. На выбор апиксабана как препарата первой линии у пожилых пациентов с ФП указывают и европейские рекомендации 2017 г. Дабигатрана этексилат (110 мг 2 раза/ сут) и ривароксабан (20 мг/сут) при этом рассматриваются в качестве препаратов второго выбора [31].
Оценка применения антикоагулянтной терапии у «хрупких» пациентов с ФП проводилась только в наблюдательных исследованиях. У «хрупких» пациентов, не получавших антикоагулянтную терапию, при наблюдении в течение 1 года отмечалось существенно большее количество инсультов и/или кровотечений по сравнению с больными, принимавшими антикоагулянты [10].
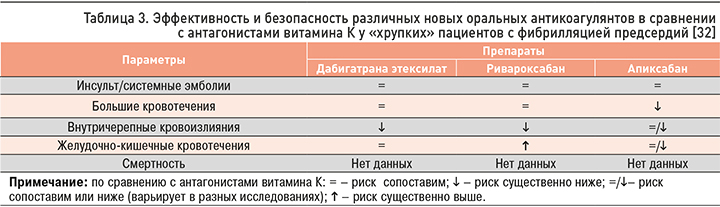
Обобщенные результаты наблюдательных исследований по применению различных НОАК в сравнении с антагонистами витамина К у «хрупких» пациентов приведены в таблице 3 [32]. В целом, по эффективности и безопасности НОАК не уступают, а по ряду показателей превосходят антагонисты витамина К, в связи с чем именно им отдается предпочтение при лечении этой категории больных. Лучшее соотношение эффективности/безопасности отмечено у апиксабана [23, 33].
Несмотря на увеличение риска инсульта в старших возрастных группах, назначение антикоагулянтной терапии с возрастом уменьшается. По данным наблюдательного исследования [34], больные ≥80 лет достоверно реже получали антикоагулянты по сравнению с пациентами <80 лет (63,0% и 74.8% соответственно; р <0,001), причем в старшей возрастной группе показатели CHA2DS2-VASc были существенно выше (4,32±1,35 и 3,04±1,54; р <0,001). В реальной клинической практике антикоагулянты получают менее 60% гериатрических больных с ФП и высоким риском инсульта по шкале CHA2DS2-VASc [16]. Кроме того, НОАК часто назначаются им в сниженных дозах, что приводит к существенному уменьшению ожидаемого эффекта. Применение сниженных доз препаратов у больных ≥75 лет не имеет преимущества перед варфарином по влиянию на риск развития ишемического инсульта/ТЭО и смертность. В связи с этим подчеркивается необходимость использования стандартных доз препаратов в отсутствии показаний к уменьшению дозировки [21, 35]. «Хрупкие» больные с ФП существенно реже, чем «крепкие», получают антикоагулянтную терапию [9, 11, 16]; при этом именно наличие «хрупкости» снижает вероятность назначения антикоагулянтов на 23% по сравнению с «крепкими» пациентами [36].
К наиболее частым причинам неназначения антикоагулянтов при наличии «хрупкости» относят полиморбидность, полипрагмазию, когнитивные нарушения, возраст более 90 лет, риск падений. Вместе с тем имеется достаточная доказательная база насчет того, что польза антикоагулянтов существенно превышает риск кровотечений при этих состояниях [32].
Среди факторов, влияющих на частоту назначения антикоагулянтов «хрупким» пациентам, также следует отметить недостаточный практический опыт их использования в данном случае, небольшую доказательную базу и отсутствие клинических рекомендаций, регламентирующих назначение антикоагулянтной терапии этой категории больных [37].
При наличии противопоказаний к назначению антикоагулянтов может быть рассмотрена возможность проведения окклюзии ушка левого предсердия [13].
Таким образом, на сегодняшний день продемонстрирована клиническая выгода от назначения антикоагулянтов «хрупким» пациентам, и наличие «хрупкости» само по себе не должно рассматриваться как противопоказание к антикоагулянтной терапии при ФП.
УМЕНЬШЕНИЕ СИМПТОМОВ И УЛУЧШЕНИЕ КАЧЕСТВА ЖИЗНИ
Клинические проявления ФП у пациентов старческого возраста могут существенно отличаться от таковых у пациентов более молодого возраста. Гериатрические пациенты чаще отмечают общие симптомы, сопровождающие аритмию: слабость, утомляемость, чувство неуверенности, головокружение, беспокойство. Наряду с этим, у них нередко ФП сопровождается коронарной, сердечной и цереброваскулярной недостаточностью [38, 39]. В старших возрастных группах наиболее часто регистрируется постоянная форма ФП [40].
Тяжесть симптомов при ФП у пациентов пожилого и старческого возраста значительно варьирует. У большинства таких больных или нет симптомов ФП (30–60%), или же они проявляются незначительно (25–40%). Наличие выраженной симптоматики отмечается менее чем у трети больных (15–30%) [38, 41]. В то же время у «хрупких» пациентов, по сравнению с «крепкими», выраженная симптоматика наблюдается намного чаще, включая более частое возникновение обморочных состояний [42]. Выявлена связь между выраженностью симптомов ФП по шкале EHRA и тяжестью синдрома «хрупкости» [43].
Для уменьшения симптомов при ведении больных с ФП применяются 2 стратегии – контроля частоты сердечных сокращений (ЧСС) и контроля ритма.
Стратегия контроля частоты сердечных сокращений
В настоящее время в реальной клинической практике у большинства больных пожилого и старческого возраста с ФП предпочтение отдается контролю ЧСС [16, 44], который служит основной стратегией ведения прежде всего бессимптомных и малосимптомных пациентов. Согласно современным рекомендациям [13], первичной целью при такой стратегии является достижение ЧСС менее 110 уд/мин («мягкий» контроль); при сохранении симптомов можно перейти к «строгому» контролю (ЧСС в покое <80 уд/мин), но в этом случае важно избегать развития брадикардии. По данным контролируемого исследования RACE-II, «строгий» контроль ЧСС может уменьшать выраженность симптомов, но не улучшает прогноз [45].
В качестве препаратов для контроля ЧСС обычно использовуются бета-адреноблокаторы, недигидропиридиновые блокаторы кальциевых каналов и дигоксин.
Препаратами выбора в данном случае выступают бета-адреноблокаторы [13]. Они не имеют аритмогенных свойств и являются единственной группой антиаритмических средств, применение которой ассоциировано со снижением смертности [46]. При наличии сопутствующей хронической сердечной недостаточности (ХСН) рекомендуется применять бисопролол, метопролола сукцинат с замедленным высвобождением, карведилол и небиволол. При наличии обструктивных заболеваний легких назначаются только селективные бета-адреноблокаторы (бисопролол). Следует помнить, что у гериатрических пациентов с наличием депрессивных расстройств бета-адреноблокаторы могут усугубить депрессию.
У пациентов старческого возраста стартовую дозу препаратов этой группы рекомендовано снижать на 50%, а в дальнейшем титровать до получения терапевтического ответа. По фармакокинетическим свойствам бисопролол отличается от других бета-адреноблокаторов, так как имеет двойной путь выведения. В связи с этим коррекция его дозы требуется только при тяжелой степени почечной или печеночной недостаточности.
В качестве альтернативы бета-адреноблокаторам могут быть назначены недигидропиридиновые блокаторы кальциевых каналов (верапамил и дилтиазем). У больных со сниженной фракцией выброса левого желудочка эти препараты не применяются в связи с отрицательным инотропным эффектом. Из побочных явлений для верапамила характерно угнетение перистальтики желудочно-кишечного тракта с развитием запоров, что может ограничивать его применение у гериатрических пациентов.
Дигоксин также может использоваться для контроля ЧСС: такой вариант терапии может быть предпочтительным у физически малоактивных больных и пациентов с сердечной недостаточностью. Однако доза препарата у пожилых пациентов не должна превышать 0,125 мг/сут. Имеются данные, что при высокой концентрации дигоксина в плазме крови наблюдается повышение летальности [47], тогда как применение малых его доз может улучшать не только качество жизни, но и прогноз [48].
Стратегия контроля ритма
Стратегия контроля ритма включает применение кардиоверсии с восстановлением синусового ритма и его сохранение с помощью проведения антиаритмической терапии или катетерной аблации. Фармакологическая кардиоверсия может иметь серьезные побочные эффекты в пожилом возрасте. При наличии синдрома слабости синусового узла, нарушений атриовентрикулярной проводимости и удлинении интервала QT фармакологическая кардиоверсия не должна применяться в амбулаторных условиях.
Наиболее безопасным препаратом для кардиоверсии у гериатрических пациентов считается амиодарон [49]. Электрическая кардиоверсия рассматривается как более эффективная по сравнению с фармакологической. Однако при наличии признаков «хрупкости» эффективность кардиоверсии может снижаться. Так, в небольшом исследовании Mlynarski R. et al. (2020) ее эффективность у «хрупких» пациентов в сравнении с «крепкими» больными сопоставимого возраста была в 1,5 раза меньше (66,2% и 99,2% соответственно) [50].
С целью сохранения синусового ритма после кардиоверсии часто назначается антиаритмическая терапия, применение которой направлено на профилактику рецидивов ФП и улучшение качества жизни. Длительное использование антиаритмических препаратов имеет много ограничений у гериатрических пациентов в связи с повышенным риском нежелательных явлений из-за частого сопутствующего поражения миокарда, печени и почек. Как правило, назначаются антиаритмические препараты 1 и 3 классов по классификации Vaughan Williams. Наиболее серьезный побочный эффект этих препаратов – проаритмическое действие, манифестирующее увеличением желудочковой эктопии, расширением интервала QT, возникновением мономорфной или пируэтной желудочковой тахикардии, избыточной брадикардии [49]. Выраженность проаритмического действия значительно увеличивается при нарушении функции печени или почек. Поэтому у пожилых пациентов с данной патологией эти препараты назначать не следует.
Тем не менее, при необходимости антиаритмические препараты 1 класса (аллапинин, этацизин, пропафенон) могут быть назначены с предельной осторожностью, но только пациентам с отсутствием структурных поражений миокарда (без снижения фракции выброса левого желудочка <40%, ХСН III стадии, перенесенного инфаркта миокарда, нестабильной стенокардии, стабильной стенокардии III–IV функционального класса, гипертрофии левого желудочка >14 мм). Препараты аллапинин и этацизин зарегистрированы только в России, специальных исследований по их применению у гериатрических больных не проводилось. Они могут быть использованы как препараты резерва.
Амиодарон, относящийся к 3 классу антиаритмических средств, при длительном приеме вызывает множество экстракардиальных побочных явлений и не должен рассматриваться как препарат первого выбора для длительного использования. Применение амиодарона рекомендовано у больных со структурными изменениями сердца, при наличии ишемической болезни сердца, ХСН.
Соталол (другой антиаритмический препарат 3 класса) также имеет много ограничений к приему; его не следует назначать при ХСН с низкой фракцией выброса, значительной гипертрофией левого желудочка, астмой, гипокалиемией, при нарушении функции почек, удлиненном QT-интервале [13]. Имеются сообщения об увеличении риска смертности у пациентов с ФП, получающих соталол [51].
Применение антиаритмических средств в пожилом возрасте может увеличивать риск синкопальных состояний и падений. Отмечено, что эти осложнения наиболее часто наблюдаются в первые 14 дней приема препаратов [52].
Важнейшее условие применения антиаритмических препаратов 1 и 3 класса – регулярный ЭКГ-контроль с анализом интервалов PQ, QRS и QTc. При увеличении QRS >25% или QTc >0,50 мс препарат необходимо отменить. Также необходимо регулярно контролировать функцию почек, поскольку при ее снижении значительно возрастает риск проаритмии.
Эффективность терапии бета-блокаторами или недигидропиридиновыми блокаторами кальциевых каналов с целью сохранения синусового ритма после успешной кардиоверсии значительно уступает антиаритмическим препаратам 1 и 3 классов [49].
В качестве альтернативы антиаритмическим средствам для сохранения синусового ритма может применяться катетерная аблация с использованием радиочастотной или криобалонной техники. Эффективность аблации в сохранении синусового ритма при пароксизмальной ФП имеет преимущество перед антиаритмической терапией [13, 49]. По результатам ряда исследований эффективность и безопасность аблации у гериатрических пациентов существенно не отличаются по сравнению с более молодыми больными [53, 54]. У «хрупких» пациентов обнаружено снижение ее эффективности и большее количество осложнений по сравнению с «крепкими» [50].
Таким образом, и стратегия контроля ЧСС, и стратегия контроля ритма позволяют уменьшить выраженность симптомов у пациентов с ФП и не имеют существенных различий по смертности, количеству инсультов и частоте развития сердечной недостаточности [44, 55]. На сегодняшний день недостаточно данных о предпочтении какой-либо одной из двух проводимых стратегий у «хрупких» пациентов. В условиях реальной клинической практики чаще применяется стратегия контроля ЧСС [16, 44, 56]. При использовании стратегии контроля ритма наблюдаются более высокие показатели качества жизни, меньшая выраженность когнитивных нарушений, но большая длительность госпитализаций [56].
СНИЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОГО РИСКА И КОМОРБИДНОСТИ
Для повышения эффективности лечения ФП рекомендуется выявление и лечение сердечно-сосудистых и сопутствующих заболеваний, а также коррекция кардиометаболических факторов риска.
Пациентам с подозрением на наличие синдрома «хрупкости» необходимо провести углубленное двухэтапное обследование: на этапе скрининга –использование специальных опросников (в России рекомендован опросник «Возраст не помеха»); на 2 этапе –комплексная гериатрическая оценка с выполнением ряда тестов, выявляющих нарушения функционального, эмоционального, социального статуса и когнитивных функций [4]. Синдром «хрупкости» представляет собой динамический процесс, и при его раннем выявлении есть возможность сохранить функциональный и когнитивный резерв, способность к самообслуживанию и снизить темп ухудшения гериатрического статуса [7].
Лекарственная терапия больным с синдромом «хрупкости» должна назначаться с учетом результатов комплексной гериатрической оценки, приоритетов самого пациента и быть ориентированной на оптимальное качество жизни и поддержание независимости от посторонней помощи.
Важно определять модифицируемые барьеры, снижающие эффективность/безопасность терапии. Усиление социальной поддержки, коррекция функционального статуса пациента, взаимодействие с семьей и лицами, осуществляющими уход, снижение потребления алкоголя могут расширить возможности применения антикоагулянтной терапии у больных с ФП. Базисное эффективное лечение сердечно-сосудистых и сопутствующих заболеваний способствует уменьшению бремени ФП и снижению резистентности к фармакотерапии.
Необходимо проводить регулярную оценку состояния пациента с контролем ЭКГ, функции почек, гериатрического статуса, осуществлять пересмотр лекарственной терапии.
В процессе лечения «хрупких» пациентов большое внимание должно уделяться немедикаментозным вмешательствам, включающим правильное питание, регулярную физическую активность, организацию безопасного быта, когнитивный тренинг и избегание социальной изоляции [4]. Получены доказательства, что физическая активность у «хрупких» пациентов снижает интенсивность симптомов при ФП [43].
Активное применение немедикаментозных методов позволяет улучшить функциональный, эмоциональный и социальный статус пациента, что в свою очередь создает условия для уменьшения полипрагмазии и повышения эффективности и безопасности проводимой терапии.
ЗАКЛЮЧЕНИЕ
В завершение следует отметить, что ведение «хрупких» пациентов с ФП – сложная задача, при решении которой необходим мультидисциплинарный подход с привлечением кардиолога, врача-гериатра, узких специалистов по профилю сопутствующих заболеваний. У «хрупких» больных имеется много ограничений при лечении ФП, однако само по себе наличие синдрома «хрупкости» не является противопоказанием к назначению адекватной медикаментозной терапии или оправданных инвазивных вмешательств.
Ведение «хрупких» больных с ФП должно быть пациент-ориентированным, включать эффективное управление сопутствующими заболеваниями, коррекцию кардиометаболических факторов, контроль гериатрического статуса, регулярный анализ проводимой терапии. Такой комплексный подход может сохранить функциональный и когнитивный резерв «хрупких» пациентов с ФП, улучшить качество и прогноз жизни. Необходимо проведение контролируемых исследований у этого контингента больных ФП для выработки наиболее оптимальной тактики их ведения.


