Тревожная статистика по заболеваемости и смертности от инфаркта миокарда (ИМ) определяет высокий интерес клиницистов и исследователей к этому заболеванию [1]. Развитие ИМ сопровождается иммуновоспалительными реакциями, при этом до настоящего времени не полностью ясна причинно-следственная связь ишемических и воспалительных процессов [2]. Помимо некроза кардиомиоцитов, при ИМ имеет место активизация апоптоза. Важная роль в апоптотических процессах принадлежит аннексину V, который (как, возможно, и другие аннексины) связывается с мембранными липидами, формирует «антитромботический щит» и снижает риск тромбоза, обусловленного апоптозом. К настоящему времени представлены исследования, демонстрирующие диагностическое и прогностическое значение изменения уровня аннексина V у пациентов с различными сердечно-сосудистыми заболеваниями (ССЗ) [3]. Однако данные об уровне аннексин-V-связанных апоптотических клеток в периферической крови у больных острым коронарным синдромом на фоне бронхолегочной патологии малочисленны.
Известно, что важную роль в повреждении сосудистого эндотелия путем индукции их апоптоза может играть неоптерин, который способен усиливать клеточную цитотоксичность, опосредованную свободными кислородными радикалами [4], а его метаболиты, являющиеся антиоксидантами, усиливают апоптоз клеток [5]. При изучении уровня неоптерина у больных с различными ССЗ было показано, что повышенный сывороточный неоптерин может выступать предиктором развития больших коронарных событий [6]. Ранее нами было установлено, что концентрация неоптерина в крови существенно повышается при развитии ИМ на фоне хронической обструктивной болезни легких (ХОБЛ) [7]. Однако, на наш взгляд, интерес представляет изучение зависимости концентрации неоптерина от длительности ишемии при ИМ на фоне бронхолегочной патологии.
В регуляции процессов апоптоза участвуют и белки теплового шока (HSP), в частности HSP70, который может проявлять как антиапоптические, так и проапоптические свойства [8].
Цель предлагаемого исследования – выявление особенностей апоптоза у больных ХОБЛ, осложненной острым ИМ, в зависимости от длительности ишемии.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 65 больных с ИМ в условиях регионального сосудистого центра Александро-Мариинской областной клинической больницы г. Астрахани в период с 2018 по 2019 г. У 37 из них ИМ развился на фоне ХОБЛ, у 28 человек – без ХОБЛ в качестве сопутствующего заболевания. Перед включением в исследование от всех пациентов было получено письменное информированное согласие на участие в нем.
Медиана возраста обследованных составила 52,8 (45,8; 60,1) года. Диагноз ИМ устанавливался на основании клинических рекомендаций «Четвертое универсальное определение инфаркта миокарда» Европейского общества кардиологов (ESC, 2018). Критериями включения в основные группы служили возраст до 60 лет, I тип ИМ. В исследование не включались пациенты другими типами ИМ, терминальной печеночной и почечной недостаточностью (скорость клубочковой фильтрации менее 30 мл/ мин), онкологическими заболеваниями.
В группе больных с ИМ на фоне ХОБЛ диагноз легочной патологии, а также тяжесть ее течения были верифицированы ранее. Все больные с ХОБЛ имели II–III стадии заболевания вне обострения. Диагноз ХОБЛ устанавливался в соответствии с программой «Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких» (GOLD, пересмотр 2019 г.). Медиана длительности ХОБЛ составила 17,5 (7,4; 24,6) лет. У всех пациентов отмечалось курение в анамнезе. На момент госпитализации курящими были 87,8% пациентов с ХОБЛ. Средний индекс курения составил 34,6 пачка-лет. В 96% случаев наблюдаемыми были мужчины с длительным анамнезом курильщика на момент исследования.
Для анализа зависимости изучаемых параметров от времени госпитализации с момента возникновения приступа группы пациентов были разделены следующим образом:
- больные с ИМ без ХОБЛ, поступившие до 12 ч, – 20 человек;
- больные с ИМ без ХОБЛ, поступившие после 12 ч, – 8 человек;
- больные с ИМ на фоне ХОБЛ, госпитализированные в первые 12 ч, – 22 человека;
- больные с ИМ на фоне ХОБЛ, госпитализированные после 12 ч, – 15 человек.
Группа контроля была представлена 30 соматически здоровыми лицами, проходившими обследование в поликлиниках г. Астрахани согласно территориальному прикреплению в соответствии с приказом Минздрава России от 03.02.2015 № 36 «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения». Лица группы контроля были сопоставимы с группой больных с ИМ по возрастно-половому составу и были соматически здоровыми.
Апоптоз мононуклеаров анализировали в образцах свежей крови методом двойной селективности с аннексином V, конъюгированным с FITC, с высокой аффинностью связывающийся с фосфатидилсерином, и витальным красителем 7-аминоактиномицином (7AAD). Мононуклеары выделяли из периферической крови на градиенте плотности «Фикол-гипак» Pharmacia Fine Chemicals (Швеция).
Цитометрический анализ выполнялся на проточном цитофлуориметре Navios (Beckman Coulter, США). На двухпараметрической диаграмме популяция клеток в апоптозе определялась в процентах от клеток общей численности мононуклеаров: положительные по аннексину V, но отрицательные по 7-ADD, т.е. клетки на ранней стадии апоптоза (AV+/7AAD-) и клетки на поздней стадии апоптоза (AV+/7AAD+).
Для определения в сыворотке крови концентрации HSP70 (нг/мл) иммуноферментным анализом (ИФА) использовался набор реагентов HSP70 High sensitivity ELISA (EnzoLifeScience, США). Уровень неоптерина (нмоль/л) измерялся с применением реагентов Neopterin ELISA (IBL international, Germany).
Статистическую обработку данных проводили с помощью программы STATISTICA 10.0. Описательные характеристики представлены медианой, 25-м и 75-м перцентилями. Для сравнения двух независимых групп выполнялся анализ ранговых вариаций с использованием непараметрического критерия Вилкоксона–Манна–Уитни. Корреляционные взаимосвязи между признаками оценивались посредством непараметрического критерия Спирмена. Отличия считались статистически значимыми при p <0,05.
Для выявления статистической значимости в трех и более исследуемых группах применялся критерий Краскела–Уоллиса с расчетом критического уровня статистической значимости. Уровень статистической значимости при четырех сравниваемых группах составил 0,009.
РЕЗУЛЬТАТЫ
Анализ содержания циркулирующих аннексин V-мононуклеаров у больных в зависимости от длительности ишемии миокарда представлен в таблице. Из нее видно, что чем раньше от момента развития ИМ был госпитализирован пациент, тем больше у него сохранялось жизнеспособных клеток и тем меньше их было на ранней стадии апоптоза, независимо от сопутствующей патологии. Если при госпитализации до 12 ч от приступа число клеток, находящихся на ранней стадии апоптоза, достоверно не отличалось от контрольных значений и составило 2,1 {1,6–2,9}%, то при более поздней госпитализации их число достоверно увеличилось до 3,8 {2,4–4,9}%, по сравнению как с контрольной группой (1,6 {0,8–2,4}%; р=0,005), так и с группой лиц с ИМ, госпитализированных в первые 12 ч (р=0,008).
Аналогичная картина наблюдалась и при госпитализации больных с коморбидной патологией. В первые часы госпитализации от момента приступа число клеток на ранней стадии апоптоза составило 4,8 {3,4–8,7}%, что было достоверно выше (р=0,005) по сравнению с контрольной группой и с группой лиц с ИМ+ХОБЛ при поздней госпитализации (р=0,006), когда явления апопотоза нарастали и достигали максимальных значений – 7,2 {4,1–12,3}%, что было статистически значимо выше по сравнению со всеми группами больных.
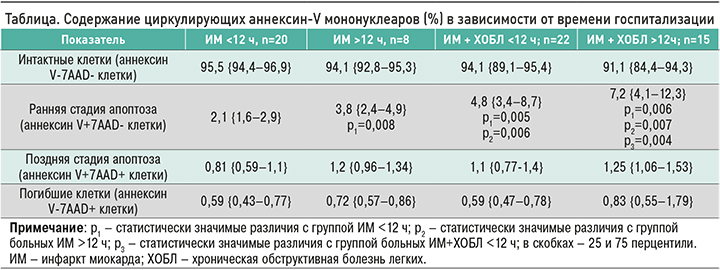
Далее был проанализирован уровень HSР70 в исследуемых группах в зависимости от времени поступления в стационар (рис. 1). У больных с ИМ, поступивших до 12 ч от момента приступа, уровень этого белка составил 0,52 {0,38–0,98} нг/мл, что было статистически значимо выше (р=0,006), чем у больных с ИМ, поступивших в сроки позже 12 ч (0,37 {0,29–0,44} нг/мл) и в группе контроля (0,12 {0,05–0,37} нг/мл). В группе больных с ИМ + ХОБЛ, госпитализированных в ранние сроки, уровень HSР70 был равен 0,93 {0,83–1,5} нг/мл; это достоверно превышало аналогичные значения в группе контроля (р=0,001), группе больных с ИМ, поступивших в аналогичные сроки (р=0,005) и в группе коморбидных больных при поздней госпитализации, уровень HSР70 у которых составил 0,77 {0,65–0,91} нг/мл (р=0,003).
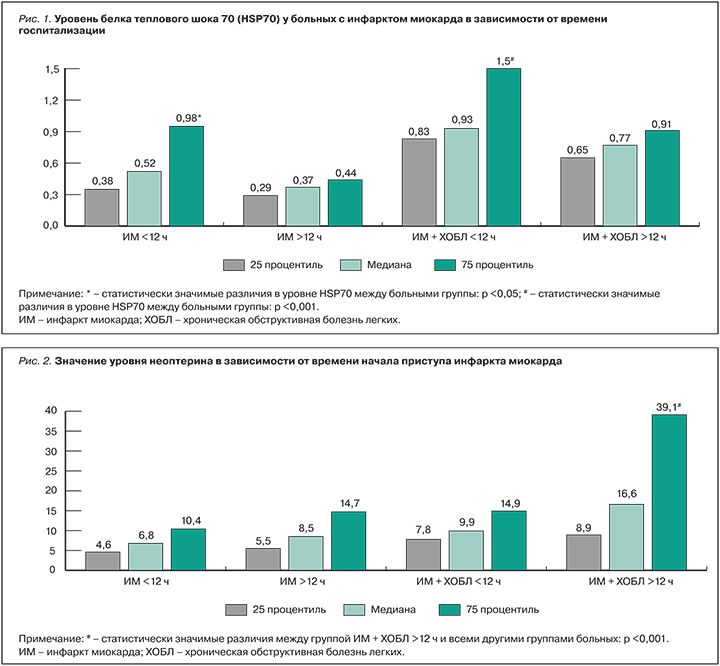
При исследовании концентрации неоптерина в зависимости от времени госпитализации было установлено, что чем позже были госпитализированы коморбидные больные с ИМ, тем выше у них был уровень этого вещества (рис. 2). При госпитализации больных с ИМ до 12 ч от развития заболевания уровень неоптерина составил 6,8 {4,6–10,4} нмоль/л, что достоверно не отличалось от группы ИМ при более поздней госпитализации – {8,5 5,5–14,7} нмоль/л. В то же время при госпитализации больных с ИМ на фоне ХОБЛ позже 12 ч от начала инфаркта уровень неоптерина достоверно повышался до 16,6 {8,9–39,1} нмоль/л в сравнении как с коморбидной группой при ранней госпитализации (9,9 {7,8–14,9}) нмоль/л; р=0,005), так и группами с мононозологией независимо от времени начала заболевания (р=0,001).
Увеличение уровня неоптерина в зависимости от длительности ишемии в коморбидной группе, вероятно, связано с накоплением токсических метаболитов (как вследствие асептического некроза кардиомиоцитов, так и хронического иммунного воспаления), а также с цитокиновым дисбалансом.
Таким образом, чем позже пациент после возникновения ИМ госпитализируется в стационар, тем продолжительнее ишемия миокарда; это сопровождается нарастанием аннексин V-зависимого апоптоза, увеличением концентрации неоптерина и снижением уровня HSP 70 в сыворотке крови, что наиболее выражено при ИМ на фоне ХОБЛ.
ОБСУЖДЕНИЕ
Долгосрочный прогноз после ИМ зависит от размера последнего, глубины и реперфузионного повреждения миокарда [9], что, в свою очередь, обусловлено общим временем ишемии, наличием и степенью коллатерализации, а также развитием микрососудистой обструкции [10]. В нашем исследовании было установлено, что длительность ишемии приводит к значительному увеличению апоптоза циркулирующих лимфоцитов с появлением некротических клеток. Обнаружено, что после ишемического события кардиомиоциты экспрессируют фосфатидилсерин на своей клеточной поверхности в течение как минимум 6 ч [11].
Выявленное нами увеличение концентрации неоптерина демонстрирует его участие в индукции апоптоза. Ранее нами было установлено, что самый высокий уровень HSР70 отмечался у больных ИМ на фоне ХОБЛ [12]. Полученное в данном исследовании повышение уровня HSP70 при ранней госпитализации и снижение его уровня при продолжительной ишемии, вероятно, обусловлено тем, что на начальных этапах острого коронарного синдрома большая масса кардиомиоцитов подвержена ишемическому стрессу, и с нарастанием числа апоптотических клеток увеличивается продукция HSР70. На более поздних этапах на фоне нарастания явлений апоптоза с появлением некроза миокарда происходит ослабление защитных возможностей HSP70, так как работа шаперона энергозависима, а в некротических клетках резко снижаются уровни АТФ из-за серьезного повреждения митохондрий и большого расхода энергии [13]. При развитии ИМ на фоне ХОБЛ по мере продолжительности ишемии нарастает гиперпродукция провоспалительных цитокинов [14], что может спровоцировать цитопатический эффект оксида азота, вызывающий дисфункцию митохондрий с фрагментацией ДНК, активацию апоптоза эндотелиальных клеток и угнетение синтеза HSР70.
ЗАКЛЮЧЕНИЕ
Таким образом, в апоптотической гибели клеток при ИМ участвуют различные межклеточные взаимодействия, которые вносят значительный вклад в повреждение миокарда. Это может отразиться на последующих процессах ремоделирования левого желудочка.


