ВВЕДЕНИЕ
Хроническая обструктивная болезнь легких (ХОБЛ) – хроническое прогрессирующее заболевание, представляющее серьезную медицинскую, экономическую и социальную проблему во всем мире. Распространенность ХОБЛ, по данным эпидемиологических исследований, составляет 11,7%, при этом тенденции к ее снижению в ближайшие десятилетия не намечается [1]. В связи с ростом распространенности курения в развивающихся странах и старением населения в странах с высоким уровнем доходов ожидается, что заболеваемость ХОБЛ вырастет в течение следующих 40 лет. В настоящее время ежегодно от этой болезни и ее осложнений умирают до 3 млн больных. По мнению экспертов, к 2060 г. количество летальных случаев превысит 5,4 млн [2, 3].
Отличительной чертой течения ХОБЛ является большое количество сопутствующих заболеваний, которые оказывают существенное влияние на течение болезни, качество жизни пациентов и прогноз в целом. В настоящее время сохраняется высоким интерес к изучению сочетанного течения ХОБЛ и сахарного диабета (СД) 2-го типа.
Последние годы характеризуются неуклонным ростом числа больных СД, что вполне обоснованно трактуется как неинфекционная пандемия. Согласно глобальному отчету Всемирной организации здравоохранения (ВОЗ) за 2018 г., во всем мире более 422 млн человек страдают СД [4], и это без учета тех пациентов, которые не знают о наличии у них диабета. А ведь количество таких больных в 3–4 раза превышает число тех, кому диагноз уже установлен. По данным Федерального регистра СД в РФ на 01.01.2019, на диспансерном учете состояло 4,58 млн человек (3,12% населения), из них 92% (4,2 млн) составляли пациенты с СД 2-го типа [5, 6].
Эскалация частоты сочетания ХОБЛ и СД обусловлено возрастанием встречаемости этих нозологий с возрастом и увеличением продолжительности жизни населения. По информации ряда авторов, риск развития ХОБЛ у больных СД составляет до 22%, тогда как риск формирования СД при ХОБЛ повышается до 40–100% [7, 8]. Патогенетические механизмы, лежащие в основе высокой распространенности СД при ХОБЛ, все еще остаются неясными и требуют детального и глубокого изучения. Принимая во внимание значимость проблемы, необходимо продолжить исследования по изучению точных механизмов тесной связи ХОБЛ и СД.
Целью настоящего исследования стало установление ведущих факторов неблагоприятного исхода у пациентов с сочетанием ХОБЛ и СД 2-го типа по результатам 10-летнего наблюдения.
МАТЕРИАЛ И МЕТОДЫ
Проведено одноцентровое проспективное наблюдательное исследование, в которое вошли 167 пациентов с изолированным течением ХОБЛ и сочетанием этой болезни с СД 2-го типа, проходившие лечение или наблюдение в Областной клинической больнице № 3 и Городском пульмонологическом центре г. Челябинска в 2008–2019 гг.
Диагноз ХОБЛ устанавливался на основании критериев GOLD (2008–2018) при отношении постбронходилатационных объема форсированного выдоха за 1-ю секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ) £0,7 [9, 10]. Диагноз СД 2-го типа устанавливался в соответствии с классификацией ВОЗ (1999–2003), клиническими рекомендациями «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» (4-й выпуск, 2009) на основании клинико-лабораторного обследования.
Основными критериями включения в исследование были информированное согласие на участие в исследовании, возраст старше 40 лет, наличие клинических диагнозов ХОБЛ и СД. Критериями исключения служили отсутствие информированного согласия больного, другие, кроме ХОБЛ, заболевания легких и дыхательных путей, вирус иммунодефицита человека (ВИЧ), злокачественные новообразования любой системы органов, неспособность понимать и выполнять диагностические процедуры.
Исследования выполнялись в стабильную фазу заболевания. У всех пациентов оценивались демографические показатели, статус курения, индекс курения (ИК), жалобы и данные анамнеза на основании медицинской документации (амбулаторной карты, выписки из карты стационарного больного). Для оценки питательного статуса пациентов использовался показатель индекса массы тела (ИМТ), который рассчитывался по общепринятой формуле: ИМТ = масса тела (кг) / рост (м2).
Тяжесть симптомов ХОБЛ определялась согласно оценочному тесту ХОБЛ (COPD Assessment Test – CAT) [9, 10]. Степень выраженности одышки определялась с помощью модифицированного вопросника Британского медицинского совета (Modified Medical Research Council questionnaire – mMRC) в баллах от 0 до 4. Пульсоксиметрия для оценки степени насыщения артериальной крови кислородом (SpO2) проводилась с помощью пульсоксиметра ChoiceMmed (Beijng Choice Electronic Technology Co., Ltd.).
Одним из ключевых параметров наблюдения выступала частота обострений ХОБЛ, под которыми понималось ухудшение симптомов заболевания, требующее изменения базисной терапии. Обострение классифицировалось как тяжелое при наличии показаний для госпитализации в круглосуточный стационар. Исследование функции легких проводилось при помощи спирографии с пробой с бронхолитиком (спирограф Microlab, MicroMedical Ltd., Великобритания) в соответствии с Федеральными клиническими рекомендациями [11].
Статистический анализ полученных данных осуществлялся с помощью программы Statistica для Windows 13. Критический уровень значимости p составил 0,05. Применялись методы описательной статистики. При анализе связей внутри групп использовался парный коэффициент корреляции Пирсона.
Всего в исследование были включены 167 пациентов, которые были разделены на 2 группы наблюдения:
- первая группа – 83 больных с изолированным течением ХОБЛ, из них 79 (95,2%) мужчин и 4 (4,8%) женщины (средний возраст 67,9±7,14 лет);
- вторая группа – 84 больных с сочетанием ХОБЛ и СД 2-го типа, из них 78 (92,9%) мужчин и 6 (7,1%) женщин (средний возраст 62,4± 6,3 года).
РЕЗУЛЬТАТЫ
Прежде всего было проанализировано количество умерших пациентов в группах наблюдения. Исходя из данных, представленных в таблице 1, количество умерших в группе пациентов с сочетанием ХОБЛ и СД было в 2,5 раза выше, чем в группе с изолированным течением. При исследовании причин смерти больных ведущей среди них в обеих группах была внебольничная пневмония. Особое внимание обращает на себя высокий уровень сердечно-сосудистых событий, таких как острый инфаркт миокарда, осложненный кардиогенным шоком, фатальные нарушения ритма сердца и тромбоэмболия легочной артерии, в группе пациентов с сочетанием ХОБЛ и СД 2-го типа.

Сравнительная характеристика наблюдаемых больных по таким параметрам, как демографические показатели, курение и длительность заболеваний, представлена в таблице 2.
Достоверных различий в возрасте между сравниваемыми группами выявлено не было. Пациенты с сочетанием ХОБЛ и СД имели более высокий ИМТ как в подгруппе живых, так и умерших больных по сравнению с пациентами с изолированным течением ХОБЛ.
Курение – ведущий фактор риска развития ХОБЛ. Все пациенты, вошедшие в исследование, курили. Наиболее высокая интенсивность курения, оцениваемая как индекс курения (ИК), наблюдалась в подгруппе умерших больных с ХОБЛ. В группе выживших больных с ХОБЛ и СД этот показатель был достоверно выше относительно пациентов с ХОБЛ без СД, продолживших наблюдение.
Достоверные различия между группой ХОБЛ + СД и группой контроля были получены по индексу массы тела (ИМТ). Наибольшая продолжительность заболевания отмечена в группе умерших пациентов с изолированной ХОБЛ, и этот показатель был статистически значимо выше в сравнении с умершими пациентами с сочетанием ХОБЛ и СД.
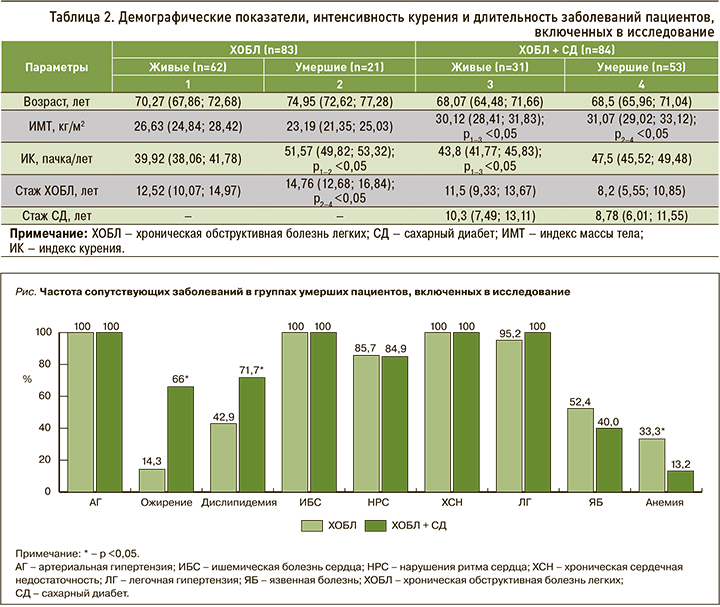
Высокая распространенность артериальной гипертензии (АГ), ишемической болезни сердца (ИБС), включая различные формы нарушений ритма сердца и развитие хронической сердечной недостаточности (ХСН), характерна как для пациентов с изолированной ХОБЛ, так и с сочетанием ХОБЛ и СД (рис.). В группе коморбидных пациентов достоверно чаще встречались ожирение и дислипидемия, что, вероятно, служит дополнительным фактором риска неблагоприятного исхода.
Исходя из данных, представленных в таблице 3, особенностью клинического течения ХОБЛ в сочетании с СД 2-го типа является высокая частота обострений и большая их продолжительность в сравнении с изолированным течением заболевания. В группе умерших пациентов как с ХОБЛ, так и с сочетанным течением наблюдалась достоверно большая частота госпитализаций, в том числе и в отделении реанимации и интенсивной терапии (ОРИТ), при этом им требовалось более длительное стационарное лечение. Наибольшая частота развития внебольничных пневмоний отмечалась в группе умерших пациентов с ХОБЛ и СД, и этот показатель был достоверно выше по сравнению с умершими пациентами с изолированной ХОБЛ.
Клинические особенности умерших пациентов как с ХОБЛ, так и с сочетанием ХОБЛ и СД – более тяжелая одышка, значительное негативное влияние на качество жизни пациентов (по результатам САТ-теста), выраженные обструктивные нарушения по сравнению с больными, продолжающими наблюдение (табл. 4).
Анализ данных, приведенных в таблице 5, свидетельствует в высокой частоте применения ингаляционных кортикостероидов (ИГКС) как в составе двойной, так и тройной терапии в группах умерших пациентов с ХОБЛ (81%) и сочетанием ХОБЛ и СД (90,6%). Среди больных, продолжающих наблюдение, основное место занимает двойная бронходилатационная терапия (5 и 80,65% соответственно).
ОБСУЖДЕНИЕ
Многочисленными исследованиями подчеркивается огромная роль сопутствующих заболеваний со значительными внелегочными системными проявлениями (в том числе СД 2-го типа) в увеличении тяжести течения ХОБЛ, влиянии на качество жизни и выживаемость пациентов [7, 8, 12–14]. В настоящее время имеется ограниченное число публикаций, посвященных изучению факторов, влияющих на течение и прогноз при сочетанном течении ХОБЛ и СД 2-го типа.
Целью настоящего исследования стало выявление основных факторов неблагоприятного исхода у пациентов с ХОБЛ и СД 2-го типа. Было продемонстрировано, что при длительном наблюдении ведущей причиной смерти в обеих наблюдаемых группах пациентов была внебольничная пневмония, однако число умерших в группе коморбидных пациентов оказалось в 2,5 раза выше, чем при изолированном течении ХОБЛ. Само по себе наличие СД увеличивает риск развития легочных инфекций из-за возникающих нарушений микроциркуляции и дисфункции иммунной системы. Сочетанное течение заболеваний характеризуется высокой частотой инфекционных обострений ХОБЛ и возрастанием числа пневмоний.
Курение – первая по значимости предпосылка развития ХОБЛ. В настоящее время эксперты также выделяют курение как фактор риска развития СД 2-го типа. Ряд авторов относит курение к предикторам смерти у больных СД [15]. Все пациенты, включенные в настоящее исследование, курили. Наиболее высокая интенсивность курения (ИК ≥45 пачка/лет) наблюдалась в подгруппах умерших пациентов как с изолированным течением ХОБЛ, так и сочетанием ХОБЛ и СД. Таким образом, курение не только выступает общим фактором риска развития этих заболеваний, но и негативно влияет на дальнейший прогноз.
Избыточная масса тела и ожирение также относятся к факторам тяжелого течения и неблагоприятного исхода у пациентов с сочетанием ХОБЛ и СД. ИМТ в группе коморбидных пациентов был достоверно выше относительно больных без СД.
Полиморбидность является не только одной из особенностей современной клиники внутренних болезней, но и связана с неблагоприятными исходами [16]. Полученные нами данные подтверждают, что ХОБЛ ассоциируется прежде всего с патологией сердечно-сосудистой системы: АГ (95,2%), ИБС (92,8%), ХСН (94,6%). В то же время такие факторы риска, как ожирение (66,7%) и дислипидемия (67,9%), выявлялись чаще у пациентов с сочетанием ХОБЛ и СД 2-го типа. Несмотря на то что в ряде исследований продемонстрирован так называемый парадокс ожирения у больных ХОБЛ [17, 18], присоединение СД может быть сопряжено с неблагоприятным исходом.
Среди основных причин прогрессирования ХОБЛ первостепенное значение имеют повторные тяжелые обострения, которые способствуют увеличению числа госпитализаций, усугубляют нарушения вентиляционной функции легких, значимо снижают качество жизни пациентов и повышают смертность. По данным литературы, у пациентов с ХОБЛ и СД отмечается повышение числа обострений ХОБЛ, увеличение продолжительности госпитализаций, более высокий уровень смертности [19]. Полученные нами результаты подтверждают, что большое количество (≥2 в течение года) и длительность обострений ХОБЛ, повторные госпитализации, включая нахождение в условиях ОРИТ, ассоциированы с риском неблагоприятного исхода.
Клиническое течение ХОБЛ в группе коморбидных пациентов характеризуется более выраженной одышкой, что подтверждалось значимой бронхиальной обструкцией по данным спирографии и тенденцией к снижению насыщения артериальной крови кислородом. Данные изменения могут быть обусловлены не только избыточной массой тела, но и дополнительным негативным влиянием СД на легочную ткань, связанным с поражением микроциркуляторного русла легких.
Одним из сложных вопросов остается необходимость использования ГКС при лечении ассоциации ХОБЛ и СД. В реальной клинической практике врачи часто не следуют клиническим рекомендациям и избыточно назначают ИГКС [20]. В настоящее время убедительно показано, что использование этой группы препаратов у пациентов с ХОБЛ сопряжено с определенным риском развития нежелательных явлений, включая угрозу развития пневмонии и плохой контроль над СД [21, 22]. Доказано, что при длительном применении ИГКС оказывают иммуносупрессивное действие в отношении клеточного звена иммунитета, при этом также повышается восприимчивость ко всем типам внутриклеточных инфекций [23]. По данным крупного когортного исследования [22], терапия ИГКС на 34% повышает риск развития и прогрессирования сахарного диабета. Полученные нами данные демонстрируют, что в группах умерших пациентов как с изолированным течением ХОБЛ, так с ее сочетанием с СД отмечалась высокая частота применения ИГКС (81 и 90,6% соответственно). При этом в группах, продолжающих наблюдение, основное место занимает двойная бронходилатационная терапия. Избыточное и необоснованное использование ИГКС, высокая вероятность развития серьезных побочных эффектов могут быть ассоциированы с риском неблагоприятных исходов у пациентов с ХОБЛ.
ЗАКЛЮЧЕНИЕ
По результатам 10-летнего наблюдения пациентов с сочетанием ХОБЛ и СД 2-го типа можно сделать следующие выводы:
- сочетанное течение ХОБЛ и СД 2-го типа повышает риск неблагоприятного исхода;
- основными причинами смерти пациентов с ХОБЛ были внебольничная пневмония и сердечно-сосудистые заболевания;
- факторами риска летального исхода выступают высокий ИК, избыточная масса тела, частые (≥2) обострения ХОБЛ и госпитализации в течение года;
- избыточное применение ИГКС ассоциировано с риском развития неблагоприятного исхода как при изолированном течении ХОБЛ, так и при сочетании ХОБЛ и СД 2-го типа.



