ВВЕДЕНИЕ
Фибрилляция предсердий (ФП) представляет собой одно из самых распространенных нарушений ритма сердца и связана с повышенной угрозой развития кардиоваскулярных осложнений, в связи с чем остается одной из важнейших проблем современного здравоохранения [1]. К числу опасных осложнений при ФП относятся тромбоэмболии, сердечная недостаточность, аритмогенная кардиомиопатия [2]. Литературные данные свидетельствуют о риске внезапной сердечной смерти при данной аритмии [3].
Различными учеными выявлены генетические предикторы, располагающие к развитию ФП. Большинство известных генетических полиморфизмов может оказывать влияние на структуру и функционирование ионных каналов [4–6]. Описаны клинические случаи, носящие наследственный характер: в этих случаях ФП наследуется по аутосомно-доминантному типу [7–12].
В клинической практике наиболее распространена ФП, возникающая как совокупность взаимодействия различных факторов. Для нее характерно взаимное переплетение и влияние генетических предпосылок и условий окружающей среды, которые в совокупности одновременно способствуют инициации и пролонгации развития ФП.
Цель исследования – оценить возможность прогнозирования развития ФП, учитывая генетические предикторы заболевания, методом множественной логистической регрессии.
МАТЕРИАЛ И МЕТОДЫ
Основную группу исследования составили 224 пациента с установленным диагнозом ФП – 111 мужчин (49,6%) и 113 женщин (50,4%). 139 из них была выполнена катетерная аблация. Среди пациентов с оперативным лечением у 37 человек была диагностирована первичная ФП, остальные 102 имели вторичную форму ФП. Остальные пациенты – без оперативного лечения (85 человек) – также страдали вторичной формой ФП. Средний возраст пациентов основой группы составил 61,47±10,62 года: у мужчин – 58,18±10,16 лет, у женщин – 64,70±10,09 года. Медиана возраста основной группы равнялась 61,00 года (28,00; 89,00): у мужчин – 58,00 лет (28,00; 84,00), у женщин – 64,00 года (28,00; 89,00).
Набор пациентов проводился на базе двух стационаров г. Красноярска. Пациенты с ФП, которым проводилось оперативное вмешательство (n=139), были обследованы на базе Федерального центра сердечно-сосудистой хирургии г. Красноярска. Остальные 85 участников проходили стационарное лечение в кардиологических отделениях Красноярской межрайонной клинической больницы № 20 им И.С. Берзона.
Дизайн исследования соответствовал Национальному стандарту РФ «Надлежащая клиническая практика» (Good Clinical Practice), ГОСТ P 52379-2005.
Критерии включения пациентов в основную группу исследования:
- подтвержденный диагноз ФП согласно рекомендациям Российского кардиологического общества, Европейского общества кардиологов: нерегулярные интервалы RR, наличие F-волны, отсутствие отчетливых зубцов Р при систематической записи электрокардиограммы (ЭКГ);
- лица мужского и женского пола;
- проживание обследуемого в Сибирском федеральном округе;
- принадлежность к европейской популяции;
- способность обследуемого выполнять условия исследования;
- добровольное информированное согласие на исследование, в том числе проведение молекулярно-генетического исследования.
Критерии исключения:
- наличие ФП, ассоциированной с клапанной патологией;
- неуточненный диагноз нарушений сердечного ритма;
- проживание вне Сибирского федерального округа;
- принадлежность пациента к иным расам, за исключением европеоидной;
- неспособность обследуемого выполнить необходимые условия исследования;
- отказ от участия в исследовании.
Для сравнения изучаемых полиморфизмов использовали контрольную группу пациентов, собранную НИИ терапии и профилактической медицины – филиалом Федерального исследовательского центра Институт цитологии и генетики Сибирского отделения РАН. Основой для набора этой группы служила популяционная выборка жителей Кировского и Октябрьского районов Новосибирска из 9400 человек, сформированная в рамках международного проекта HAPPIE (Health, Alcohol and Psychological factors In Eastern Europe). Из этой большой когорты в наше исследование был включен 171 человек – 88 мужчин (51,5%) и 83 женщины (48,5%). Средний возраст в этой группе составил 56,00±8,27 лет: 54,00±9,40 лет у мужчин и 59,00±5,98 лет у женщин. Медиана возраста – 56,00 лет (32,00; 69,00): у мужчин – 54,00 лет (32,00; 68,00), у женщин – 59,00 лет (43,00; 69,00). Никто из лиц контрольной группы не состоял в родственных связях с пациентами основной группы, кроме того, у всех 171 пациента не было диагноза ФП.
Наряду с общеклиническими методами всем пациентам с ФП проводились инструментальные методы исследования, такие как ЭКГ, холтеровское мониторирование ЭКГ, при необходимости для верификации этиологического фактора ФП – велоэргометрия, чреспищеводная стимуляция левого предсердия, коронароангиография.
Всем пациентам основной и контрольной групп было выполнено молекулярно-генетическое исследование.
При проведении генотипирования в случае с ОНВ 10824026 верификация частот генотипов и аллелей полиморфизма A/G гена SYNPO2L была выполнена у 204 человек основной группы и 157 пациентов группы контроля.
При исследовании ОНВ 3740293 A/C гена MYOZ1 молекулярно-генетическое исследование было проведено 187 из 224 пациентов основной группы и 109 лицам контрольной группы.
Статистическая обработка материала осуществлялась с использованием пакета прикладных программ EXСEL и STATISTICA FOR WINDOWS.
РЕЗУЛЬТАТЫ
Результаты анализа полиморфизма А/G гена SYNPO2L среди больных с ФП (пациентов с проведенной радиочастотной аблацией и без нее) и у лиц контрольной группой представлены ниже (табл. 1).
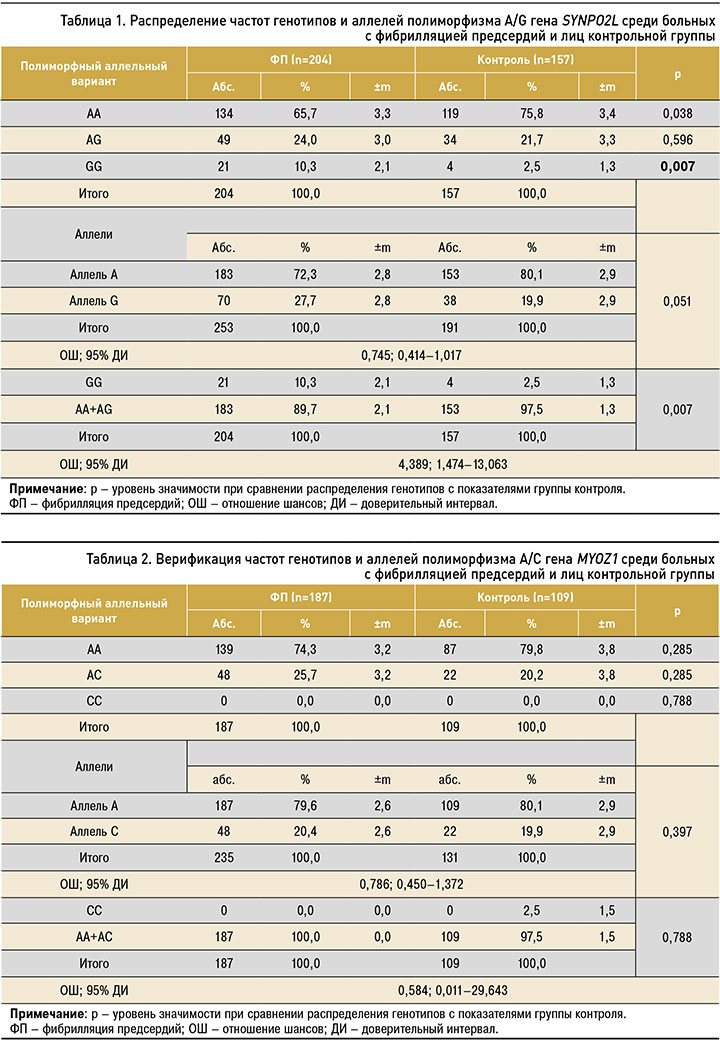
Частота встречаемости распространенного гомозиготного генотипа A/A среди больных с ФП составила 65,7±3,3%, гетерозиготного генотипа A/G – 24,0%±3,0, редкого гомозиготного генотипа G/G – 10,3%±2,1. В контрольной группе преобладал гомозиготный генотип A/A – 75,8%±3,4 случаев, количество носителей гетерозиготного генотипа A/G составило 21,7%±3,3, а гомозиготного генотипа G/G по редкому аллелю – 2,5%±1,3. Таким образом, редкий гомозиготный генотип GG статистически значимо чаще преобладал в группе пациентов с ФП по сравнению с лицами контрольной группы, что доказывает ассоциативную связь ФП с гомозиготным генотипом G /G гена SYNPO2.
Результаты анализа полиморфизма А/C гена MYOZ1 среди больных с ФП (пациентов с проведенной радиочастотной аблацией и без нее) и лиц контрольной группой представлены в таблице 2.
Встречаемость распространенного гомозиготного генотипа A/A среди больных с ФП составила 74,3%±3,2, гетерозиготного генотипа A/С – 25,7%±3,2, редкого гомозиготного генотипа С/С – 0,0%±0,0. В контрольной группе преобладал гомозиготный генотип A/A – 79,8%±3,8, количество носителей гетерозиготного генотипа A/С равнялось 20,2%±3,8, а гомозиготного генотипа С/С – 0,0%±0,0 (см. табл. 2). Статистически значимых различий выявлено не было.
В рамках логистического регрессионного анализа на первом этапе оценивалась значимость предполагаемых генетических предикторов для всех случаев ФП (табл. 3).
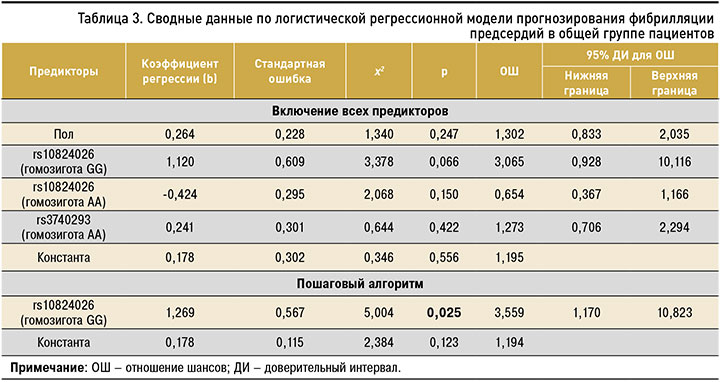
Результаты выполненного многофакторного анализа методом принудительного включения не продемонстрировали статистически значимого влияния ни одного из рассматриваемых предикторов. В то же время статистически значимая (χ2=9,559; р=0,049) однофакторная регрессионная модель с пошаговым включением единственного предиктора демонстрирует значимое увеличение шансов развития ФП при наличии у пациента генотипа GG гена rs10824026 по сравнению с другими аллельными вариантами (АА и АG). При этом отношение шансов (ОШ) составляет 3,559 (95% доверительный интервал (ДИ): 1,170–10,823).
Данная модель представлена следующим уравнением: p = 1/ (1 + e–(0,178 + 1,296x)), где р – вероятность наличия у пациента ФП; х – наличие генотипа GG гена rs10824026 (есть – 1, нет – 0); е – основание натурального логарифма 2,72.
В целом для всех случаев ФП коэффициент детерминации (R2) составил 0,039 (статистически значимое объяснение данным генетическим фактором дисперсии зависимой переменной в исследуемой группе пациентов только на 3,9%). Представленная модель обладает максимальной специфичностью в плане прогнозирования отсутствия возникновения ФП (в 100% случаев) при отсутствии правильных предсказаний случаев развития ФП. С учетом этого общее число корректных предсказаний составило 56,1%.
По результатам построения ROC-кривой (рис. 1) показатель AUC составил 0,557±0,035 (ДИ 95%: 0,488–0,627). При этом показатель площади под кривой не был статистически значимым (р=0,093), в связи с чем прогностическое качество данной модели может быть оценено как неудовлетворительное.

В связи с неудовлетворительными результатами оценки прогностической модели развития ФП для общей группы пациентов было решено провести аналогичный анализ при разделении группы пациентов с ФП на подгруппы в зависимости от течения заболевания и его формы (первичная или вторичная).
Вначале был сделан логистический регрессионный анализ для отдельно выделенной группы пациентов с пароксизмальным течением ФП и группы пациентов, включающей все остальные варианты течения ФП (персистирующее, длительно персистирующее и постоянное). Результаты анализа предикторов для пароксизмального течения ФП представлены в таблице 4.
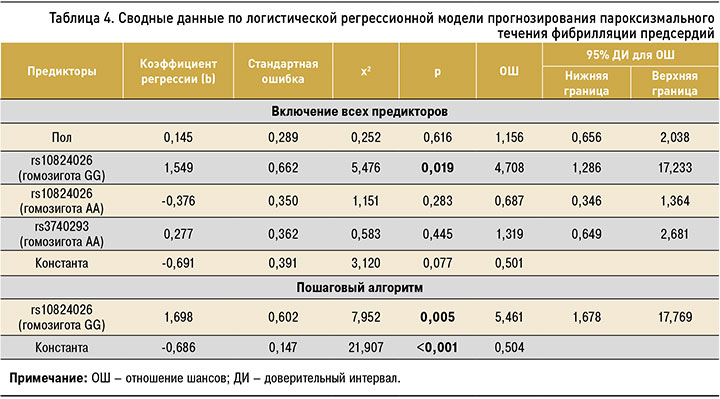
При включении всех предикторов в многофакторный анализ статистически значимое влияние на развитие пароксизмальной формы ФП показало только наличие генотипа GG гена rs10824026 (р=0,019). Однофакторная регрессионная модель является статистически значимой (χ2=9,223; р=0,002). Согласно ей присутствие у пациента генотипа GG гена rs10824026 увеличивает шансы развития пароксизмальной формы ФП (ОШ=5,461; 95% ДИ: 1,687–17,769). Данную модель описывает следующее уравнение регрессии: p = 1 / (1 + e–(0,686 + 1,986x)), где р – вероятность наличия у пациента ФП; x – наличие генотипа GG гена rs10824026 (есть – 1, нет – 0); е – основание натурального логарифма 2,72.
Коэффициент детерминации данной модели (R2=0,055) дает статистически значимое объяснение присутствием в генотипе аллеля G вероятности развития пароксизмальной ФП на 5,5%. При этом модель имеет специфичность 93,2% для предсказания отсутствия пароксизмального течения ФП и с чувствительностью 13,6% предсказывает его наличие. Всего корректными оказались 67,0% прогнозов.

По результатам построения ROC-кривой (рис. 2), показатель AUC составил 0,564±0,038 (95% ДИ: 0,490–0,638). Поскольку нижняя граница ДИ AUC оказывается меньше уровня вероятности 0,5, данный показатель не является статистически значимым (р=0,087), что не соответствует удовлетворительному качеству прогностической модели, несмотря на доказанное значимое влияние на развитие ФП с пароксизмальным течением генетического фактора, входящего в эту модель.
Регрессионный анализ предикторов для остальных вариантов течения ФП (т.е. всех, не считая пароксизмальной) представлен в таблице 5. Из нее видно, что ни один из рассматриваемых предикторов не играл статистически значимой роли в группе пациентов с персистирующим, длительно персистирующим и постоянным течением ФП. Алгоритм с пошаговым включением предикторов в модель также не выявил ни одного статистически значимого фактора.
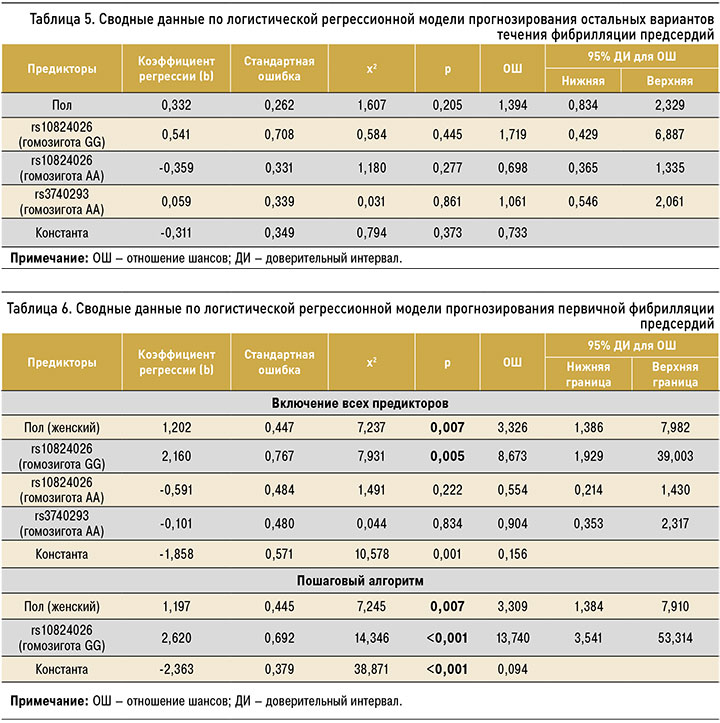
На следующем этапе анализа были составлены регрессионные логистические модели для первичной и вторичной форм ФП. Результаты анализа предполагаемых предикторов развития первичной формы ФП представлены в таблице 6. Как видно, к предикторам, статистически значимо повышающим вероятность развития первичной ФП, относятся пол (частота первичной ФП при наличии генотипа GG в исследуемой группе статистически значимо выше среди женщин – ОШ=3,309; 95% ДИ: 1,384–7,910) и наличие у пациента генотипа GG гена rs10824026 (ОШ=13,740; 95% ДИ: 3,541–53,314). Присутствие генотипа GG гена rs10824026 в сочетании с женским полом демонстрирует свою статистическую значимость как в многофакторном, так и в пошаговом варианте анализа.
Регрессионная модель первичной ФП представлена следующим уравнением: p = 1/ (1 + e–(–2,363 + 2,197x1 + 2,620x2)), где р – вероятность наличия у пациента АС; х1 – пол (женский); х2 – наличие генотипа GG гена rs10824026 (есть – 1, нет – 0); е – основание натурального логарифма 2,72.
Модель является статистически значимой (р <0,001) и согласуется с исходными данными по критерию Хосмера–Лемешева (0,621). Данная модель дает наиболее высокий коэффициент детерминации из всех рассмотренных – 0,197, т.е. показывает статистически значимое объяснение вероятности развития первичной ФП включенными в модель факторами на 19,7%. Специфичность данной модели составила 97,5% при чувствительности 24,4% и общей прогностической точности 82,3%.
По результатам построения ROC-кривой (рис. 3) показатель AUC составил 0,706±0,047 (95% ДИ: 0,615–0,798; р <0,001), что соответствует хорошему качеству прогностической модели.

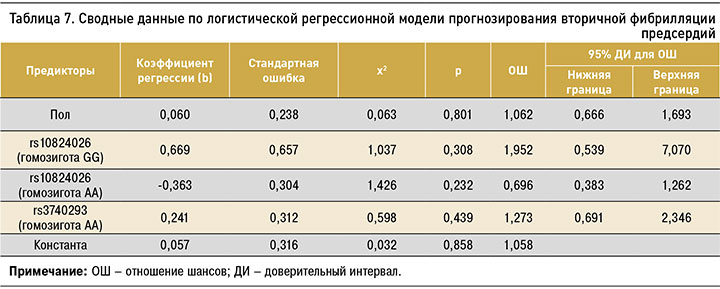
Результаты регрессионного анализа для вторичной формы ФП представлены в таблице 7. Ни многофакторный, ни пошаговый варианты регрессионного анализа не выявили статистически значимых предикторов для развития этой формы заболевания.
ЗАКЛЮЧЕНИЕ
SYNPO2L кодирует сигнальные белки, которые локализуются на Z диске и модулируют сердечную саркомерную функцию, т.е. Z диски определяют эластичность кардиомиоцитов. Преобладание гомозиготного генотипа GG rs10824026 гена SYNPO2L провоцирует изменение эластичности кардиомиоцитов, запуск механизма re-entry и развитие ФП.
При помощи проведенного нами логистического регрессионного анализа подтверждена предиктивная значимость наличия генотипа GG rs10824026 гена SYNPO2L для развития ФП, в большей степени для ее пароксизмальной формы. Наиболее значимо данная зависимость реализуется при первичной форме ФП у пациентов женского пола, что подтверждается наилучшей оценкой прогностических характеристик соответствующей регрессионной модели. Для rs3740293 гена MYOZ1не было обнаружено ни одной значимой взаимосвязи.


