ВВЕДЕНИЕ
В большинстве экономически развитых стран сердечно-сосудистая патология и ее осложнения, включая инфаркт миокарда и острое нарушение мозгового кровообращения (ОНМК), служат основной причиной смертности взрослого населения. Не вызывает сомнения, что заболевания именно атеросклеротического генеза вносят существенный вклад в показатели смертности [1].
Клиническое значение выявления периферического атеросклероза определяется крайне неблагоприятным прогнозом и необходимостью комплексного подхода в отношении диагностики и тактики ведения данной категории пациентов [2].
Оценка распространенности и степени тяжести атеросклеротического поражения сосудов – предмет множества крупномасштабных исследований [3]. Например, по данным регистра ACTION, пациентам с обострением ишемической болезни сердца (ИБС) на фоне мультифокального атеросклеротического поражения реже проводили реваскуляризацию коронарных артерий; также у них были ограничены возможности применения гиполипидемической терапии [4].
В регистре REACH мероприятия по вторичной профилактике сердечно-сосудистых заболеваний у пациентов обсуждаемой группы были менее эффективными [5]. Так, частота неблагоприятных сердечно-сосудистых событий у них в течение 2 лет в 1,6 раза превышала данный показатель среди лиц с поражением одного артериального бассейна. Ухудшение прогноза при сочетанном поражении нескольких артериальных бассейнов отмечалось у пациентов с ОНМК или периферическим атеросклерозом и острым коронарным синдромом при условии выполнения реваскуляризации миокарда [6].
В последнее время интерес к исследованиям, направленным на прогнозирование сердечно-сосудистого риска у лиц с периферическим атеросклерозом, значительно возрос. Основные задачи таких исследований – получение данных о частоте, особенностях патологического процесса и прогнозирование отдаленных исходов у пациентов очень высокого сердечно-сосудистого риска.
Целью нашего исследования стало изучение влияния атеросклеротического поражения различных сосудистых бассейнов на отдаленный прогноз и оптимизация прогнозирования фатальных и нефатальных случаев инсульта у больных с периферическим атеросклерозом.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 519 пациентов с поражением различных сосудистых бассейнов, находившихся на лечении в профильных отделениях ГБУ РО «Ростовская областная клиническая больница», из них 360 (69,4%) мужчин и 159 (30,6%) женщин. Средний возраст обследованных больных составил 60,0±8,7лет.
Всем пациентам были проведены стандартные биохимические исследования по оценке показателей липидного обмена (общего холестерина, холестерина липопротеидов высокой и низкой плотности, индекса атерогенности, триглицеридов), уровня креатинина, мочевины. Скорость клубочковой фильтрации (СКФ) рассчитывалась по формулам MDRD и CKD-EPI.
Комплекс инструментальных исследований включал регистрацию электрокардиограммы (ЭКГ) в покое, холтеровское мониторирование ЭКГ, ультразвуковое исследование (УЗИ) сердца, почек, сонных сосудов, коронароангиографию (КАГ) для определения степени поражения коронарных сосудов, ангиографию почечных, сонных артерий и артерий нижних конечностей.
Вторым этапом работы стало проспективное наблюдение за пациентами в течение 3 лет с оценкой конечных точек.
Статистический анализ полученных результатов выполнялся с помощью набора прикладных статистических программ Microsoft Office Excel 2010 (Microsoft Corp., США) и STATISTICA 10.0 (StatSoft Inc., США). С целью оценки типа распределения данных применялся анализ Колмогорова–Смирнова, при значениях p >0,05 распределение считали не отличающимся от нормального.
Описательную статистику проводили с определением следующих особенностей: данные представляли в виде M±SD (где M – среднее арифметическое, SD – стандартное отклонение) при нормальном распределении и в виде Me [Q1; Q3] (где Me – медиана, Q1 и Q3 – первый и третий квартили) при ненормальном распределении. В случае нормального распределения выборки при сравнении двух независимых выборок использовали критерий Стьюдента, а при отличии от нормального – критерии Манна–Уитни и χ2 или тест Левена с определением F. Также применялся логистический регрессионный анализ с расчетом относительных рисков (OR) и определением χ2. Связь считалась статистически значимой при значении р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Несмотря на значительные успехи, достигнутые в области диагностики и лечения заболеваний сердечно-сосудистой системы, связанных с атеросклерозом, а также внедрение в широкую клиническую практику реперфузионной терапии, эндоваскулярных вмешательств и дезагрегантной терапии, подавляющее большинство пациентов имеет неблагоприятный отдаленный прогноз [7]. Для комплексного учета взаимовлияния факторов риска широкое распространение получила стратегия оценки суммарного сердечно-сосудистого риска [8].
Согласно данным ряда широкомасштабных исследований, в популяции взрослого населения сочетание двух факторов риска встречается в 4,3–12,9%, а трех – в 4,8–7,6% случаев [9]. Данные исследования PROCAM продемонстрировали, что сочетание двух и более факторов сердечно-сосудистого риска приводит к значительному увеличению числа случаев внезапной смерти и острых ишемических событий [10]. Несомненно, при оценке вероятности развития сердечно-сосудистых событий необходимо принимать во внимание все основные факторы риска и оценивать их влияние на суммарный показатель в отношении отдаленного прогноза [11].
В ходе нашей работы был выполнен анализ встречаемости различных конечных точек в процессе 3-летнего проспективного наблюдения у лиц с периферическим атеросклерозом. Проведенный статистический анализ данных выявил, что у 123 (28,9 %) пациентов верифицированы сосудистые события, причем сосудистый эпизод в течение первого года отмечен у 11 (9,3%), в течение двух лет – у 60 (48,5%), в течение трех лет – у 52 больных (42,2%).
В процессе наблюдения были определены следующие конечные точки: острый инфаркт миокарда, транзиторная ишемическая атака, госпитализация по поводу сердечной недостаточности, стенокардии, хронической болезни почек, ампутация нижней конечности и инсульт. Последний был зафиксирован у 6,1% больных.
Согласно данным литературы, у большей части пациентов с цереброваскулярными заболеваниями имеется в анамнезе кардиальная патология, что вполне объяснимо неразрывной связью их патогенетических механизмов [12]. Так, 90% пациентов с инсультом в анамнезе страдали артериальной гипертензией,75% таких пациентов имели сердечно-сосудистые заболевания, в том числе хроническую сердечную недостаточность, пороки сердца, ИБС и т.д. [13].
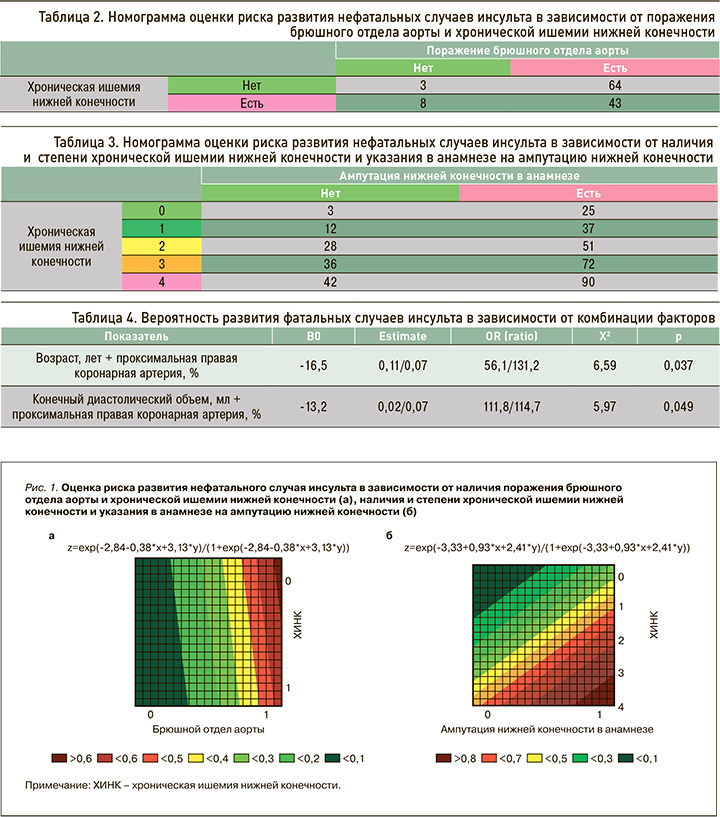
В ходе двухфакторного логистического регрессионного анализа нами был получен комплекс факторов, оказывающих свое влияние на риск развития нефатальных случаев инсульта, а именно «хроническая ишемия нижней конечности (ХИНК) + атеросклеротическое поражение брюшного отдела аорты» (р=0,043), «ампутация нижней конечности в анамнезе + ХИНК» (р=0,017; табл. 1).

С использованием уравнений логистической регрессии были составлены номограммы, позволяющие оценить риск развития нефатальных случаев инсульта в зависимости от факторов риска (рис. 1). Так, в случае наличия у пациента ХИНК и атеросклеротического поражения брюшного отдела аорты величина обсуждаемого риска составила 43%. При этом, если у больного верифицирована ХИНК, но отсутствует поражение брюшного отдела аорты, риск развития нефатальных случаев инсульта равен лишь 8% (табл. 2).
При наличии у пациента ХИНК 1-й степени и указании в анамнезе на ампутацию нижней конечности риск развития нефатальных случаев инсульта был равен 37%. В случае верификации того же комплекса факторов при условии наличия ХИНК 2-й стадии обсуждаемый риск составил 51%, тогда как при наличии ХИНК 2-й степени, но отсутствии в анамнезе ампутации – 28% (табл. 3).
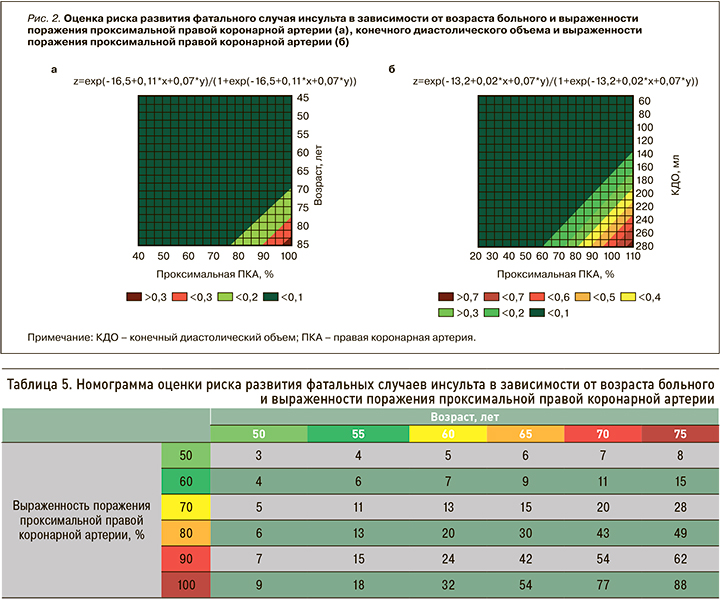
В отношении конечной точки – фатальных случаев инсульта – в ходе двухфакторного логистического регрессионного анализа свою статистическую значимость продемонстрировали следующие комбинации: «возраст, лет + проксимальная правая коронарная артерия (ПКА)» (р=0,037), «конечный диастолический объем (КДО), мл + проксимальная ПКА» (р=0,049; табл. 4).
Известно, что одним из основных факторов риска развития инсульта является возраст: так, у людей старше 55 лет риск патологического события может удваиваться на каждое последующее десятилетие [14]. Процесс старения влияет на различные биологические изменения в организме – как на состояние сердечно-сосудистой системы, так и на способность нейронных систем сопротивляться патологическим факторам [15].
По аналогии с предыдущей конечной точкой с помощью уравнений логистической регрессии нами были разработаны номограммы с целью оценки представленного выше риска (рис. 2).
Роль гемодинамически незначимого (субклинического) атеросклероза изучалась в исследовании COURAGE. Согласно полученным результатам, прогноз исследованных пациентов существенно не отличался от такового в группе лиц со значимыми атеросклеротическими поражениями, которым проводилась эндоваскулярная коррекция атеросклероза с хорошим клиническим результатом [16].
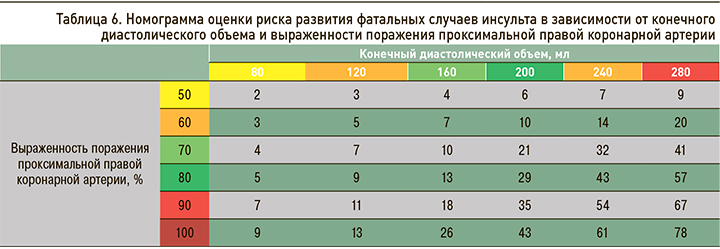
Таким образом, развитие сердечно сосудистых событий и неблагоприятных исходов может определяться наличием малых атеросклеротических бляшек на участках артериального русла за пределами зоны значимого стенозирования и их дестабилизацией [17]. Так, в случае возраста пациента 60 лет и наличии у него стенозирования проксимальной ПКА 70% риск развития фатального инсульта в нашем исследовании составил 13%, а при окклюзии представленного сосуда у того же больного – 32%. В возрасте 70 лет при верифицированном поражении проксимальной ПКА 80% обсуждаемый риск был равен 43%, а в случае той же степени поражения сосуда, но у пациента в возрасте 75 лет – 49% (табл. 5).
Вторая составленная номограмма для оценки риска развития фатальных случаев инсульта у пациентов с периферическим атеросклерозом продемонстрировала следующие данные: при наличии стенозирования проксимальной ПКА, например, 60% и значении КДО 80 мл обсуждаемый риск равен 3%, при окклюзии сосуда и аналогичном значении КДО – 9%. В случае стенозирования проксимальной ПКА, например, 90% и значении КДО 160 мл аналогичный показатель составил 18%, а при том же значении КДО, но 70%-ном стенозировании сосуда – 10% (табл. 6).
ЗАКЛЮЧЕНИЕ
В нашей работе при помощи двухфакторного логистического регрессионного анализа выявлена комбинация признаков, оказывающих влияние на риск развития фатальных и нефатальных случаев инсульта у пациентов высокого сердечно-сосудистого риска. Разработаны оригинальные номограммы для оценки риска инсульта у больных с периферическим атеросклерозом, которые могут служить дополнительным методом оценки сосудистых событий.


