ВВЕДЕНИЕ
Увеличение доли пожилых людей в возрастной структуре населения ассоциировано с нарастанием количества хронических заболеваний. По мере изменения демографической ситуации повышается вклад патологий органов кровообращения в общее бремя болезней и смертности, отмечается тенденция к увеличению числа пациентов с сердечной недостаточностью [1].
Хроническая сердечная недостаточность (ХСН) представляет собой комплексный клинический синдром, при котором нарушение функции сердца вызывает или увеличивает в последующем риск возникновения симптомов и признаков снижения сердечного выброса и/или приводит к легочному либо системному застою в состоянии покоя или при нагрузке. Синдром ХСН связан с широким спектром нарушений функции левого и правого желудочков (или клапанов сердца) и характеризуется прогрессирующим характером течения [2].
В мире более 26 млн человек страдают этим недугом [3]. Крупнейшее шотландское исследование [4] с использованием данных 1 424 378 пациентов в возрасте 18 лет и старше показало, что у 17 285 (1,2%) лиц имелась сердечная недостаточность с систолической дисфункцией левого желудочка (ЛЖ). В европейской популяции в возрасте 60 лет и старше 4,9% лиц страдают сердечной недостаточностью с сохраненной фракцией выброса левого желудочка (CНсФВ); на их долю приходится около 50% от всех пациентов с ХСН [5]. Летальность больных ХСН остается достаточно высокой, достигая в течение года от момента постановки диагноза 20% (95% доверительный интервал (ДИ): 19–22), а в течение 5 лет – 53% (95% ДИ: 51–55) [6].
Результаты проспективного наблюдательного регистра The European Society of Cardiology Heart Failure Long-Term Registry (ESC-HF-LT-R) c участием 211 кардиологических центров из 21 европейской страны (количество пациентов – 12 440) свидетельствуют, что 59,5% амбулаторным больным ХСН необходима госпитализация, а общая смертность в течение года достигает 6,4%. Комбинированная конечная точка, включающая смертность или госпитализации в связи с ХСН в течение года, зафиксирована у 14,5% пациентов с ХСН [3].
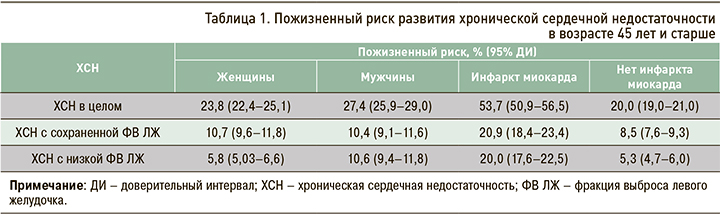
Следует отметить, что пожизненный риск развития ХСН в возрастной группе 45 лет и старше более высок у мужчин (особенно при наличии низкой ФВ ЛЖ), чем у женщин, а также у лиц с перенесенным ранее инфарктом миокарда, чем при его отсутствии, независимо от фенотипа сердечной недостаточности (табл. 1) [7].
В нашей стране встречаемость ХСН увеличилась с 4,9% в 1998 г. до 10,2% в 2014 г. (р=0,01) [8]. Анализ репрезентативной выборки (n=19 276) европейской части России, наблюдаемой на протяжении 2002–2017 гг., показал изменение структуры клинических симптомов и признаков ХСН: увеличение частоты одышки при ходьбе с 9,9 до 11,8% (р <0,001), уменьшение встречаемости периферических отеков c 12,2 до 7,14%, частоты сердечных сокращений (ЧСС) ≥80 уд./мин c 23,9 до 17,8% и слабости c 39,5 до 27,7%. Авторы не исключают того, что изменение клинических особенностей ХСН обусловлено широкой терапией ингибиторами ангиотензинпревращающего фермента (ИАПФ), диуретиками и β-адреноблокаторами (β-АБ) [9].
БЕТА-АДРЕНОБЛОКАТОРЫ ПРИ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Медикаментозная терапия ХСН основана на принципах доказательной медицины, т.е. подразумевает применение тех лекарственных средств, чья эффективность и безопасность доказана в длительных многоцентровых рандомизированных контролируемых исследованиях (РКИ). К препаратам, подтвердившим свою способность к снижению летальности и заболеваемости при ХСН с систолической дисфункцией ЛЖ, относятся и b-АБ [10, 11]. Установлено, что риск летального исхода существенно увеличивается как за счет повторных госпитализаций по поводу декомпенсации ХСН, так и отсутствия в фармакотерапии основных классов лекарственных препаратов, влияющих на прогноз, – блокаторов ренин-ангиотензин-альдостероновой системы (РААС) или β-АБ [12].
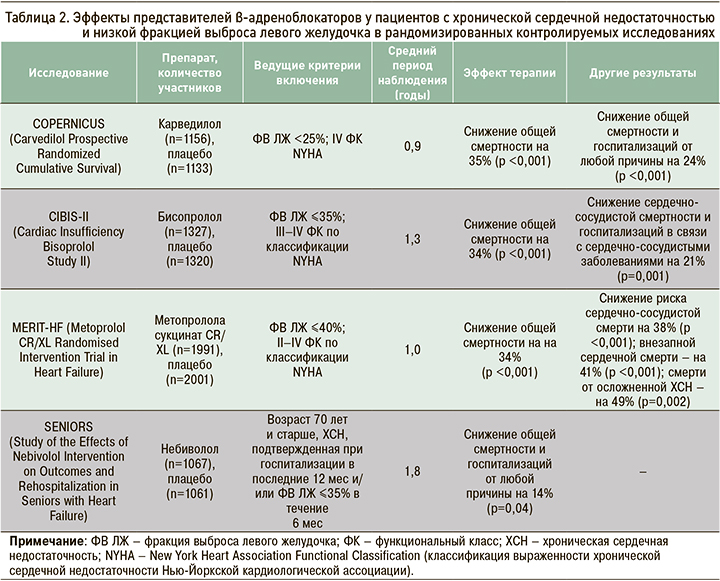
При симптоматически выраженной ХСН с низкой ФВ ЛЖ и стабильном ее течении b-АБ рекомендованы к назначению совместно с ИАПФ для улучшения клинической симптоматики, уменьшения риска госпитализаций в связи с сердечной недостаточностью и улучшения выживаемости: класс рекомендаций I и уровень достоверности доказательности А согласно Европейскому обществу кардиологов (уровень достоверности доказательств (УДД) 2, уровень убедительности рекомендаций (УУР) А) [13]. Препараты этого класса имеют весомые доказательства влияния на снижение заболеваемости и смертности пациентов с ХСН и низкой ФВ ЛЖ (табл. 2) независимо от применения ИАПФ и в большинстве случаев диуретиков. У больных с инфарктом миокарда в анамнезе и лиц с бессимптомной дисфункцией ЛЖ b-АБ также рассматриваются как препараты выбора для снижения риска смерти: класс рекомендаций I и уровень достоверности доказательности В согласно Европейскому обществу кардиологов (УДД 2, УУР А) [13–17].
Hampton J. в 1996 г. обосновал необходимость длительного применения β-АБ у пациентов с ХСН, при которой наблюдается активация симпатоадреналовой системы, оказывающей пагубное воздействие на сердечно-сосудистую систему разными путями [18]. Во-первых, при систолической дисфункции ЛЖ нарушается регуляция β1-адренорецепторов и ослабевает ответ на введение бета-агонистов. Теоретически длительная терапия β-АБ может активировать рецепторный аппарат и восстанавливать надлежащую чувствительность миокарда к бета-стимуляции. Во-вторых, высокий уровень норадреналина плазмы служит маркером тяжелого течения ХСН, а симпатическая активация развивается на этапе, когда еще отсутствуют клинические проявления заболевания. В-третьих, β-АБ улучшают функцию ЛЖ, обладают антиишемическим эффектом и, возможно, улучшают диастолическую функцию ЛЖ. В-четвертых, исследования с участием пациентов, перенесших инфаркт миокарда, свидетельствуют о том, что β-АБ предупреждают развитие жизнеугрожающих нарушений ритма и внезапной смерти, которые достаточно часто регистрируются при ХСН. Наконец, активация РААС при ХСН является неотъемлемой частью симпатического тонуса, и, следовательно, назначение β-АБ может наряду с прочим влиять и на эту нейрогуморальную систему.
Для доказательства этих предположений в отношении благоприятных эффектов β-АБ при лечении ХСН был проведен ряд многоцентровых РКИ, а бисопролол стал первым препаратом этой группы, доказавшим свою высокую эффективность при лечении пациентов с ХСН и низкой ФВ ЛЖ.
БИСОПРОЛОЛ ПРИ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ С НИЗКОЙ ФРАКЦИЕЙ ВЫБРОСА ЛЕВОГО ЖЕЛУДОЧКА
Изучение эффектов бисопролола у пациентов с ХСН и низкой ФВ ЛЖ проводилось в трех крупнейших РКИ – CIBIS, CIBIS II и CIBIS III.
В проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании CIBIS (Cardiac Insufficiency Bisoprolol Study) приняли участие 641 пациент с ХСН III–IV функциональных классов (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA) и ФВ ЛЖ менее 40% [19, 20]. В нем оценивалось влияние бисопролола на смертность пациентов на фоне приема вазодилататоров (в 90% случаев – ИАПФ) и при необходимости сердечных гликозидов и диуретиков. Продолжительность периода наблюдения составила 1,9±0,1 года. По результатам этого РКИ не было получено статистически значимого снижения смертности на фоне применения бисопролола в составе комплексной терапии. Однако наблюдалось снижение смертности на 53% у пациентов с дилатационной кардиомиопатией, на 42% (р=0,05) – у лиц с ЧСС >80 уд/мин и на 47% (р <0,001) – в группе пациентов без инфаркта миокарда. Улучшение ФК было выявлено у 21% пациентов в группе приема бисопролола против 15% в группе плацебо (р=0,04).
В многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование CIBIS II (Cardiac Insufficiency Bisoprolol Study II) вошли 2647 пациентов в возрасте от 18 до 80 лет с симптомами ХСН III–IV ФК и ФВ ЛЖ ≤35%, которые получали стандартную терапию ИАПФ и диуретиками. Пациенты были рандомизированы в группу приема бисопролола в дозе 1,25 мг/сут c последующей титрацией препарата до 10 мг/сут (n=1327) или группу плацебо (n=1320). Период наблюдения составил 1,3 года, поскольку исследование было прекращено преждевременно после проведения второго промежуточного анализа результатов из-за достижения запланированных конечных исходов. В группе бисопролола наблюдалось значимое снижение общей смертности по сравнению с плацебо: 156 (11,8%) против 228 (17,3%) смертей; отношение шансов (ОШ) 0,66; 95% доверительный интервал (ДИ): 0,54–0,81; p <0,0001; это оказалось значительно выше предполагаемого результата (ожидаемое снижение смертности составляло 25%). Полученные результаты свидетельствуют о высокой клинической значимости применения бисопролола, так как верхняя граница ДИ была близка к границе предполагаемой эффективности препарата. Кроме того, в группе бисопролола отмечалось меньшее количество случаев внезапной смерти по сравнению с плацебо: 48 (3,6%) против 83 (6,3%) смертельных исходов; ОШ 0,56; 95% ДИ: 0,39–0,80; p=0,0011. Полученные эффекты не зависели от тяжести и причины ХСН. Анализ ожидаемых вторичных точек показал, что частота госпитализаций пациентов в группе бисопролола (33%) также была значительно ниже, чем в группе плацебо (39%; р=0,0006). Авторы отметили хорошую переносимость этого β-АБ, о чем свидетельствует одинаковое количество вынужденного отказа от дальнейшего приема бисопролола и плацебо (в обоих случаях 15%; p=0,980) [20].
Целью исследования CIBIS III (Cardiac Insufficiency Bisoprolol Study III) была проверка гипотезы, что начальная монотерапия бисопрололом с дальнейшим подключением к нему ИАПФ (эналаприла) столь же эффективна в профилактике комбинированной конечной точки (смертности и госпитализаций по всем причинам), как и начальная монотерапия эналаприлом с дальнейшим подключением бисопролола и последующим сочетанным использованием двух препаратов в течение не менее чем 18 мес. В исследовании приняли участие 1010 пациентов (32% женщин) в возрасте 65 лет и старше (средний возраст 72 года) с ХСН II–III ФК и ФВ ЛЖ ≤35% (исходная средняя ФВ ЛЖ 28,8%) минимум за 3 мес до включения в исследование [21]. Результаты исследования позволили заключить, что начало терапии бисопрололом с последующей титрацией до 10 мг/сут так же эффективно и хорошо переносится, как и начало лечения эналаприлом с титрацией до дозы 10 мг 2 раза/ сут: в случае начала монотерапии бисопрололом общая смертность составила 35,2%, эналаприлом – 36,8%. Это позволяет лечащему врачу выбирать первый лекарственный препарат для профилактики нежелательных клинических исходов.
Интерес вызывают дальнейшие результаты, указывающие на эффективность монотерапии бисопрололом по сравнению с начальной монотерапией эналаприлом в течение первого года лечения. Это привело к снижению риска внезапной смерти на 46% (p <0,05): в группе бисопролола произошло 34,8%, эналаприла – 50% случаев такого исхода (ОШ 0,50; 95% ДИ: 0,21–1,16; p=0,107) [22]. Данный факт примечателен тем, что назначение бисопролола в эффективной дозе сопровождалось не только изменением структуры смертности в виде уменьшения случаев внезапной смерти, но и снижением общей смертности у лиц в возрасте 65 лет и старше с ХСН II–III ФК и низкой ФВ ЛЖ.
Таким образом, данные представленных РКИ, в которых оценивалась эффективность применения бисопролола, демонстрируют важное место этого лекарственного средства в лечении пациентов с ХСН и низкой ФВ ЛЖ, что вполне закономерно. Истинная природа ХСН представляет собой хронологическую прогрессию патологического ремоделирования ЛЖ в результате субклинической или выраженной ишемии на фоне нарушенной активации нейрогуморальных систем, включая симпатоадреналовую и РААС, гемодинамической перегрузки, нарушения внутриклеточного обмена кальция и ускоренного апоптоза кардиомиоцитов, нарушения баланса образования и распада внеклеточного матрикса и разных генетических особенностях [23] Эти изменения проявляются клиническими симптомами и признаками, ухудшением качества жизни и нередко преждевременной инвалидизацией и летальностью. В свою очередь, наличие систолической дисфункции миокарда ЛЖ, кроме высокой симпатической активности, ассоциируется с высоким риском внезапной сердечной смерти и увеличивается с возрастом ввиду более высокой распространенности ишемической болезни сердца (ИБС) среди лиц старшего возраста [24–26].
Именно модулирующим действием [27] на активность симпатической нервной системы и РААС можно объяснить эффект бисопролола в плане снижения числа случаев смерти, в том числе и внезапной, в исследованиях CIBIS, CIBIS II и СIBIS III.
Подводя итоги 15-летнего периода проведения клинических исследований с участием больных ХСН, в 1998 г. Massie B.M. обратил внимание на некорректную интерпретацию результатов исследования CIBIS I, которые обычно рассматривают как негативные. По факту прием бисопролола в этом исследовании ассоциировался со снижением смертности на 20%, но из-за малого количества случаев летального исхода данная разница оказалась статистически незначимой (р=0,22). Последующее исследование CIBIS II выполнялось с участием гораздо большего количества участников и было преждевременно прекращено из-за выраженного благоприятного эффекта бисопролола на выживаемость пациентов с ХСН и систолической дисфункцией ЛЖ [28]. Помимо этого, Massie B.M. подчеркивает, что эффективность (или вред) в клинических исследованиях определяется не только свойствами изучаемого препарата, но и достижением целевой дозы.
В этом аспекте невозможно не отметить важность достижения целевых значений лекарственной дозы, подтверждением которого служат результаты многоцентрового исследования CIBIS-ELD [29] с участием 883 пациентов в возрасте 65 лет и старше с ХСН II–IV ФК и ФВ ЛЖ менее 45%. Сравнительный анализ подтвердил сопоставимую эффективность и безопасность бисопролола и карведилола, хотя целевые дозы двух препаратов не были достигнуты у большинства пациентов. Более значимое уменьшение ЧСС наблюдалось у пациентов в группе бисопролола, и именно достигнутая ЧСС на фоне терапии бисопрололом определяла долгосрочный прогноз пациентов с ХСН [30, 31].
БЕТА-АДРЕНОБЛОКАТОРЫ КАК НЕЙРОГУМОРАЛЬНЫЕ МОДУЛЯТОРЫ ПРИ РАЗНЫХ ФЕНОТИПАХ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
На сегодняшний день неоспорима взаимосвязь эндотелиальной дисфункции с артериальной гипертензией (АГ), ИБС, сахарным диабетом (СД), ожирением, ХСН и другими заболеваниями [32]. Нарушение эндотелийзависимой вазодилатации на фоне снижения биодоступности оксида азота, нарушение чувствительности к вазодилатирующим простагландинам, высвобождаемым эндотелием, служат одними из ведущих механизмов развития и прогрессирования ХСН. Гипоксия тканей на фоне дисфункции сердечно-сосудистой системы приводит к изменению эндотелий-зависимой вазодилатации на фоне снижения биодоступности оксида азота и уменьшению чувствительности к эффектам вазодилатирующих простагландинов. Повышенная продукция свободных радикалов усугубляет развивающуюся микрососудистую дисфункцию, включая эндотелий сосудов, повреждает мембрану клеток и способствуют высвобождению провоспалительных цитокинов, оказывающих негативное влияние на сердечно-сосудистую систему. Это проявляется формированием апоптоза, фиброза тканей с дальнейшим развитием ремоделирования миокарда ЛЖ и ухудшением прогноза [33].
Механизмы, с помощью которых b-АБ оказывают положительное действие при сердечной недостаточности, до конца не изучены. Блокада адренергических рецепторов оказывает прямое влияние на кардиомиоциты, снижает ЧСС, сосудистый тонус и нейрогуморальный ответ [34, 35].
Таким образом, у больных ХСН с синусовым ритмом и ФВ ЛЖ <40% b-АБ, в частности бисопролол, улучшают систолическую функцию ЛЖ и снижают кардиоваскулярную заболеваемость и смертность. К тому же низкая ЧСС ассоциирована с улучшением выживаемости при ХСН с низкой ФВ ЛЖ, а большинство благоприятных исходов наблюдалось именно у пациентов с ЧСС около 60 уд./мин [36].
Эти преимущества b-АБ возможно также экстраполировать на пациентов с ХСН и ФВ ЛЖ 40–49%, которым терапия этими препаратами, по-видимому, скорее поможет, чем навредит [37]. Группа пациентов с ХСН и промежуточной ФВ ЛЖ практически не изучена, так как большинство исследований, посвященных ХСН, включали пациентов с сохраненной или низкой ФВ ЛЖ. Промежуточная ФВ ЛЖ нередко становится результатом снижения нормальной или восстановления низкой, в связи с чем при выборе тактики ведения следует учитывать величину ФВ ЛЖ, этиологию, сопутствующую патологию, особенности клинической картины и прогноз.
Патофизиологические механизмы ХСН с сохраненной ФВ ЛЖ до конца не определены, вследствие чего лечение этого фенотипа окончательно не разработано. Это обусловлено отсутствием достаточного количества проспективных РКИ у данной категории пациентов. С современной точки зрения ХСН-с-ФВЛЖ представляет собой комплексное заболевание, характеризующееся хроническим системным неинфекционным воспалением, дисфункцией эндотелия сосудов и нарушением водно-солевого обмена [38, 39]. Обязательным условием при ведении таких пациентов должно быть выявление и коррекция всех факторов риска и заболеваний, способствующих развитию диастолических расстройств: АГ, гипертрофии ЛЖ, ИБС, СД, ожирения и др. [40].
Если говорить о роли b-АБ в лечении пациентов с ХСН и ФВ ЛЖ ≥50%, то пользы от их назначения выявлено не было. К сожалению, в соответствующих РКИ принимало участие слишком малое количество пациентов, чтобы сделать надежные выводы об эффективности или безопасности b-АБ при этом фенотипе ХСН.
Вероятно, b-АБ можно рассматривать в качестве нейрогуморальных модуляторов при ХСН-с-ФВЛЖ за счет их прицельного воздействия на катехоламины, диастолическую функцию, атриовентрикулярную проводимость, ЧСС, эктопическую активность миокарда. Все это может снижать риск развития нарушений ритма, вероятность которых возрастает при диастолической дисфункции ЛЖ. С учетом того что оптимальная частота сокращения желудочков у пациентов с ХСН-с-ФВЛЖ не установлена, агрессивный контроль и снижение ЧСС могут оказать неблагоприятное воздействие.
Метаанализ 17 исследований с участием 27 099 пациентов с ХСН-с-ФВЛЖ показал, что в случае терапии b-АБ наблюдалось снижение общей смертности на 19%, но только по данным наблюдательных исследований (ОШ 0,81; р <0,001). Этот факт был существенным ограничением данного анализа [41].
В исследовании Zhang C. et al. изучались кардиопротекторные эффекты бисопролола как результата модуляции развернутого белкового ответа (РБО) и противовоспалительного действия во время ишемического/реперфузионного повреждения миокарда. Было обнаружено, что бисопролол улучшает состояние миокарда на этом фоне за счет уменьшения пути передачи сигнала РБО, играющего критическую роль в данном процессе. РБО ослабляет апоптоз, вызванный ишемией, за счет уменьшения окислительного повреждения и воспалительного ответа. Проведенное исследование поможет понять фармакологическое действие бисопролола в лечении ИБС как одной из ведущих причин развития ХСН и способствовать развитию понимания механизма ишемического повреждения миокарда [42].
Ранее Schiattarella G. et al. описали механизм развития диастолической дисфункции ЛЖ, в основе которого лежит снижение развернутого белкового ответа, приводящего к накоплению дестабилизированных миофиламентных белков в миокарде [43].
ВОЗМОЖНОСТИ НАЗНАЧЕНИЯ БИСОПРОЛОЛА ПРИ МУЛЬТИМОРБИДНОСТИ
Выбор конкретного препарата обычно основан на уровне доказанности в РКИ его метаболической нейтральности и органопротективного действия. Бисопролол представляет собой кардиоселективный b-АБ, степень селективности которого (соотношение влияния на β1- и β2-адренорецепторы) составляет 1:75. Он не обладает мембраностабилизирующим эффектом, имеет высокую биодоступность и практически полностью абсорбируется в желудочно-кишечном тракте (90%). Связывание бисопролола с белками плазмы достаточно низкое (30%) с соотношением 1:1 между метаболизмом в печени и почечной экскрецией.
Ряд клинически значимых качеств отличают бисопролол от других b-АБ: это отсутствие внутренней симпатомиметической активности и блокады β3-адренорецепторов, а также амфифильность. Сбалансированный клиренс за счет двойного пути элиминации (частичный печеночный метаболизм и почечная экскреция в неизменном виде) имеет важное значение при лечении мультиморбидных пациентов. К тому же длительный период полувыведения, составляющий 10–11 ч, пик действия через 2–4 ч после приема и продолжительность эффекта до 24 ч позволяют рекомендовать этот препарат к приему 1 раз/сут, что способствует повышению приверженности пациентов к лечению [44].
Бисопролол имеет благоприятный профиль переносимости. Снижение функции печени и почек практически не влияет на его концентрацию в крови, но при терминальной стадии хронической болезни почек необходима коррекция дозы.
Пациенты с высоким и очень высоким сердечно-сосудистым риском, к которым относятся больные ХСН, как правило, имеют комплексную сопутствующую патологию и принимают b-АБ в составе комбинированной терапии. Принимая во внимание значимую роль повышенной симпатической активности в повреждении органов-мишеней, снижение симпатикотонии позволит повлиять на обратное ремоделирование поврежденных органов.
Механизм действия b-АБ заключается в блокаде b-адренорецепторов, расположенных в разных органах (миокарде и жировой ткани сердца, сосудах, почках, бронхах, поджелудочной железе и др.), что препятствует воздействию катехоламинов на рецепторы. Подавляя активность аденилатциклазы клеточной мембраны за счет связывания с G-белками, b-АБ тормозят синтез цАМФ – внутриклеточного трансмиттера действия катехоламинов. Препараты этого класса замедляют спонтанную диастолическую деполяризацию и атриовентрикулярную проводимость, уменьшают ЧСС и потребность миокарда в кислороде, что приводит к улучшению кровоснабжения миокарда. Дополнительно b-АБ замедляют частоту синусовой импульсации и эктопическую активность сердца, уменьшая риск развития аритмий. Кроме того, блокируя b-адренорецепторы в юкстагломерулярном аппарате почек, b-АБ снижают секрецию ренина и активность РААС [45–47].
Одна из проблем при выборе b-АБ – появление или усиление бронхообструкции, поскольку при их применении происходит блокада не только β1-адренорецепторов, обеспечивающих антиангинальный и антигипертензивный эффект, но и β2-адренорецепторов, приводящих к спазму средних и мелких бронхов, ухудшению вентиляции легких и гипоксемии, что клинически манифестирует нарастанием одышки. Поэтому степень кардиоселективности b-АБ имеет решающее значение при выборе конкретного препарата в случае бронхолегочной патологии [48].
Систематический метаанализ, объединивший 49 исследований с участием 670 594 пациентов, подтвердил не только безопасность приема кардиоселективных по сравнению с неселективными b-АБ (ацебуталол, атенолол, бетаксолол, бисопролол, карведилол, лабетолол, метопролол, надолол, небиволол, пенбутолол, пиндолол, пропранолол, соталол, эсмолол, левобунолол, окспренолол) у пациентов с хронической обструктивной болезнью легких (ХОБЛ) и сердечно-сосудистыми заболеваниями, но и их вклад в снижение общей смертности (ОШ 0,70; 95% ДИ: 0,59–0,83; p <0,0001) и внутригоспитальной смертности (ОШ 0,67; 95% ДИ: 0,46–0,99; p=0,04) [49].
Высокая кардиоселективность бисопролола позволяет минимизировать вероятность появления побочных эффектов, обусловленных воздействием на β2-адренорецепторы, и использовать этот препарат у лиц с ХОБЛ [50].
Бронхиальная астма является общепринятым противопоказанием для назначения b-АБ, однако недавний сетевой метаанализ 24 РКИ показал, что при приеме пероральной формы бисопролода вероятность возникновения обострения астмы минимальная (ОШ 0,46; 95% ДИ: 0,02–11,65) [51]. В перспективе крайне необходимы дополнительные исследования по оценке эффективности и влияния на прогноз b-АБ у пациентов с бронхолегочными и сердечно-сосудистыми заболеваниями [52].
Длительное время назначение b-АБ было противопоказано пациентам с СД из-за негативного влияния неселективных препаратов этой группы на углеводный и липидный обмен, приводящего к атерогенности и усугублению течения диабета и сопутствующих сердечно-сосудистых заболеваний. Однако на сегодняшний день применение b-АБ при СД и ХСН признано важнейшим компонентом лечения таких пациентов. Это обусловлено коррекцией высокого тонуса симпатической нервной системы, возникающего на фоне гиперинсулинемии, а также нарушения эндотелийзависимой вазодилатации, выступающего одним из механизмов развития инсулинорезистентности. В связи с этим предпочтение отдается b-АБ, которые не ухудшают толерантности к глюкозе и улучшают чувствительность периферических тканей к инсулину. Высокая селективность бисопролола, являющаяся эталонной среди высокоселективных b-АБ, объясняет отсутствие ухудшения состояния липидного и углеводного обмена при его применении [53, 54].
В дозе до 10 мг/сут бисопролол метаболически нейтрален, не вызывает гипогликемии, увеличения уровня липопротеинов низкой плотности и триглицеридов сыворотки крови [44, 55]. Практикующему врачу важно помнить, что при увеличении дозы соотношение заблокированных β1- и β2-адренорецепторов уменьшается, что может привести к снижению активности β2-адренорецепторов бронхов, сосудов и др. В терапевтической дозе от 2,5 до 10,0 мг бисопролол практически не оказывает влияния на эндогенные катехоламины, действующие на β2-адренорецепторы, а также на тонус мускулатуры бронхов, кровоток и гликолитические процессы в скелетных мышцах, вследствие чего на фоне его приема не наблюдается снижения толерантности к физическим нагрузкам.
В свете вышесказанного интересны данные анализа назначения b-АБ пациентам с кардиоваскулярными заболеваниями в регистрах ПРОФИЛЬ (n=1531) и РЕКВАЗА (n=3690), из которых подтвержденный диагноз СД имели 14,4 и 18,9% соответственно. Результаты показали, что врачи специализированного кардиологического отделения в сравнении с врачами районных поликлиник чаще рекомендовали таким пациентам прием b-АБ, и в первую очередь бисопролола (61,8% случаев в регистре ПРОФИЛЬ и 75,4% – в регистре РЕКВАЗА). Причем такие назначения делались в первую очередь с целью благоприятного влияния на прогноз заболевания [56].
Начинать лечение бисопрололом следует с минимальной дозы, в последующем постепенно повышая дозировку до целевой терапевтической (табл. 3). При хорошей переносимости доза бисопролола удваивается не чаще чем 1 раз в 2 нед. Улучшение клинического состояния ожидаемо через 2–3 мес после начала терапии. При подборе дозы b-АБ возможно появление преходящих гипотонии, брадикардии и(или) ухудшения сердечной недостаточности, поэтому необходимо их своевременное выявление и устранение. Критериями прекращения увеличения суточной дозы считаются снижение систолического артериального давления менее 85 мм рт.ст., урежение ЧСС менее 50 уд/мин, усиление симптомов сердечной недостаточности.

При развитии гипотонии и брадикардии следует уменьшить дозу препарата или полностью отменить. В случае нарастания явлений сердечной недостаточности в первую очередь необходимо повысить дозу диуретиков и ИАПФ. При неэффективности этой меры доза бисопролола должна быть временно снижена. По достижении стабильного состояния пациента необходимо вновь возобновить лечение и/или продолжить титрование дозы препарата.
Дозы и кратность приема b-АБ подбирают индивидуально, c постепенной ее титрацией, ориентируясь на самочувствие пациента и показатели гемодинамики. Целевой уровень достижения ЧСС – 55–60 уд./мин, уровень систолического артериального давления в начале лечения не следует снижать более чем на 15–20% от исходного. Также в процессе терапии b-АБ необходимо контролировать функцию почек.
ЗАКЛЮЧЕНИЕ
Особенности метаболизма бисопролола определяют его клинические преимущества: удобство приема (однократно в сутки), повышающее приверженность к лечению, отсутствие необходимости коррекции дозы при патологии печени и почек, возможность назначения лицам старшего возраста и при совместном использовании с другими лекарственными средствами. Особого внимания требуют мультиморбидные пациенты с ХСН, у которых имеются сопутствующие ХОБЛ, ожирение, СД и хроническая болезнь почек. Этой категории пациентов необходима основанная на доказательствах комплексная терапия, позволяющая предупредить прогрессирование осложнений, в которой кардиоселективным b-АБ, в частности бисопрололу, отводится одна из приоритетных позиций. Результаты крупных международных РКИ, в которых оценивалось влияние бисопролола на прогноз, определили место этого лекарственного препарата в лечении пациентов с ХСН и низкой ФВ ЛЖ. Персонализированный подход к пациенту с ХСН в зависимости от возраста, клинического статуса, функции почек, а также тщательное титрование дозы с учетом гемодинамического профиля (уровня артериального давления, ЧСС, признаков застоя) и рекомендаций доказательной медицины по благоприятному влиянию препаратов на прогноз позволяет достигнуть лучших результатов при лечении.



