ВВЕДЕНИЕ
В условиях пандемии COVID-19 нельзя обойти стороной остро возникшую проблему поражения кишечника у пациентов, инфицированных SARS- CoV-2, особенно часто возникающего на фоне массивного и порой бесконтрольного применения антибактериальной терапии. Клинические наблюдения показывают, что данное поражение может проявляться в самых разных вариантах, начиная с легкой степени диареи и вплоть до развития весьма грозного проявления – псевдомембранозного колита, который приводит к развитию синдрома системной воспалительной реакции, выраженной эндогенной интоксикации и нередко к фатальному исходу.
Согласно актуальным данным статистики, непосредственно само течение COVID-19 сопровождается вовлечением в процесс желудочно-кишечного тракта (ЖКТ) с развитием диареи, тошноты, рвоты, боли в животе в 2–49% случаев [1–4]. Изучение патогенеза этой инфекции позволяет предположить несколько механизмов развития поражения ЖКТ.
Установлено, что SARS-CoV-2 инфицирует клетки путем связывания с рецептором ангиотензинпревращающего фермента 2 (AПФ2) [5], который в больших количествах содержится в эпителии тонкой кишки, толстом кишечнике, желудке. В меньшей концентрации его обнаруживают в печени, желчных протоках, пищеводе. Внутриклеточная репликация вируса и его дальнейшее выделение из клетки вызывают развитие местного воспаления и гибели эпителия, что, в свою очередь, обусловливает нарушение кишечного барьера и формирование так называемого дырявого кишечника.
Кроме того, вирус SARS-CoV-2 не только использует эктоэнзим плазматической мембраны АПФ2 для проникновения в клетки, но и в дальнейшем модулирует его активность, снижая экспрессию АПФ2 в тканях, что ведет к формированию целой цепочки негативных эффектов [6]. Во-первых, дефицит АПФ2 способствует ослаблению протективных свойств ангиотензина 1-7, которые заключаются в противовоспалительном, антитромботическом и антифибротическом действии; это, в свою очередь, вызывает увеличение проницаемости стенки кишечника и усиление местного воспалительного процесса. Во-вторых, недостаток АПФ2 влечет за собой нарушение транспорта триптофана через стенку тонкого кишечника, который регулирует секрецию антимикробных пептидов, влияющих на состав кишечного микробиома. Возникающий вследствие этого недостаток триптофана приводит к развитию дисбактериоза и, как следствие, воспалению стенки кишечника [6].
Весомый вклад в развитие желудочно-кишечной симптоматики вносит изменение состава и функции кишечной микрофлоры на фоне гипоксии, связанной с поражением дыхательной системы SARS-CoV-2. И, наконец, вовлечение в процесс оси «кишечник – головной мозг», обусловленное либо непосредственным поражением вирусом нервной системы кишечника, либо компонентами иммунного ответа, ведет к изменению моторики и болевого восприятия кишечника, нарушению эпителиального барьера, увеличению проницаемости кишечной стенки и изменению кишечной микробиоты [7–9].
На фоне такого многокомпонентного воздействия вирусной инфекции на ЖКТ применение антибактериальных препаратов у пациентов с респираторными проявлениями COVID-19 становится еще одним фактором, провоцирующим каскад патологических процессов в пищеварительной системе. В зависимости от групповой принадлежности антибактериального препарата этот каскад опосредован такими разнообразными механизмами воздействия, как усиление моторики кишечника за счет стимуляции мотилиновых рецепторов, повышение внутрикишечного осмотического давления вследствие нарушения метаболизма углеводов и неполного всасывания антибиотика, усиление секреции в толстой кишке из-за нарушения деконьюгации желчных кислот. Имеет место и непосредственное токсическое действие антибактериальных препаратов на слизистую оболочку ЖКТ, характерное для пенициллинов и препаратов тетрациклинового ряда. И, конечно, немаловажное значение в развитии нарушений со стороны ЖКТ имеет изменение состава и количества нормальной кишечной микробиоты [10], определяющее снижение выработки короткоцепочечных жирных кислот, которые играют ключевую роль в поддержании гомеостаза кишечника, целостности кишечной стенки и контроле кишечных патогенов. В результате рост патогенной флоры влечет за собой продукцию токсинов, вызывающих повреждение слизистой оболочки и нарушение кишечного эпителиального барьера [11]. Данный процесс индуцирует образование провоспалительных цитокинов, ведущих к апоптозу и некрозу эпителиоцитов. Это увеличивает проницаемость кишечной стенки, способствуя развитию диареи вплоть до тяжелых форм псевдомембранозного колита, и, замыкая порочный круг, вызывает вирусную и бактериальную транслокацию, которая, в свою очередь, поддерживает системное воспаление.
С учетом резкого учащения случаев развития псевдомембранозного колита в Республике Мордовия (РМ) возникла необходимость проанализировать причины сложившейся ситуации. Для этого был создан регистр пациентов с псевдомембранозным колитом, развившимся в период пандемии COVID-19, на территории региона.
Цель исследования – провести ретроспективный анализ и выявить особенности течения псевдомембранозного колита у пациентов, инфицированных SARS-CoV-2.
МАТЕРИАЛ И МЕТОДЫ
Анализ был выполнен на основании данных анкет пациентов с COVID-19, осложненным псевдомембранозным колитом, которые были госпитализированы на территории РМ за период с июня 2020 по май 2021 г. Анкеты включали информацию о течении и проведенном лечении COVID- 19, сопутствующей патологии пациента. Наряду с этим в них были зафиксированы клинические симптомы псевдомембранозного колита и сроки их развития, представлены результаты колоноскопии, исследования кала на токсины А и В Clostridium Difficile методом иммуноферментного анализа, а также исследования кала на возбудителей кишечных инфекций.
Полученные данные обрабатывались с помощью программы Microsoft Excel 2021.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам статистического исследования среди пациентов, госпитализированных с COVID- 19, псевдомембранозный колит был выявлен у 396 человек, при этом в структуре пациентов женщины количественно преобладали над мужчинами (259 против 137).
В основном пациенты госпитализировались с респираторными осложнениями новой коронавирусной инфекции, в частности с пневмонией средней и тяжелой степени. Наряду с респираторными проявлениями COVID-19 симптомы кишечной диспепсии при поступлении в стационар наблюдались у 31% пациентов, в остальных случаях клиника поражения кишечника развернулась в условиях стационара. Развитие симптомов кишечной диспепсии у 24% пациентов имело место в первые 5–10 дней от начала COVID-19. У большинства больных (69%) дебют кишечной симптоматики отмечался на 10–20-й день от начала заболевания, при этом были и пациенты (7%), у которых кишечные проявления развивались спустя месяц и более от начала вирусной инфекции.
Среди обследуемых чаще всего подвергались госпитализации больные в возрасте 60–69 лет (36%). С увеличением возраста число госпитализированных пациентов постепенно снижалось, однако такая динамика, скорее, следствие средней продолжительности жизни по РМ, которая, согласно данным Росстата на 2020 г., составила 71,6 лет. Что касается пациентов моложе 60 лет, то среди них частота госпитализаций снижалась пропорционально уменьшению возраста и была минимальной в группе лиц моложе 30 лет (рис.).
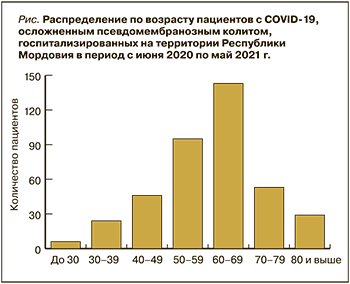
В клинической картине псевдомембранозного колита наблюдались характерные симптомы в виде многократного жидкого стула, в тяжелых случаях до 20 раз/сут, боли в животе спастического характера по ходу кишечника. При тяжелом течении отмечались лихорадка, симптомы интоксикации и водно-электролитных расстройств. В 78,5% имели место рецидивы кишечной симптоматики, требующие подчас неоднократной госпитализации пациента.
По данным колоноскопии чаще всего выявлялось тотальное поражение толстой кишки с преимущественной локализацией процесса в нисходящей ободочной кишке. Макроскопическая картина характеризовалась отеком и гиперемией слизистой оболочки, возвышающимися желтыми или серо-желтыми бляшками, которые имели тенденцию к слиянию с формированием обширных полей. При гистологическом исследовании слизистой оболочки во всех случаях наблюдались отек, нарушение кровообращения в подслизистой основе в виде расширения и полнокровия сосудов, иногда с тромбозами и кровоизлияниями. Псевдомембраны состояли из слизи, фибрина, нейтрофилов и эритроцитов в различных пропорциях. В области бляшек имелась гиперсекреция слизи.
Наличие в кале токсина А и В C. difficile определялось лишь в 9,1%случаев, что свидетельствует о полиэтиологическом генезе псевдомембранозного колита на фоне COVID-19. Результаты исследования кала на сальмонеллез и шигеллезы были отрицательными во всех случаях, у части больных (3%) с неклостридиальным псевдомембранозным колитом обнаруживалась Klebsiella oxytocica.
В 81% случаев развитию кишечной симптоматики предшествовала антибактериальная терапия. Более половины пациентов получали антибактериальные препараты на догоспитальном этапе. Среди наиболее часто назначаемых в амбулаторных условиях антибиотиков были азитромицин (47%), амоксициллин (24%), комбинация азитромицин + цефтриаксон (8%), левофлоксацин (7%). В остальных случаях использовались цефтриаксон, цефиксим в рамках монотерапии, также имело место последовательное курсовое назначение цефтриаксона и левофлоксацина, азитромицина и левофлоксацина. В условиях стационара чаще всего применялся левофлоксацин (24%) – как правило, у тех пациентов, которым амбулаторно первым курсом антибактериальной терапии назначались азитромицин или амоксициллин. Азитромицин в период госпитализации использовался в 22%, цефтриаксон – в 16%. Ввиду того что все госпитализированные пациенты имели среднюю и тяжелую степень поражения легочной ткани, у них чаще, чем на догоспитальном этапе (в 38%), применялись различные комбинации антибиотиков, состоящие из цефтриаксона, левофлоксацина, азитромицина, меропенема, амоксициллина + клавулановой кислоты.
Поскольку в схемах лечения респираторных поражений, вызванных инфицированием вирусом SARS-CoV-2, назначались глюкокортикостероиды, весьма распространенным у госпитализированных пациентов оказалось применение ингибиторов протонной помпы: по результатам нашего исследования, препараты этой группы назначались в 67%. Не исключено, что назначение ингибиторов протонной помпы также могло привести к утяжелению кишечной симптоматики, так как, согласно проведенным многочисленным зарубежным исследованиям [12, 13], прием антисекреторных препаратов у пациентов с COVID-19 вызывает или усугубляет избыточный бактериальный рост в кишечнике. В условиях уже имеющейся нарушенной кишечной проницаемости это приводит к проникновению бактериальной и вирусной инфекции в кровеносное русло и усугублению симптомов кишечной диспепсии вплоть до развития тяжелых форм псевдомембранозного колита, а также способствует развитию неблагоприятных исходов, в том числе вторичной пневмонии [14].
К сожалению, весьма высокой оказалась летальность среди больных псевдомембранозным колитом, развившимся на фоне SARS-CoV-2: ее показатель, подтвержденный патологоанатомическим заключением, составил 25,5% (101 человек). Нужно отметить, что у 17% умерших пациентов псевдомембранозный колит выступал в качестве конкурирующей патологии с коронавирусной инфекцией, осложненной тяжелой формой пневмонии. Больше всего летальных исходов было зафиксировано в возрастной группе 60–69 лет (45,5%), что объяснимо и большей частотой госпитализации в этой категории пациентов. Однако, анализируя летальность отдельно в каждой возрастной группе, было выявлено, что соотношение количества летальных исходов с числом госпитализированных пациентов возрастало с увеличением возраста больного и достигало максимума среди пациентов старше 80 лет – 51,7% (табл.).

Такая тенденция может быть объяснима увеличением с возрастом числа сердечно-сосудистых заболеваний и метаболических нарушений, для которых изначально характерна разбалансированная работа ренин-ангиотензин-альдостероновой системы (РААС). В условиях же воздействия SARS-CoV-2 формируется еще более выраженный дефицит АПФ2, что приводит к нарушению соотношения ангиотензина 2 и ангиотензина 1-7 в пользу первого с последующим развитием вазоконстриктивного, прооксидантного, провоспалительного и профибротического эффектов.
Кроме того, растет количество убедительных доказательств того, что пациентам с метаболическими нарушениями и патологией сердечно-сосудистой системы изначально присущ дисбиоз кишечной микрофлоры, который проявляется снижением разнообразия, устойчивости микробиоты, нарушенным соотношением Firmicutes и Bacterioidetes (маркер дисбактериоза) и снижением уровня пробиотических бактерий (Lactobacillus и Bifidobacterium) [15, 16].
В итоге состояние дисбиоза и дефицит АПФ2 (последний, наряду с прочим, обеспечивает синтез противомикробных пептидов, дефицит которых усугубляет дисбаланс микробиоты) приводят к нарушению целостности кишечного барьера, что способствует попаданию фрагментов бактерий, а именно липополисахарида и пептидогликана, из просвета кишечника в кровоток. Возникшая в результате этого эндотоксемиия способствует системному воспалению. Учитывая же, что пожилые пациенты часто уже имеют скрытое «воспалительное» состояние и адаптивные изменения в иммунной системе как следствие старения (иммуносенесценции), все это может дополнительно поддерживать несбалансированный иммунный ответ и чрезмерно реактивный воспалительный фенотип, как в случае инфекции, вызванной SARS-CoV-2 [15].
Подтверждением факта влияния коморбидной патологии на исход псевдомембранозного колита стали и данные нашего исследования, которое показало, что за исключением 4 случаев пациентов среднего возраста, не имевших в анамнезе сопутствующей патологии, все остальные умершие больные страдали сердечно-сосудистыми заболеваниями, метаболическими нарушениями и их сочетаниями. Так, в структуре коморбидной патологии у умерших больных гипертоническая болезнь была зафиксирована в 47%, различные варианты ИБС – в 43%, сахарный диабет – в 28% случаев. Ожирение (как фактор риска развития неблагоприятного исхода) отмечалось у 19% обследуемых пациентов.
Причиной летальных исходов у пациентов с псевдомембранозным колитом в большинстве случаев служило развитие синдрома полиорганной недостаточности. Появление этого синдрома, по всей видимости, обусловлено инфекционно-токсическим поражением органов на фоне генерализации бактериально-вирусной инфекции, в том числе за счет повреждения и повышения проницаемости кишечной стенки. Это, в свою очередь, приводило к системному воспалению и запуску каскада реакций, вызывающих необратимое клеточное повреждение. Отягощающим фактором выступало развитие на фоне псевдомембранозного колита тяжелой диареи, влекущей за собой гипопротеинемию и водно-электролитные нарушения, которые усугубляют микроциркуляторные расстройства.
Такие классические осложнения псевдомембранозного колита, как токсический мегаколон, перфорация, перитонит, а также кишечная непроходимость, в качестве непосредственной причины смерти были зарегистрированы лишь в 4 случаях. Следует отметить, что тяжелое течение вирусной пневмонии у умерших больных наблюдалось только в 17%, что свидетельствует о ведущей роли поражения кишечника в развитии синдрома полиорганной недостаточности у пациентов с псевдомембранозным колитом на фоне инфицирования вирусом SARS-CoV-2.
ЗАКЛЮЧЕНИЕ
Установлено, что среди пациентов с COVID- 19 псевдомембранозный колит чаще развивался у женщин. Наиболее подверженной поражению кишечника оказалась возрастная категория от 60 до 69 лет. Появление симптомов кишечной диспепсии в большинстве случаев (67%) наблюдалось на 10–20-й день от начала COVID-19. Клиническая и эндоскопическая картина псевдомембранозного колита на фоне SARS-CoV-2 не имела высокоспецифичных признаков течения, однако в 78,5% случаев характеризовалась неоднократными рецидивами. В 81% случаев псевдомембранозный колит развивался на фоне применения антибактериальной терапии, в 67% его развитие сочеталось с назначением ингибиторов протонной помпы. Летальность от псевдомембранозного колита на фоне инфицирования вирусом SARS-CoV-2 была весьма высокой (25,5%) и нарастала с увеличением возраста пациента, достигая максимума (51,7%) в группе больных старше 80 лет. В большинстве случаев причиной летального исхода пациентов с псевдомембранозным колитом, инфицированных SARS-CoV-2, служило развитие полиорганной недостаточности, возникновению которой способствовало наличие сочетанной патологии сердечно-сосудистой системы, сахарного диабета и метаболического синдрома.


