ВВЕДЕНИЕ
В начале пандемии новой коронавирусной инфекции COVID-19 у практикующих специалистов существовали серьезные опасения насчет ее негативного воздействия на пациентов с бронхиальной астмой (БА) и другими хроническими легочными заболеваниями (например, хронической обструктивной болезнью легких, бронхоэктатической болезнью) [1]. Предполагалось, что COVID- 19 может оказаться как спусковым механизмом внезапной дисфункции (астматическая атака) и триггером тяжелых обострений, так и прогностическим фактором тяжести заболевания и преждевременной смерти больного с БА [2].
Однако с накоплением знаний в ходе проведения рандомизированных клинических исследований (РКИ) у пациентов с БА было установлено обратное: сокращение количества астматических атак (приступов удушья) на амбулаторном и стационарном этапах лечения, в отделениях реанимации и интенсивной терапии (ОРИТ) [3–6], что связано, скорее, с социальным дистанцированием, повсеместным ношением медицинских масок, меньшим загрязнением воздуха и повышенным самоконтролем [7, 8], чем с медицинским обслуживанием, направленным на прекращение пандемии [5]. С другой стороны, знания о том, что контролируемая БА снижает риски тяжелых обострений [9] и уменьшает пагубные последствия COVID-19 [10], извратили у практикующих специалистов клинические представления о приступе БА, обострении БА, коронавирусной инфекции, сделав в их глазах дифференциальную диагностику этих состояний ненужной и плохо понимаемой [11]. Целью настоящего обзора является клинический анализ подходов к медикаментозной терапии и применения небулизированного будесонида при БА с учетом реальных амбулаторных лечебных возможностей и действующих актуальных рекомендаций [12, 13].
БРОНХИАЛЬНАЯ АСТМА: АСТМАТИЧЕСКАЯ АТАКА И ОБОСТРЕНИЕ
Астматическая атака, или приступ БА, – это острый эпизод респираторной дисфункции в виде удушья, изменяющий функциональную проходимость воздуха по дыхательным путям (ДП). Она купируется применением устраняющих удушье бронходилататоров и, возможно, изменяет базисную (контролирующую) терапию БА [14, 15]. Любопытно, что коллегия экспертов журнала Lancet (2018) рекомендовала врачам использовать именно термин «астматическая атака» (вместо «приступ», «удушье», «ухудшение»), тем самым подчеркивая клиническую важность события и его последствий, способных триггерировать фатальную астму (астматический статус) и даже смерть пациента. Более того, термин «астматическая атака» любим пациентами, поскольку наиболее точно описывает их состояние и хорошо понимается их друзьями и семьей [16]. Именно поэтому в этой статье мы будем использовать термин «астматическая(-ие) атака(-и)» (АСАТ) вместо «приступы удушья» или их аналогов.
АСАT являются как серьезным бременем болезни для пациента, так и тяжелым финансовым грузом для здравоохранения [14, 15]. Они могут возникать как у пациентов c уже развившейся БА, так и у нативных (первичных) пациентов, отражая в последнем случае начало болезни. Повторяемость АСАТ у пациента свидетельствует о тяжести астмы и служит значимым предиктором будущих обострений и неконтролируемого течения заболевания [17]. Частота тяжелых АСАТ, требующих терапии оральными кортикостероидами (ОКС) с госпитализацией в ОРИТ, в эпидемиологических РКИ составляла 0,1–0,2 на 1 пациента/год. Важно знать, что АСАТ редко требуют госпитализации или не приводят к летальному исходу (≤1,2%), хотя удлинение интервала удушья может спровоцировать фатальную астму (статус астматикус) и смерть пациента [18].
Обострение БА – фаза болезни с длительно существующими респираторными симптомами в виде одышки, кашля, свистящих хрипов, заложенности в груди, которые существуют ≥3 дней, несмотря на увеличение объема медикаментозной терапии (в первую очередь кортикостероидной), с потенциальной необходимостью госпитализации пациента в стационар и/или ОРИТ при развитии у него дыхательной недостаточности (рис. 1) [15, 19].
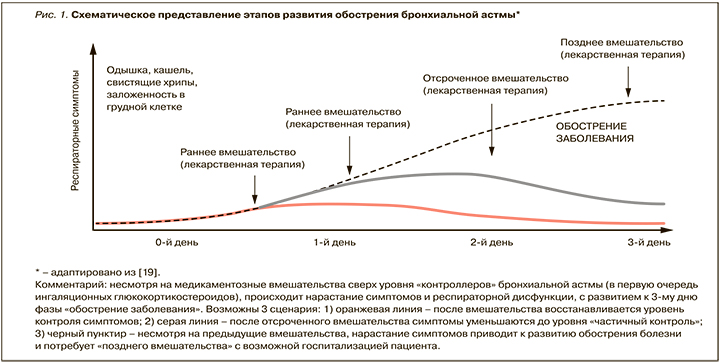
Основными триггерами обострений БА считаются [15]:
- инфекции респираторного тракта (чаще всего вызванные риновирусами);
- аллергены и аэрополлютанты;
- физическая нагрузка;
- метеорологические факторы (сырость и влажность);
- прием ряда лекарственных средств (бета-блокаторов, нестероидных противовоспалительных препаратов).
К основным факторам риска развития обострений БА относят [15]:
- неконтролируемую БА, чрезмерное использование короткодействующих β2-агонистов (КДБА);
- отсутствие терапии ингаляционными глюкокортикостероидами (ИГКС) или плохая приверженность к терапии;
- низкий объем форсированного выдоха за 1-ю секунду (ОФВ1), особенно ОФВ1 ≤60% от должных значений;
- наличие ≥1 тяжелого обострения БА за последние 12 мес;
- внешние воздействия – табакокурение, действие аллергена;
- коморбидность: риносинусит (РС), гастроэзофагеальная рефлюксная болезнь (ГЭРБ), пищевая аллергия, ожирение, эозинофилия крови (EO# ≥300 кл/мкл), беременность.
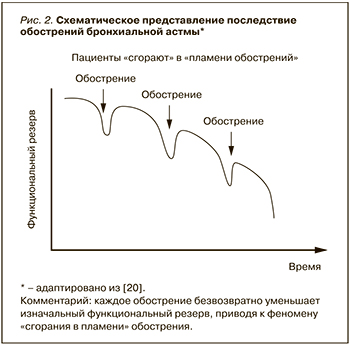
Важно, что, в отличие от АСАТ, обострения БА существенно уменьшают функциональный резерв; это, в свою очередь, сокращает продолжительность жизни и выживаемость пациентов (рис. 2) [15, 20].
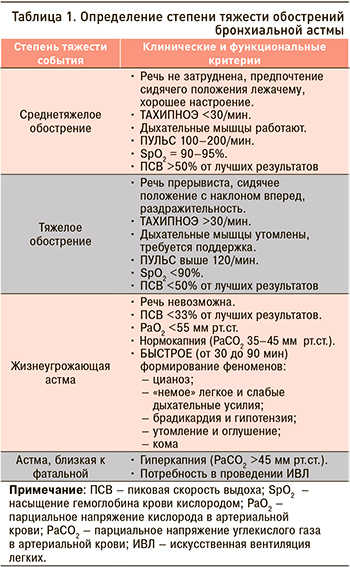
Никакое из обострений БА не может быть легким. Любое из них имеет четкие критерии тяжести (табл. 1) [15].
Таким образом, между астматической атакой и обострением БА имеются принципиальные различия. Понимание этой разницы позволяет практикующему специалисту вовремя назначить адекватный объем медикаментозной терапии и предпринять все необходимые действия для правильной маршрутизации пациента в лечебное учреждение.
БРОНХИАЛЬНАЯ АСТМА, ПРОСТУДА И COVID-19: КЛЮЧЕВЫЕ РАЗЛИЧИЯ
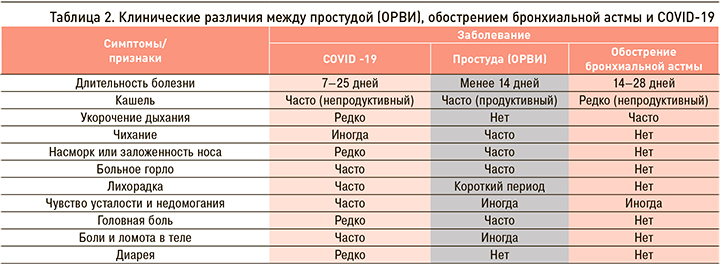
Между БА, простудой (ОРВИ) и COVID-19 существуют принципиальные различия в респираторных симптомах, температурной реакции, эпидемиологическом анамнезе заболевания (табл. 2) [21].
Под термином «простуда» (или острая респираторная вирусная инфекция, ОРВИ) нами понимается острое инфекционное заболевание, ведущей причиной которого выступают риновирусы или коронавирусы, с обязательным поражением верхних дыхательных путей, в том числе носа, горла, придаточных пазух носа, слуховых труб, трахеи, гортани и бронхов [22].
Для дифференциальной диагностики обострения БА, простуды (ОРВИ) или COVID-19 рекомендуется пошаговая структурированная клиническая оценка, включающая следующие этапы: 1) подробный эпидемиологический анамнез (история передвижения, история контакта с инфицированным лицом, внятный аллергический анамнез); 2) анализ медицинской карты и клинических записей (коморбидный фон и хронические болезни); 3) анализ данных лабораторно-инструментальных исследований (спирометрия: жизненная емкость легких (ЖЕЛ), ОФВ1, ОФВ1/ЖЕЛ, пиковая скорость выдоха (ПСВ), эозинофилия крови (EO# ≥300 кл/мкл), уровни С-реактивного белка, прокальцитонина) [15, 23]. Несмотря на то что все перечисленные заболевания могут сопровождаться кашлем, а иногда и одышкой, у пациентов с обострением БА обнаруживается свистящее дыхание и снижается ПСВ, что указывает на нарастание обструкции дыхательных путей [23]. В противоположность сказанному для пациентов с COVID- 19 характерны лихорадка, сухой, малопродуктивный кашель, гриппоподобные симптомы (усталость, головная боль), потеря вкуса и обоняния [24].
КАК ЭФФЕКТИВНО ЛЕЧИТЬ ОБОСТРЕНИЯ АСТМЫ В АМБУЛАТОРНЫХ УСЛОВИЯХ В ПЕРИОД ПАНДЕМИИ COVID-19?
Этот вопрос наиболее часто задается специалистами первичного звена при диагностировании обострения БА. Постараемся дать на него аргументированный ответ.
Во-первых, рекомендации по ведению астмы (GINA 2021) остаются неизменными во время пандемии COVID-19 [13–15]. Несмотря на то что в период пандемии отмечалась нехватка КДБА из-за ажиотажного спроса на них, доказательства какой-либо выгоды от отмены ИГКС-терапии у пациентов с БА в условиях пандемии отсутствуют. Более того, в настоящее время нет доказательств того, что применение ИГКС при обструктивных легочных заболеваниях является фактором риска неблагоприятных исходов как при ОРВИ, так и при инфицировании SARS-CoV-2 [25].
Во-вторых, наиболее оправданной и разумной терапией обострений БА признается сочетание комбинированных КДБА и ингаляционного будесонида в форме небулизированной суспензии в средней дозе 4 мг/сут в домашних условиях [15]. Небулайзерная терапия не имеет ограничений при амбулаторном использовании, если у пациента отсутствует острый COVID- 19 или нет риска заражения окружающих лиц. Домашняя небулайзерная терапия дает возможность пациенту получать лечение в привычных условиях, экономит время и затраты на медицинскую помощь, позволяет минимизировать перекрестное инфицирование в условиях стационара [26].
НЕБУЛИЗИРОВАННЫЙ БУДЕСОНИД: МЕХАНИЗМ ДЕЙСТВИя
Будесонид – это негалогенезированный ГКС, оказывающий выраженное местное действие и обладающий хорошей переносимостью. Он представляет собой смесь (примерно 1:1) эпимеров 22S и 22R, которые имеют сходные фармакологические свойства. Высокая местная активность и селективность действия будесонида обусловливают его геномные и внегеномные эффекты (рис. 3) [27, 28].
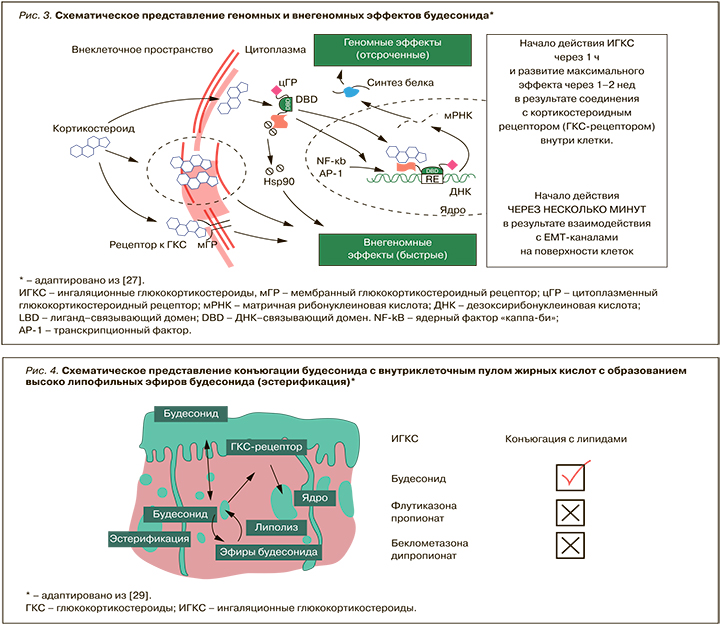
Высокая липофильность является ключевой особенностью этого препарата, определяющей его внегеномную противовоспалительную активность с удлинением интервала действия. После конъюгации будесонида с внутриклеточным пулом жирных кислот образуются липофильные эфиры будесонида (эстерификация), откладывающиеся в клетке. После активации внутриклеточной липазы начинается медленное высвобождение свободного будесонида. Доказано, что этот ГКС сохраняется в тканях дыхательных путей дольше, чем беклометазона дипропионат и флутиказона пропионат (рис. 4) [29]. С этими свойствами связан длительный противовоспалительный эффект небулизированного будесонида при обострениях БА [30].
К доказанным преимуществам небулизированного будесонида относятся [31]:
- быстрое купирование симптомов обострения БА и улучшение дыхательной функции;
- доставка лекарственного средства непосредственно в дыхательные пути;
- минимальные системные нежелательные явления;
- возможность проведения терапии в домашних условиях.
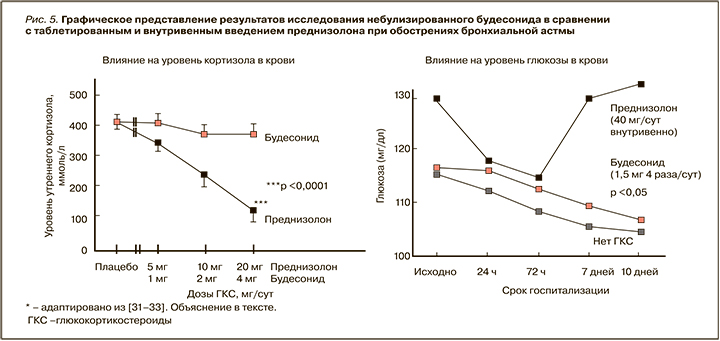
Объективно небулизированный будесонид обладает высоким профилем безопасности и служит надежной альтернативой системным ГКС (рис. 5) [31, 32]. Так, в плацебо-контролируемом исследовании сравнивались дозы 5–10–20 мг таблетированного преднизолона с сопоставимыми дозами 1–2–4 мг небулизированного будесонида по влиянию на уровень утреннего кортизола и глюкозы крови. Было убедительно показано, что небулизированный будесонид сохранял уровень утреннего кортизола при использовании в любой рекомендуемой дозировке, тогда как пероральный преднизолон в дозе 20 мг приводил к 4-кратному снижению концентрации этого гормона [32]. В свою очередь, в открытом проспективном исследовании, посвященном сравнению эффектов небулизированного будесонида в дозе 6 мг/сут и внутривенного преднизолона в дозе 40 мг/сут, было убедительно продемонстрировано, что первый препарат не изменял уровень глюкозы крови как в течение первых суток, так и на 10-й день терапии. В то же время внутривенный преднизолон резко повышал глюкозу крови с 7-го по 10-й день [33].
Отдельного внимания заслуживает обширный ретроспективный мультивариантный регрессионный анализ Ito K. et al. (2020) среди пациентов с обострением БА, поступивших в ОРИТ в период с 2014 по 2019 г. с симптомами жизнеугрожающей астмы и признаками респираторной инфекции, которым назначалась терапия суспензией будесонида в сочетании с прокатеролом. Эти пациенты сравнивались с контрольной группой без ингаляционной терапии. Результаты исследования убедительно свидетельствуют о достоверном преимуществе терапии суспензией будесонида + прокатеролом в плане сокращения дней госпитализации (6,0 против 8,5 дней в контрольной группе) и уменьшения дней существования симптомов жизнеугрожающей астмы (2,5 против 5,0 дней) [34].
ЗАКЛЮЧЕНИЕ
Пандемия новой коронавирусной инфекции изменила отношение к терапии многих хронических легочных заболеваний и особенно к ведению пациентов с БА, когда изменение характера респираторных симптомов требует от врача разумной дифференциальной диагностики между приступом астмы (астматической атакой), обострением БА и инфекцией COVID-19.
Выбор небулизированного будесонида как уникального ИГКС с выраженной противоотечной и противовоспалительной активностью, его способность быстро купировать респираторные симптомы и сокращать время госпитализации открывает реальную клиническую возможность эффективной терапии пациентов с обострениями БА различной степени тяжести, что является важной задачей современной медицины.



