АКТУАЛЬНОСТЬ
Хронический простатит (ХП) – одно из наиболее обсуждаемых урологических заболеваний. Оно широко распространено среди мужчин трудоспособного возраста и имеет большое количество экономических, демографических и социальных негативных последствий. По данным зарубежных авторов, симптомы, характерные для ХП, встречаются у 30–75% лиц мужского пола, в России же заболевание диагностируется у 35% мужчин в возрасте до 40 лет [1–3].
По распространенности ХП стоит в одном ряду с сахарным диабетом и ишемической болезнью сердца. При этом известно, что он не только снижает качество жизни пациентов за счет выраженной клинической симптоматики и рецидивирующего течения, но и оказывает негативное воздействие на сексуальную функцию и сперматогенез, психоэмоциональное состояние мужчин, а также повышает риск развития сопутствующих кардиоваскулярных и неврологических заболеваний [4–6]. Таким образом, не вызывает сомнений, что ХП относится к числу самых серьезных проблем урологии во всем мире.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КЛАССИФИКАЦИИ ХРОНИЧЕСКОГО ПРОСТАТИТА
Истоки современной классификации ХП берут свое начало еще в середине XX в., когда в 1968 г. в журнале Investigative Urology появилась публикация американских урологов Meares E.W. и Stamey T.A. об особенностях локализации инфекции при простатите и уретрите, открывшая новый этап в диагностике этих заболеваний [7].
Логическим развитием этой работы стала предложенная 10 лет спустя систематизация простатита Drach G.W. et al., основанная на интерпретации результатов 4-стаканной пробы Meares – Stamey и впоследствии около двух десятков лет применявшаяся в урологической практике [8]: в соответствии с ней выделяли острый бактериальный, хронический бактериальный, хронический небактериальный простатит и простатодинию. Тем не менее и такая дифференциация имела свои недостатки, что послужило основанием для ее последующего обновления.
Новая категоризация форм простатита (Chronic Prostatitis Symptom Index, CPSI) была разработана на рубеже XX и XXI вв. Национальным институтом здоровья США (National Institutes of Health, NIH) и Национальным институтом диабета, заболеваний органов пищеварения и почек (National Institute of Diabetes and Digestive and Kidney Diseases, NIDDK) [9]. Основными ее критериями служат характер течения и клинических проявлений заболевания, наличие бактериального возбудителя (табл. 1).

В последние годы знания о разнообразии факторов риска ХП и особенностях его патогенеза значительно расширились, что диктует необходимость разработки новых классификаций, отвечающих современным взглядам на механизмы развития заболевания, которые позволят повысить эффективность лечения соответствующих пациентов. Так, Shoskes D.A. et al. в 2009 г. представили модернизированную систематизацию ХП под названием UPOINT [10]. Эта аббревиатура подразумевает оценку шести доменов для более подробного описания определенных клинических фенотипов заболевания: U (Urinary) – мочевой домен; Р (Psychosocial) – психосоциальный домен; О (Organ specific) – органоспецифический домен; I (Infection) – инфекционный домен; N (Neurologic/systemic) – неврологический домен; T (Tenderness) – болевой домен. Согласно выводам авторов, число обнаруженных доменов у определенного пациента выраженно коррелирует с тяжестью и продолжительностью симптомов ХП, при этом выявленный фенотип ХП дает возможность подобрать мультимодальное персонализированное лечение для каждого из доменов [11].
Тем не менее, несмотря на ряд пробелов, классификация CPSI – NIH на сегодняшний день остается основной в большинстве клинических рекомендаций и наиболее распространенной в клинической практике урологов [1–3].
ФАКТОРЫ РИСКА И ЭТИОЛОГИЯ ХРОНИЧЕСКОГО ПРОСТАТИТА
Возникновение и развитие ХП нельзя связывать с каким-либо одним фактором. Заболевание становится результатом воздействия на организм больного множества инициирующих, моделирующих, каскадно множащихся, взаимно обусловленных болезнетворных факторов: анатомических, гемодинамических, уродинамических, гормональных, иммунологических, застойных и инфекционных [12–14]. Они могут быть врожденными и приобретенными (табл. 2).
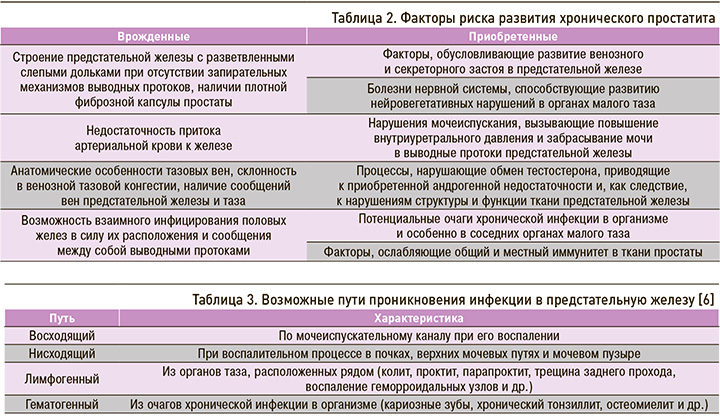
ХП не является «однородной» патологией. Каждый из факторов риска накладывает на заболевание свой отпечаток, определяя развитие той или иной его формы [15]. При этом на практике дифференцировать различные формы простатита зачастую трудно. Несовершенство существующих диагностических методов, морфофункциональные изменения в самой предстательной железе (нарушение дренажной функции из-за закупорки протоков ацинусов железы гнойным секретом, уменьшение объема выделяемого секрета после массажа простаты при отсутствии увеличения в нем количества лейкоцитов), а также наличие сопутствующей патологии, например доброкачественной гиперплазии предстательной железы (ПЖ), могут приводить к сложностям и ошибкам при определении причины возникновения заболевания у конкретного больного. Тем не менее традиционно принято выделять инфекционную и неинфекционную этиологию простатита [16].
ХРОНИЧЕСКИЙ БАКТЕРИАЛЬНЫЙ ПРОСТАТИТ
Несмотря на распространенность простатита, инфекцию при первичном обследовании удается выявить менее чем в 10% случаев [1–3]. Существуют различные пути проникновения инфекции в ПЖ (табл. 3).
В 80% случаев бактериальные простатиты обусловлены инфицированием ПЖ патогенными штаммами кишечной палочки. Остальные наиболее часто встречающиеся бактерии представлены протеем, клебсиеллой, синегнойной палочкой, морганеллами, энтеробактериями, серрацией, энтерококками, патогенными стафило- и стрептококками, неклостридиальными анаэробами [5, 6]. Некоторые виды кокков могут считаться, скорее, нормальными обитателями мочеиспускательного канала (МК), чем возбудителями заболевания простаты. Они могут иметь определенное значение лишь у мужчин с иммунодефицитами. Эти микроорганизмы заслуживают внимания как потенциальные возбудители простатита при отсутствии других возможных патогенов, а также в случаях, когда по мере их исчезновения в процессе лечения отмечается клиническое улучшение. Однозначно считать бактерии причиной воспаления ПЖ можно лишь при соблюдении следующих условий: они не относятся к нормофлоре МК, обладают патогенными свойствами, а их наличие в секрете простаты, как правило, сопряжено с воспалительной реакцией. Нижний порог микробного числа, позволяющий говорить о бактериальной этиологии ХП, равен 104 КОЕ/мл [1, 3, 5].
ХРОНИЧЕСКИЙ АБАКТЕРИАЛЬНЫЙ ПРОСТАТИТ
Воспалительный синдром хронической тазовой боли рассматривают как воспалительный ответ ПЖ при отрицательном результате повторных стандартных микробиологических исследований [2]. При этом на сегодняшний день есть лишь предположительные данные о возможных причинах и механизмах развития абактериального ХП (ХАП). Наиболее достоверными объяснениями развития данной формы заболевания являются инфекционная теория, теория химического воспаления и иммунная теория [16, 17].
Инфекционная теория развития хронического абактериального простатита
Эту концепцию подтверждают данные исследований, в которых было выявлено присутствие микроорганизмов в секрете и ткани ПЖ при отрицательных результатах традиционных микробиологических тестов [14]. К инфекционным агентам, связанным с развитием воспаления при стерильном посеве, относят некоторые персистирующие внутриклеточные микроорганизмы (C. trachomatis, U. urealyticum, M. hominis и др.), анаэробы и вирусы [18, 19].
Д.Н. Величко и соавт., выполнив микробиологический анализ биоптатов ПЖ у мужчин с ХП и аденомой простаты, обнаружили U. urealiticum в 30,4%, T. Vaginalis – в 8,7% случаев [20]. В ходе исследования 332 мужчин с ХП, проведенного О.Л. Тиктинским и С.Н. Калининой, наиболее часто у пациентов встречались уреаплазмы (51,2%) и хламидии (46,7%). Еще в 16,3% случаев у исследуемых были найдены микоплазмы, в 7,2% – гарднереллы, в 10,2% – вирус простого герпеса 2-го типа [21].
Признаками хламидийной инфекции являются [22]:
- смещение соотношения субпопуляций Т-лимфоцитов в сторону снижения как Т-хелперов, так и Т-супрессоров;
- снижение переваривающей функции сегментоядерных лейкоцитов крови и очагов поражения;
- отсутствие реактивности фагоцитов и чувствительности лимфоцитов к иммунокорректорам, повышающим активность иммунной системы.
Хламидии, не вызывающие каких-либо болезненных проявлений, могут в то же время выступать антигенами, стимулирующими возникновение реакций повышенной чувствительности замедленного типа, что приводит к разнообразным осложнениям ХАП. Примерно у 30% больных с признаками ХАП и увеличением количества лейкоцитов в секрете ПЖ (> 10 в большом поле зрения) можно обнаружить специфический кровяной белок – иммуноглобулин IgM к хламидиям, а в сперме – антихламидийные антитела (IgA, IgG) [23–26].
Микоплазмы в количестве не более 103 КОЕ/ мл выявляются в секрете простаты здоровых мужчин, а их детекция в титре 106 КОЕ/мл и более у 10% больных ХАП может подтверждать роль этих микроорганизмов в качестве возбудителя заболевания. Существует обоснованное мнение, что микоплазмы способны проявлять свое болезнетворное действие только при особых обстоятельствах [23–26].
Многие отрицают роль уреаплазм в развитии болезни. Однако уреаплазмы, бессимптомными носителями которых являются женщины, могут играть более значительную роль в развитии воспаления уретры и ПЖ у мужчин, чем микоплазмы. Известно, что уреаплазма, благодаря определенному ферменту, обладает уникальной способностью расщеплять кровяной белок IgA на два фрагмента, что влияет на защитные реакции организма. 10-кратное увеличение концентрации уреаплазм в секрете простаты по сравнению с их концентрацией в моче отмечается у 14% больных ХАП [23–26].
Гарднереллы, как известно, играют ведущую роль в этиопатогенезе бактериального вагиноза. У мужчин эпителий МК устойчив к этим микроорганизмам, хотя их проникновение в уретру при половом акте очевидно. Однако роль гарднерелл в развитии ХАП спорна и не доказана. Наряду с трихомонадами, гонококками, грибами, вирусами и некоторыми другими, их относят к редким возбудителям ХАП воспалительной природы. При трихомонадном уретрите ХАП диагностируют у 11–75%, при вялотекущей хронической гонорее – у 61,2% больных [23–26].
Генитальный герпес – одна из самых распространенных форм вирусной мочеполовой инфекции. Вирус герпеса может передаваться половым путем, проникая через кожу и слизистые, и начинает размножаться в месте внедрения. Затем он поступает в лимфатические узлы, попадает в кровь, нервные волокна и внутренние органы. Сохранение вируса в нервных ганглиях вызывает рецидивы герпетической инфекции. При воспалении МК герпетической природы ХАП может наблюдаться в 21,8% случаев [23–26].
Наиболее частые возбудители грибковых уретритов и простатитов – грибы рода Candida. В качестве причинного фактора ХАП грибки встречаются редко; считается, что слизистая МК и железистая ткань ПЖ к ним мало чувствительны. Развитие микоинфекции возможно лишь при уменьшении иммунологической реактивности организма вследствие нерациональной массивной антибактериальной терапии, применении глюкокортикоидов, дисбактериозе и пр. [23–26].
Предпосылками к развитию ХАП под воздействием перечисленных факторов служат неэффективное удаление микроорганизмов при лечении уретрита, общие заболевания со снижением иммунологической реактивности, предшествовавшая массивная антибиотикотерапия, повреждения МК. Если патогены не были уничтожены в начальной стадии заболевания, они могут задействовать и более сложные различные механизмы выживания в ткани ПЖ. Среди них бактериальная биопленка, представляющая собой структурно организованное сообщество микроорганизмов под общим слизистым слоем, препятствующим воздействию противомикробных средств [25, 26].
Теория химического воспаления
Причиной развития воспаления в ПЖ и перехода его в хроническое может быть «химическое», а точнее, осмотическое воздействие мочи. В нормальных условиях, несмотря на то что моча является агрессивной химической средой (гипертонический, в 10 раз пересыщенный раствор солей), повреждений простаты не возникает. Неповрежденную слизистую уретры на всем протяжении от внутреннего до наружного отверстия защищает специальный слизистый слой, вырабатываемый эпителием. Кроме того, нормальное мочеиспускание сопровождается резким снижением давления в МК, что при условии быстрого тока мочи по уретре не только не способствует ее проникновению в протоки ПЖ, но даже облегчает продвижение секрета из глубины протоков за счет «присасывающего» действия струи мочи [23–26].
Реализация «химического» воспаления ПЖ происходит в условиях нарушенного мочеиспускания. Следует обратить внимание на существование уретрального сфинктера, который при сокращении закрывает просвет МК, прекращая мочеиспускание. Такое сокращение мужчина может вызвать сам, сознательным усилием, но оно может появляться и непроизвольно, в результате воспаления в МК и воздействия различных факторов, обусловленных изменениями нервной системы. При этом нарушается координация в деятельности мускулатуры мочевого пузыря и уретрального сфинктера: на фоне сокращения мускулатуры мочевого пузыря во время мочеиспускания внезапно сокращается сфинктер, что вызывает резкое повышение давления в МК. В результате этого моча может под давлением «впрыскиваться» в протоки ПЖ, повреждать железистый эпителий и приводить к развитию немикробного (асептического) воспаления. Повторение подобных эпизодов «неправильного» обратного тока мочи со скачкообразным повышением внутриуретрального давления, называемое уретропростатическим рефлюксом, может выступать фактором, вызывающим и поддерживающим ХАП [23–26].
Аутоиммунная теория развития хронического абактериального простатита
В пользу этой теории говорит увеличение уровня Т- и В-лимфоцитов в секрете простаты по сравнению с их нормальным содержанием в начальной фазе воспаления. При длительном течении ХАП количество Т-лимфоцитов уменьшается, тогда как В-лимфоциты остаются повышенными, кроме того, в секрете ПЖ наблюдается высокое (92%) содержание 0-лимфоцитов. В стадии активного воспаления у пациентов с ХАП увеличен уровень IgG, IgM, IgA и С3-компонента комплемента в этом биоматериале. Скрытому хроническому воспалению сопутствует снижение концентрации IgM в секрете ПЖ, при этом содержание С4-компонента комплемента в нем повышено и при активном, и при латентном воспалительном процессе. В экспериментах на животных показана возможность развития воспаления в простате с избыточным увеличением количества Т-лимфоцитов после введения в кровоток ее собственного тканевого экстракта и жидкой части спермы, содержащих в том числе и секрет ПЖ [23–26].
КЛИНИКО-ПСИХОЛОГИЧЕСКИЕ АСПЕКТЫ ХРОНИЧЕСКОГО ПРОСТАТИТА
В большинстве случаев на первом плане находятся биомедицинские модели возникновения урологической боли, однако множество исследований демонстрирует также большое влияние накопленного психологического стресса на этиопатогенез и течение ХП [27–29]. Депрессивные руминации, катастрофизация заболевания пациентом, физический и психический дискомфорт снижают вероятность улучшения симптомов в течение 12 мес. Частая неготовность пациента полно и подробно обсуждать с врачом свою болезнь, нерациональное самолечение, избыточный прием препаратов (для перестраховки) отрицательно сказываются на его качестве жизни и комплаентности [27].
Согласно зарубежным источникам, около 40% врачей общей практики и порядка 70% врачей-урологов отмечают влияние психологических особенностей пациента на развитие и течение ХП, при этом 78% больных ХП жалуются на симптомы депрессии, а у 60% диагностируются средняя или тяжелая депрессия либо паническое расстройство [29]. Существует ассоциация проявлений депрессии и панического расстройства с болевыми и мочевыми симптомами при ХП. Поскольку у многих мужчин с ХП наблюдается повышенная реакция на стрессовые воздействия с усилением урологических симптомов, исследователями был предложен термин «стресс-индуцированный простатит» (stress prostatitis) как эквивалент панической атаки [27].
Установлено, что у пациентов рецидивы простатита зачастую возникают на фоне профессионального переутомления, хронического стресса (в том числе финансового). У порядка четверти больных, с их слов, появление или обострение симптомов простатита связано с разводом, у 4–6% – с проблемами планирования деторождения, потерей ребенка при беременности партнера [29]. Кроме того, психоэмоциональные нарушения негативно отражаются на вегетативной регуляции, снижают адаптационные возможности организма, а также существенно повышают уровень перекисного окисления липидов (ПОЛ), которое, в свою очередь, оказывает влияние на течение воспалительного процесса [30].
ПАТОГЕНЕЗ ХРОНИЧЕСКОГО ПРОСТАТИТА
Гиподинамия, злоупотребление алкоголем и острой пищей, нерегулярная половая жизнь, половые эксцессы, длительное половое воздержание служат причиной секреторной и венозной тазовой конгестии. Последняя за счет повышения активности альфа-адренорецепторов вегетативной нервной системы способствует спазму артериальных сосудов и стазу крови в простатических венах. Эти процессы лежат в основе отека ткани ПЖ с ущемлением ее в ригидной фиброзной капсуле простаты, повышением внутрипростатического давления и боли, которые вызывают в клетках железы активизацию каскадов обмена арахидоновой кислоты с развитием местного воспаления и вторичных нарушений кровообращения [6].
Первичные нарушения микроциркуляции в простате, кроме того, влекут за собой ишемию и гипертонус гладкомышечных элементов ПЖ, что становится основой расстройств уродинамики, координации сокращений мускулатуры мочевого пузыря и уретрального сфинктера, скачкообразного повышения внутриуретрального давления, уретропростатического рефлюкса, который выступает дополнительным фактором, усугубляющим и поддерживающим течение воспалительного процесса.
Возникновение хронического воспалительного процесса в простате включает множество сложных механизмов. На его фоне происходит выход форменных элементов крови и компонентов плазмы в ткани ПЖ и ее секрет, что создает условия для повреждения органа. При длительном стаже простатита возможна сенсибилизация организма тканями собственной ПЖ, лежащая в основе аутоиммунных изменений, в дальнейшем поддерживающих воспалительный процесс и способствующих его хронизации. Сдавление выводных протоков простаты окружающей воспаленной тканью приводит к вторичному нарушению оттока ее секрета и воспалительного экссудата с образованием мелких гнойных полостей – микроабсцессов. Повреждение и воспалительная отечность сменяются рубцеванием. Разрастающаяся соединительная ткань еще больше сдавливает выводные протоки простаты, усугубляя застой секрета, который распадается и подвергается обратному всасыванию тканью ПЖ [23–26].
РОЛЬ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ В РАЗВИТИИ И ТЕЧЕНИИ ВОСПАЛЕНИЯ В ТКАНИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
При любом воспалении в организме, в том числе при простатите, существенная роль в повреждении клеточных мембран принадлежит ПОЛ [30, 31]. Оно отличается реакциями с образованием особых веществ – высоко активных свободных радикалов, способных разрушать нормальные клетки. В норме подобный механизм потенциально заложен в каждой клетке, а его реализации препятствует естественная антиоксидантная система (АОС). Наблюдаемые при воспалении активация ПОЛ, недостаток ряда микроэлементов (цинка, селена) и других веществ с антиоксидантными свойствами увеличивают расход компонентов АОС – биоантиокислителей, что снижает способность организма регулировать ПОЛ (липопероксидацию) и способствует поддержанию повреждения тканей. У больных ХП на фоне усиления ПОЛ антиоксидантная активность плазмы крови возрастает, а секрета простаты значительно уменьшается. Существует точка зрения, что изменения в ПЖ, связанные с венозным застоем в малом тазу и секреторной конгестией в простате, располагают к активации ПОЛ, повышенной потере биоантиокислителей и снижению потенциала АОС. В таких условиях значительно возрастает угроза инфицирования простаты, что опять же стимулирует ПОЛ в ее клетках, несмотря на компенсаторное усиление активности АОС в плазме крови. При этом антиоксидантный ресурс секрета простаты заметно ослабевает, что негативно сказывается и на фертильности сперматозоидов, и на состоянии местного иммунитета [23–26].
При воспалении инициируется вторичная активация ферментных клеточных систем, образующих кинины и простагландины, изменяются обмен и баланс тестостерона. Вследствие этого существенно ухудшаются процессы микроциркуляции крови и тканевой жидкости в ПЖ. Нарушение проницаемости мембран железистых клеток простаты способствует выходу жидкой части крови в межклеточные пространства, усиливая и поддерживая отечность воспаленной ткани ПЖ.
Кроме того, свободные радикалы способны оказывать повреждающее воздействие на сперматозоиды. Это обусловлено, во-первых, исключительной восприимчивостью мембран сперматозоидов к продуктам ПОЛ в связи с высоким содержанием в их составе полиненасыщенных жирных кислот. Во-вторых, в отличие от других клеток сперматозоиды характеризуются низким потенциалом восстановления поврежденных внутриклеточных структур из-за малого количества цитоплазмы и неактивного хроматина. В-третьих, мужские половые клетки обладают низкой обороноспособностью против агрессии свободных радикалов [23–26].
НЕЙРОГУМОРАЛЬНЫЕ ФАКТОРЫ ПАТОГЕНЕЗА ХРОНИЧЕСКОГО ПРОСТАТИТА
Нарушение нейрогуморальной и местной регуляции функций простаты также рассматривается как одна из предпосылок развития ХП [23–26]. Мы упоминали о вероятной роли повышенной активности альфа-1-А-адренорецепторных структур в развитии нарушений кровообращения таза и простаты. В последние годы удалось выяснить, что регуляция функций ПЖ в значительной степени определяется различными биохимическими факторами, вовлеченными в процессы локального контроля деятельности железистого эпителия, выработки секрета и моторики органа. К таким факторам, кроме нейропептидов, играющих роль нейротрансмиттеров, нейромодуляторов и питательных факторов, относится крайне важный универсальный химический регулятор работы гладкомышечных органов – окись азота (NO).
NO – газообразный нейромедиатор и нейромодулятор, который образуется в результате деятельности специальных нервных окончаний, а также эндотелия кровеносных сосудов под действием фермента NO-синтазы. Он участвует как в центральных, так и местных регуляторных реакциях. Так, введение NO или его предшественников в область дыхательного и сосудодвигательного центров вызывают уменьшение частоты дыхания и вентиляции легких при увеличении длительности вдоха, а также падение системного артериального давления и сокращение частоты сердечных сокращений. К местным реакциям на введение NO относятся выраженная вазодилатация и, как следствие, снижение периферического и общего сосудистого сопротивления, местного и системного артериального давления. Доказано, что заболевания, сопровождаемые спазмом гладкой мускулатуры, например артериальная гипертензия и бронхиальная астма, связаны с недостатком этого вещества.
Сегодня убедительно доказана важная роль NO в регуляции половой функции мужчин, в частности в возникновении и поддержании эрекции. Известные лекарственные средства из группы ингибиторов фосфодиэстеразы-5 (силденафил, тадалафил, варденафил и др.) оказывают непосредственное влияние на расслабляющее действие окиси азота в ткани кавернозных тел полового члена. Тормозя активность фермента супероксиддисмутазы, имеющего важное значение в АОС организма, окись азота служит фактором, препятствующим повреждениям клеток. Синтез NO защищает мембраны сперматозоидов от разрушающего влияния продуктов ПОЛ. Недавно получены данные о существенной прямой зависимости активности сперматогенного эпителия яичек от активности NO-синтазы и концентрации NO в артериальной крови, омывающей тестостерон-продуцирующие клетки.
С другой стороны, избыточное образование NO приводит к повреждениям клеток, следовательно, для адекватного контроля функций гладкомышечных органов необходим нормальный уровень окиси азота в организме. NO-синтаза обнаружена в нервных клетках и ткани, окружающих секреторные дольки ПЖ, что свидетельствует о возможном участии NO в регуляции деятельности простаты. Совместное расположение структур, образующих вазоактивный интестинальный пептид (VIP) и NO-синтазу в нервных волокнах, расположенных непосредственно под секреторными железистыми клетками долек простаты, указывает на совместную роль NO и VIP в продукции секрета ПЖ. Торможение активности NO-синтазы, уменьшающее продукцию окиси азота, или, наоборот, ее избыточная активность приводят к дисфункции ПЖ с развитием воспаления и разрастанием железистых элементов доброкачественного и злокачественного характера.
К другим факторам, вносящим свой вклад в развитие и сохранение воспаления и других патологических процессов в ПЖ, относится эндотелин, вырабатываемый сосудистым эндотелием. Этот пептид, обладающий действием, противоположным NO, обнаружен в секреторном железистом эпителии простаты. Интересно, что сперма содержит самую высокую концентрацию эндотелина в сравнении с другими жидкостями мужского организма. В зависимости от дозы эндотелин может вызывать сокращение как капсулы, так и всей ткани ПЖ. Помимо этого, он резко повышает скорость развития и размножения различных клеток, включая железистые клетки простаты. Его роль в патогенезе воспалительных изменений тканей ПЖ уточняется. Характерно, что функция эндотелина находится во взаимодействии и равновесии с окисью азота, которую, как мы уже отмечали, вырабатывает эндотелий сосудов простаты. NO, вызывая расслабление гладких мышц простаты и тормозя выработку эндотелина, нейтрализует его эффекты и таким образом может поддерживать баланс тонуса ее гладкой мускулатуры [23–26].
СОСТАВ СЕКРЕТА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И ЕГО РОЛЬ В ТЕЧЕНИИ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА
Секрет предстательной железы (СПЖ) за счет вырабатываемых ферментов обладает способностью разрушать белковые вещества. Многие из этих ферментов непосредственно вовлечены в процессы роста и разрушения отживших клеток. Так, широко известный как опухолевый маркер простатоспецифический антиген (ПСА) является особым белком (гликопротеидом), функция которого заключается в разжижении спермы. В секрете простаты содержатся и другие ферменты: кислая фосфатаза, лактатдегидрогеназа, малатдегидрогеназа, глюкуронидаза и пр. Наиболее известна среди них простатическая кислая фосфатаза, играющая роль в обеспечении правильного роста клеток простаты. Простатические ферменты участвуют в необходимом разрушении продуктов спермы, например в деструкции белка, ограничивающего подвижность сперматозоидов [24].
Из-за высокого уровня цитрата СПЖ имеет слабокислый pH. Образуя комплексы с Са2+, лимонная кислота обеспечивает поддержание низкой концентрации свободных ионов кальция в сперме, что необходимо для подвижности, функциональной активности, оплодотворяющей способности половых клеток. Содержание лимонной кислоты в ткани простаты на несколько порядков (примерно в 500–1000 раз) превышает таковую в плазме крови [22].
Обсуждается этиологическая роль аберрации простатических протеолитических энзимов и цитратов в развитии деструктивных и воспалительных процессов в простате, мужской инфертильности, поскольку эти состояния сопровождаются значительными изменениями содержания указанных веществ в СПЖ и семенной плазме.
К другим пептидным соединениям, которые предположительно могут влиять на развитие ХАП, относят так называемые факторы роста (эпидермальный фактор роста, инсулиноподобные факторы роста и др.). Они продуцируются в ПЖ и участвуют в регуляции ее роста – как нормального, так и патологического [22].
ЦИТОКИНЫ И ХРОНИЧЕСКИЙ ПРОСТАТИТ
Поскольку в вопросах патогенеза ХАП остается еще немало неясных моментов, в настоящее время продолжается изучение ранее не известных факторов, так или иначе вовлеченных в формирование и поддержание воспаления ПЖ. Особое внимание в этом плане уделяется так называемым цитокинам – растворенным в СПЖ, семенной плазме и других жидких средах организма протеинам, которые вырабатываются клетками иммунной системы и служат обязательными регуляторами воспалительных и иммунных реакций [32–34].
Доказательство роли цитокинов в воспалительном процессе в простате стало бы дополнительным доводом в пользу иммунной или аутоиммунной теории патогенеза ХАП. Важный вектор исследований, посвященных оценке значения цитокинов в воспалении простаты, – определение их концентраций в эксприматах ПЖ у пациентов с различными формами ХП и здоровых людей. При этом с помощью этих маркеров ученые пытаются выявить сходства и различия в механизмах развития воспалительного и невоспалительного синдромов хронической тазовой боли (категории IIIA и IIIB) и асимптоматического воспалительного ХП (категория IV). Также выясняются возможности использования уровня цитокинов как дополнительного критерия диагностики различных форм ХП и индикатора эффективности терапии [32–34].
В связи с этим отметим, что у пациентов с ХАП (категория IIIA и IIIB) по сравнению со здоровыми лицами в семенной плазме наблюдается высокодостоверное повышение концентрации интерлейкина 1β (ИЛ-1β) и фактора некроза опухоли-альфа (ФНО-α) – почти в 9 и 5,5 раза соответственно. При этом отмечается сильная корреляция между уровнем цитокинов в семенной плазме и выраженностью заболевания, тогда как взаимосвязь между их концентрацией и числом лейкоцитов в СПЖ не обнаружена. Это позволяет выдвинуть следующие постулаты.
1. Цитокины имеют непосредственное отношение к реализации хронического воспаления в ПЖ.
2. Воспаление ПЖ и нижних мочеполовых путей – обязательный признак ХП, независимо от наличия или отсутствия лейкоцитов в эксприматах ПЖ [32–34].
3. Уровень цитокинов в семенной плазме может служить объективным критерием наличия и степени тяжести ХП и использоваться как маркер успешности комплексной терапии.
Помимо существенного возрастания концентрации цитокинов в эксприматах ПЖ при ХАП, показано, что у пациентов с воспалительным ХАП (категории IIIA и IV) уровень ИЛ-1β и ФНО-α высокодостоверно (p < 0,001) выше, чем при невоспалительном синдроме хронической тазовой боли. При этом наблюдаются сильная корреляция между концентрацией ИЛ-1β и ФНО-α (p < 0,003) и отсутствие корреляционной зависимости между содержанием лейкоцитов в СПЖ и уровнем этих цитокинов. Таким образом, концентрация цитокинов, наряду с прочим, может быть критерием дифференциальной диагностики воспалительного или невоспалительного генеза хронической тазовой боли при ХП и фактором, подтверждающим диагноз асимптоматического воспалительного простатита. Новые данные в этой области, возможно, станут основанием для пересмотра некоторых традиционных аспектов дифференциальной диагностики ХАП, в частности необходимости использования такого лабораторного критерия, как количество лейкоцитов в СПЖ.
При ХАП (категории IIIA и IV) обнаружено существенное возрастание уровня и ряда других цитокинов: ИЛ-6, ИЛ-8, ИЛ-10, продуктов лизиса клеточных рецепторов (R-протеинов), «фактора роста нервов». Интересно, что у больных с ХАП имеют место высокодостоверные корреляционные связи между концентрацией цитокинов в семенной плазме и показателями качества жизни, а в некоторых случаях и со степенью болевого синдрома. При этом, как было сказано, необходимы дальнейшие исследования роли цитокинов в патогенезе ХАП с целью практического применения полученных знаний в диагностике заболевания [32–34].
Несомненно, что установление типа тканевой реакции в простате при различных формах ХАП возможно только с помощью морфологического исследования. Однако биопсия представляет собой достаточно сложную и трудоемкую диагностическую манипуляцию. С другой стороны, любая морфологическая картина в ПЖ неминуемо отзывается определенной реакцией в секрете, вырабатываемом этим органом. Поэтому адекватный анализ клеточных коопераций и биохимических сдвигов в эксприматах ПЖ позволяет оценить суть патологических процессов, происходящих в органе, и тем самым обосновывать рациональный подбор терапии [23–26].
ЗАКЛЮЧЕНИЕ
Какими бы ни были причины ХП, при длительном течении воспалительного процесса в простате на определенной стадии инфекционные факторы отодвигаются на задний план, и болезнь приобретает характер вторичного асептического воспаления. При этом как в случаях бактериального ХП, так и в отсутствие изначального инфицирования ПЖ наблюдается конвергенция патогенетических механизмов: приоритетными становятся аспекты патогенеза, связанные с нарушениями нервной и гуморальной регуляции, застой секрета ПЖ, нарушение микроциркуляции, нарушение трофики и регуляции сократительных элементов, снижение барьерных функций, аллергические и токсические повреждения [25].
Понимание этиологии и патогенеза ХП способно помочь в выборе эффективной стратегии лечения. Учитывая роль оксидативного стресса в патогенезе ХП, морфофункциональном состояния ПЖ, а также в течении и исходе заболевания, большое значение имеет состояние системы антиоксидантной защиты организма и биохимический состав простатического секрета. С этой точки зрения целесообразным и обоснованным является применение антиоксидантных витаминно-минеральных комплексов, содержащих такие важные для функционального состояния простаты микроэлементы, как цинк и селен, к которым относится комплекс Селцинк Плюс®. Применение Селцинк Плюс® в комбинированной терапии ХП – один из путей совершенствования терапии больных с ХП любой этиологии [26].


