Согласно Римским критериям III пересмотра, принятым на Всемирном конгрессе гастроэнтерологов в Риме в 2006 г., синдром раздраженного кишечника (СРК) определяют как функциональное расстройство, при котором периодически повторяющиеся боль или неприятные ощущения (дискомфорт) в животе связаны с дефекацией, изменениями частоты и характера стула или другими признаками нарушения опорожнения кишечника при отсутствии идентифицируемых органических причин [1]. Согласно клиническим рекомендациям Американского колледжа гастроэнтерологов (ACG, 2014), боль или дискомфорт в животе в сочетании с изменением стула должны иметь при СРК длительность, по меньшей мере, 3 мес.
 СРК – «диагноз исключения», который ставят после исключения других причин с учетом всех указанных выше критериев. Римские критерии III предусматривают четыре варианта СРК: СРК с запорами, СРК с диареей, смешанный и неклассифицируемый вариант, характеризующийся недостаточным изменением формы стула для определения типа СРК [1]. Позднее, по мере углубления знаний о механизмах развития СРК, классификация дополнена еще четырьмя вариантами заболевания, исходя из различия провоцирующих факторов: СРК постинфекционный, индуцированный приемом пищи или определенными продуктами, стресс-индуцируемый и СРК, вызванный опиатами [2–6].
СРК – «диагноз исключения», который ставят после исключения других причин с учетом всех указанных выше критериев. Римские критерии III предусматривают четыре варианта СРК: СРК с запорами, СРК с диареей, смешанный и неклассифицируемый вариант, характеризующийся недостаточным изменением формы стула для определения типа СРК [1]. Позднее, по мере углубления знаний о механизмах развития СРК, классификация дополнена еще четырьмя вариантами заболевания, исходя из различия провоцирующих факторов: СРК постинфекционный, индуцированный приемом пищи или определенными продуктами, стресс-индуцируемый и СРК, вызванный опиатами [2–6].
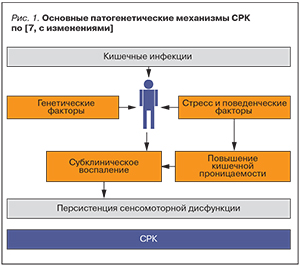
Патогенез СРК продолжает интенсивно изучаться. На сегодняшний день ведущими патогенетическими факторами заболевания считаются генетические особенности, психосоматические нарушения, реализующиеся по оси «головной мозг – кишечник», висцеральная гиперчувствительность, изменение моторной функции кишечника (кишечного транзита), нарушение кишечной микробиоты, активация иммунной системы кишечной стенки и субклиническое воспаление [7–10]. Причем воспаление рассматривается как один из ключевых механизмов развития СРК, неразрывно связанный с другими звеньями его патогенеза (рис. 1). Именно субклиническое воспаление слизистой оболочки кишки, трактуемое также как минимальный воспалительный процесс, является результирующим итогом генетической предрасположенности, стрессов, перенесенных кишечных инфекций в сочетании с повышением проницаемости стенки кишки. Оно, в свою очередь, способствует развитию моторной дисфункции и гиперсенситивности кишечника, обусловливающих клиническое манифестирование СРК (рис. 2).
 Особую роль воспаление играет в развитии постинфекционного СРК. Об этом свидетельствуют результаты детального изучения маркеров воспалительной реакции в слизистой оболочке толстой кишки (СОТК) и регионарных лимфатических узлах при данном состоянии [8, 11, 12]. Установлено, что персистирующий воспалительный процесс в СОТК при постинфекционном СРК реализуется посредством гиперплазии и гиперфункции тучных клеток, активации моноцитов, индуцирующих развитие иммунного воспаления, увеличения экспрессии индуцибельной NO-синтазы, интерлейкина-1, фактора некроза опухоли α (ФНО-α). В исследовани L. Ohman и М. Simrén (2010) показано, что развитие любого типа СРК ассоциируется с гиперплазией энтерохромаффинных клеток, продуцирующих серотонин и мелатонин, высокой экспрессией пептида YY, инфильтрацией СОТК лимфоцитами, макрофагами и плазмоцитами. Наличие активного воспалительного процесса в СОТК у пациентов с СРК подтверждено увеличением числа клеток, иммунопозитивных по отношению к основному маркеру воспаления – кальпротектину, продуцируемому макрофагами и моноцитами [8]
Особую роль воспаление играет в развитии постинфекционного СРК. Об этом свидетельствуют результаты детального изучения маркеров воспалительной реакции в слизистой оболочке толстой кишки (СОТК) и регионарных лимфатических узлах при данном состоянии [8, 11, 12]. Установлено, что персистирующий воспалительный процесс в СОТК при постинфекционном СРК реализуется посредством гиперплазии и гиперфункции тучных клеток, активации моноцитов, индуцирующих развитие иммунного воспаления, увеличения экспрессии индуцибельной NO-синтазы, интерлейкина-1, фактора некроза опухоли α (ФНО-α). В исследовани L. Ohman и М. Simrén (2010) показано, что развитие любого типа СРК ассоциируется с гиперплазией энтерохромаффинных клеток, продуцирующих серотонин и мелатонин, высокой экспрессией пептида YY, инфильтрацией СОТК лимфоцитами, макрофагами и плазмоцитами. Наличие активного воспалительного процесса в СОТК у пациентов с СРК подтверждено увеличением числа клеток, иммунопозитивных по отношению к основному маркеру воспаления – кальпротектину, продуцируемому макрофагами и моноцитами [8]
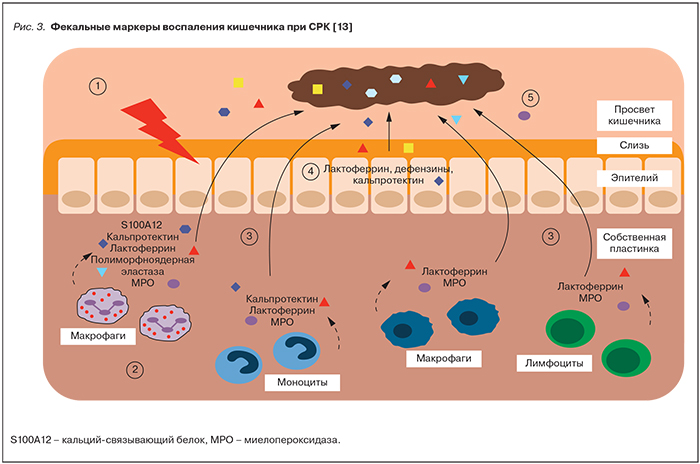
На рис. 3 представлена схема появления маркеров воспаления в кале при СРК [13]. Под действием факторов риска СРК (стресс, кишечные инфекции, генетическая предрасположенность, образ жизни и т. п.), обозначенных на схеме цифрой 1, происходит активация кишечной иммунной системы. В ходе иммунного ответа происходит приток различных клеток врожденного иммунитета (гранулоцитов, моноцитов, макрофагов), обозначенных цифрой 2, и клеток адаптивной иммунной системы (Т-лимфоцитов) в СОТК. Эти клетки активно секретируют медиаторы воспаления или дегранулируются с выходом активных белков – лактоферрина, полиморфноядерной эластазы, миелопероксидазы, кальпротектина и кальций-связывающего белка (данный процесс обозначен цифрой 3 на рис. 3). На ранних стадиях воспаления кишечника часть этих белков выходит из слизистой оболочки в полость кишечника, часть – находится в эпителии и кишечной слизи в непосредственном контакте со слизистой оболочкой (цифры 4 и 5 на рис. 3). Поэтому фекальные массы содержат специфические белки воспаления СОТК. Обнаружение этих маркеров в кале указывает на наличие и степень воспаления кишечника.
Основным клиническим симптомом при всех вариантах СРК является абдоминальная боль, обусловленная, прежде всего, висцеральной гиперчувствительностью. Висцеральная чувствительность формируется на разных уровнях – периферическом (слизистая/подслизистая оболочка кишки), спинномозговом и уровне ЦНС. Наряду с невоспалительными стимулами, такими как стресс и др., к пусковым механизмам висцеральных болей относят также воспалительные и химические медиаторы. Воспалительные медиаторы, такие как простагландин E2, или химические медиаторы, такие как АТФ, брадикинин, 5-гидрокситриптамин, субстанция P и кальцитониноген-связанный пептид, напрямую активируют нервные окончания и стимулируют высвобождение болевых медиаторов, гистамина, серотонина, фактора роста нервов из других клеток и афферентных нейронов, ответственных за повышенную болевую чувствительность [14, 15].
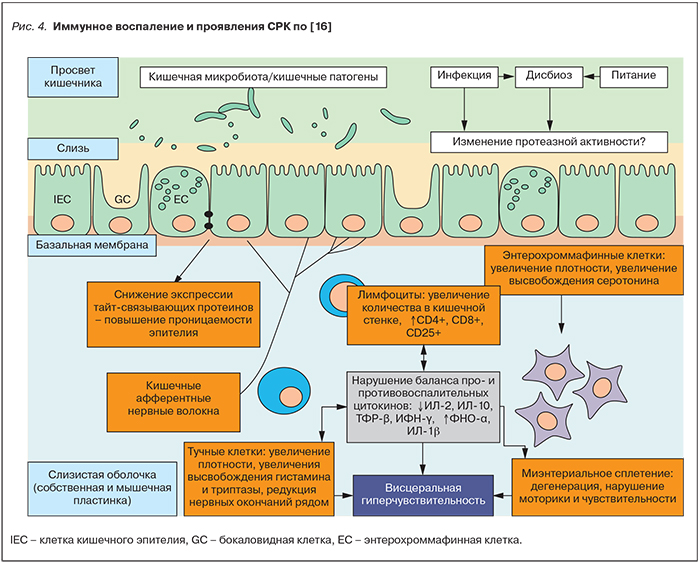
На рис. 4 представлены данные о влиянии иммунного воспаления на клиническую симптоматику СРК. В основе процесса лежит повышение проницаемости эпителиального барьера, что инициирует иммунный ответ – активацию тучных клеток и лимфоцитов в СОТК. Выход в слизистую оболочку медиаторов воспаления из тучных клеток и лимфоцитов вызывает раздражение энтеральной нервной системы, воспаление СОТК, изменения чувствительности и моторики кишечника [16].
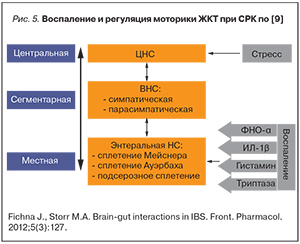
Нейросоматические изменения СОТК влияют на ЦНС, сигналы от которой вторично воздействуют на сенсорно-моторное состояние кишечника и местную иммунную систему, формируя тем самым «порочный круг» с постоянной сменой причинно-следственных отношений (рис. 5). В частности, при СРК описано увеличение количества Т-лимфоцитов, триптазы и гистамина, вызывающих повышенную возбудимость висцеральных сенсорных нервов в различных отделах кишечника [9].
 Появление многочисленных доказательств наличия иммунно-воспалительных изменений в СОТК у пациентов с СРК явилось основанием для обсуждения необходимости пересмотра оценки СРК как чисто функционального заболевания. И в настоящее время СРК все чаще рассматривается не как функциональная патология, а как воспалительное заболевание кишечника с минимальными изменениями слизистой оболочки.
Появление многочисленных доказательств наличия иммунно-воспалительных изменений в СОТК у пациентов с СРК явилось основанием для обсуждения необходимости пересмотра оценки СРК как чисто функционального заболевания. И в настоящее время СРК все чаще рассматривается не как функциональная патология, а как воспалительное заболевание кишечника с минимальными изменениями слизистой оболочки.
Данный подход диктует необходимость использования для лечения пациентов с СРК не только традиционных лекарственных препаратов (селективных спазмолитиков, прокинетиков, слабительных или противодиарейных средств, кишечных антибиотиков или антисептиков, эубиотиков, препаратов для коррекции психоэмоциональных нарушений), но и других, принципиально новых медикаментов, оказывающих комплексное влияние на максимально большое число изученных патогенетических факторов, в т.ч. воспалительный процесс.
В качестве подобного средства может рассматриваться отечественный препарат Колофорт, позволяющий эффективно контролировать заболевание, несмотря на клинические различия его вариантов. Комплексное действие Колофорта опосредовано тремя его компонентами: аффинно очищенными релиз-активными антителами (РААТ) к мозгоспецифическому белку S-100, гистамину и ФНО-α. РААТ к мозгоспецифическому белку S-100 в составе Колофорта обладают антистрессорным, антидепрессивным, антиастеническим и анксиолитическим действием, проявляют ноотропную, стресс- и нейропротекторную активность посредством стимулирующего влияния на 5НТ-рецепторы и антагонистического – на дофаминовые рецепторы [17]. РААТ к гистамину оказывают спазмолитическое, противовоспалительное, противоотечное действие, способствуя нормализации нарушенной моторики желудочно-кишечного тракта (ЖКТ) [18]. РААТ к ФНО-α оказывают выраженное противовоспалительное действие с нормализацией соотношения провоспалительных и противовоспалительных цитокинов в кишечной стенке [19].
Колофорт относится к фармакотерапевтической группе комплексных средств с противовоспалительным, спазмолитическим и анксиолитическим эффектами. В эксперименте показано, что его компоненты модифицируют активность лиганд-рецепторного взаимодействия эндогенных регуляторов с соответствующими рецепторами: антител к белку S-100 – с серотониновыми рецепторами и сигма-1 рецепторами; антител к ФНО-α – с рецепторами ФНО-α; антител к гистамину – с локализованными в ЖКТ Н4-гистаминовыми рецепторами.
В ходе доклинических исследований Колофорта и его компонентов в НИИ фармакологии СО РАМН (Томск) был конкретизирован механизм действия препарата и оценено его влияние на основные звенья патогенеза СРК [20]. Установлено, что применение компонентов в составе Колофорта способствует нормализации нервной и гуморальной регуляции функции кишечника, снижению висцеральной гиперчувствительности рецепторов толстой кишки к растяжению, восстановлению нарушенной моторики ЖКТ, купированию ощущения вздутия живота и переполнения желудка, уменьшению выраженности болевого абдоминального синдрома. Спазмолитическое действие препарата проявляется в расслаблении гладкой мускулатуры и уменьшении тонуса стенок желудка и кишечника, снижении внутрипросветного давления, нормализации консистенции стула, его частоты и в устранении сопутствующих синдромов (купирование императивных позывов, тенезмов, чувства неполного опорожнения кишечника, дополнительных усилий при акте дефекации и т. д.). Были сделаны выводы о том, что Колофорт обладает антистрессорной активностью, оказывает антидепрессивное, противотревожное и спазмолитическое действие, имеет выраженные противовоспалительные свойства, включая противоотечное и анальгетическое действие, способствует нормализации моторной функции кишечника (кишечного транзита).
Результаты многоцентрового двойного слепого плацебо-контролируемого рандомизированного клинического исследования [21] показали, что Колофорт оказывает выраженный анальгетический эффект у пациентов со всеми вариантами СРК, который развивался в течение первых 2-х нед терапии. Установлено, что уменьшение выраженности болевого абдоминального синдрома и восстановление моторно-эвакуаторной функции ЖКТ на фоне лечения Колофортом происходило за счет воздействия как на центральные, так и на периферические звенья патогенеза СРК, висцеральную гиперчувствительность и гипералгезию, субклиническое воспаление и психофизиологические расстройства.
Результаты данного исследования свидетельствуют о том, что Колофорт оказывает значимое положительное влияние на форму и частоту стула у пациентов с разными вариантами СРК. Средняя частота стула у пациентов подгруппы «СРК с преобладанием запоров» от исходных 1–2 раза/нед увеличивалась до 3–7 раз. Одновременное улучшение характеристик стула и анальгетический эффект при лечении Колофортом было зарегистрировано у 84% больных. При этом все пациенты отмечали снижение выраженности «негастроэнтерологических» соматовегетативных и психофизиологических расстройств, повышение физической и умственной работоспособности, активности и стрессоустойчивости, уменьшение раздражительности и эмоциональной лабильности. Итогом позитивного влияния на разные стороны физического и психического здоровья было улучшение качества жизни пациентов в целом [21].
Колофорт применяется в виде таблеток для рассасывания, по 1–2 таблетки 2 раза/сут (не во время еды). Рекомендуемая длительность лечения составляет 3 мес. Учитывая нарастающий в течение 12-недельного курса эффект, можно рекомендовать его продление до 6 мес. На фоне обострения заболевания возможно увеличение частоты приема Колофорта до 4 раз/сут на срок от 7 до 14 дней с последующим переходом на двукратный прием. Препарат не оказывает седативного действия, не вызывает привыкания и синдрома отмены.



