Хронический панкреатит (ХП) – сложная проблема клинической терапии и хирургии. Несмотря на прогресс в диагностике и лечении ХП, он по-прежнему приводит к тяжелым осложнениям и в ряде случаев заканчивается летально.
К основным этиологическим причинам формирования ХП относятся алкоголь и желчнокаменная болезнь (ЖКБ) [1]. Однако ХП формируется лишь у 10% [2] больных, злоупотребляющих алкоголем. ХП может развиться и без видимых провоцирующих факторов; это т.н. идиопатический панкреатит (ИП), который составляет 10–30% всех случаев заболевания [3]. Одним из признанных факторов риска ХП являются генетические мутации, приводящие к ферментопатиям, которые становятся причиной хронического рецидивирующего воспаления. В свою очередь, ХП является фактором риска развития рака поджелудочной железы (ПЖ) [4].
Основными генами, в которых происходят мутации, приводящие к формированию ХП, являются: ген муковисцидоза – сystic fibrosis transmembrane conductance regulator (CFTR), ген катионного трипсиногена (PRSS1) и панкреатического секреторного ингибитора трипсина (SPINK1) [5]. Описаны и другие мутации, оказывающие влияние на состояние ПЖ. Это мутации в генах, отвечающих за синтез α1-антитрипсина [6], обмен железа (наследственный гемохроматоз), синтез алкогольдегидрогеназы. Мутации в генах, таких как PPARG, отвечающих за углеводный и липидный обмен, могут влиять на формирование сахарного диабета (СД) при ХП [7].
Встречаемость генов, влияющих на формирование ХП, в разных странах различна и составляет в популяции 2%. В группе больных ХП встречаемость мутаций в данных генах составляет 13–37%. Исследования, направленные на уточнение роли наследственных факторов в развитии ХП, являются актуальными во всем мире. В Европе создается регистр наследственного панкреатита и рака ПЖ [5].
Цель исследования: выявить мутации SPINK1 N34S, PRSS1, R122H и CFTR, мутации del508 и Gly542Ter в группе больных с заболеваниями ПЖ.
Материалы и методы
Обследовано 150 человек (105 мужчин и 45 женщин) с патологией ПЖ. Средний возраст больных составил 48±12,4 года. В группу вошли 75 пациентов с алкогольным панкреатитом (АП), 41 – с ИП, 17 – с билиарным панкреатитом (БП), 2 – с аутоиммунным панкреатитом, 7 больных, оперированных по поводу рака ПЖ, и 8 пациентов, оперированных по поводу муцинозной цистаденомы (МЦА). У всех оперированных больных диагноз был подтвержден гистологическим исследованием операционного материала.
Диагноз ХП устанавливался на основании комплексного клинического и лабораторно-инструментального обследования, включающего в т.ч. эндоскопическую ультрасонографию, компьютерную и магнитно-резонансную томографию брюшной полости. Всем больным было проведено молекулярно-генетическое исследование с использованием полимеразной цепной реакции в генах SPINK1 N34S, PRSS1, R122H и CFTR, мутации del508 и Gly542Ter (НПО «Литех», Россия).
Результаты и обсуждение
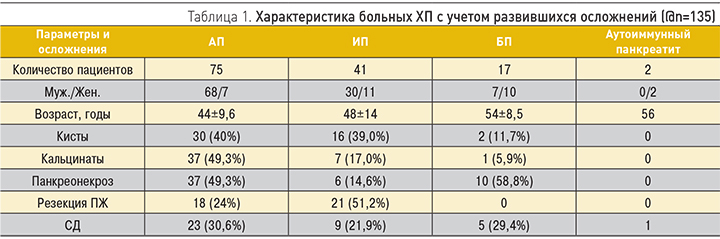
В результате обследования было выделено две группы: больные ХП и пациенты с другими заболеваниями ПЖ (рак и МЦА). Более половины составили больные АП (55,5%), вторым по распространенности был ИП (30,4%), на третьем месте по частоте выявления – БП (12,6%); также в эту группу вошли 2 женщины с аутоиммунным панкреатитом (1,5%; табл. 1).
В нашем исследовании выделено два варианта клинических проявлений ХП. Для первого варианта характерно внезапное начало в виде тяжелого приступа, нередко протекающего как острый панкреатит. Данный вариант с острым началом клинических проявлений имел место у 21% больных ХП. Эту группу преимущественно составляли больные АП. Минимальный период злоупотребления алкоголем, предшествовавший первому приступу панкреатита, составлял 2 года, максимальный – 40 лет.
Второй вариант начальных клинических проявлений, наблюдавшийся у 79% больных, характеризовался тупыми болями и чувством дискомфорта в подложечной области, диспепсическими проявлениями в течение нескольких месяцев или лет. Эту группу составляли преимущественно больные БП и ИП. С течением времени развитие фиброзных и склеротических изменений приводило к тому, что основными клиническими проявлениями становились признаки функциональной недостаточности ПЖ.
Для АП характерен первый тип течения. У таких больных за стадией ранних проявлений часто возникал острый приступ болей в верхней половине живота, нередко с развитием геморрагического или жирового некроза. Вслед за возникновением первого острого приступа болей в верхней половине живота заболевание вступало в стадию развернутой клинической картины, характерной особенностью которой являлись тяжелые рецидивы заболевания. Обострение протекало как острый панкреатит, чередуясь с периодами полной или неполной клинической ремиссии [8]. Продолжительность стадии рецидивов была различна и зависела от степени утраты функциональной ткани ПЖ как результата панкреонекроза или постепенного замещения воспаленной ткани фиброзом.
ХП является прогрессирующим длительно существующим заболеванием с повторяющимися обострениями хронического воспаления, развитием склероза и фиброза, что приводит к замещению секретирующего эпителия железы соединительной тканью и снижению внешнесекреторной функции ПЖ [9].
Если осложнения не развивались, то с годами у части больных приступы становились слабее, и наступал период относительной стабилизации с неяркими клиническими проявлениями. Такой вариант выявлен у 12% больных АП. Более характерная для АП клиническая картина с тяжелыми приступами в начале заболевания, формированием осложнений выявлена у 83,4% пациентов. Это типичный вариант течения АП. Только у 5 больных (4,6%) выявлено отсутствие рецидивов, что позволило отнести эти случаи к атипичному варианту течения ХП алкогольной этиологии.
Для АП характерна высокая частота осложнений [10–12]. Она выявлена более чем у половины пациентов с АП и более чем у трети больных идиопатическим ХП (табл. 1). СД формируется у этих больных независимо от этиологии заболевания. Стадия осложнений может наступить как уже после первого тяжелого приступа ХП, так и после серии рецидивов в течение нескольких лет. Типичными для АП являются такие осложнения, как псевдотуморозный панкреатит, кальциноз и кисты ПЖ (табл. 1).
Развитие осложнений меняет клиническую картину и требует разного подхода к лечению (консервативного или хирургического).
Необходимо отметить, что на стадии поздних осложнений наиболее выражены нарушения функций ПЖ, которые проявляются поносами, похуданием, СД. Последняя стадия ХП характеризуется декомпенсированной недостаточностью внешне- и внутрисекреторной функции ПЖ, когда к имеющейся клинической картине присоединяются, а затем выходят на первый план стеаторея и СД.
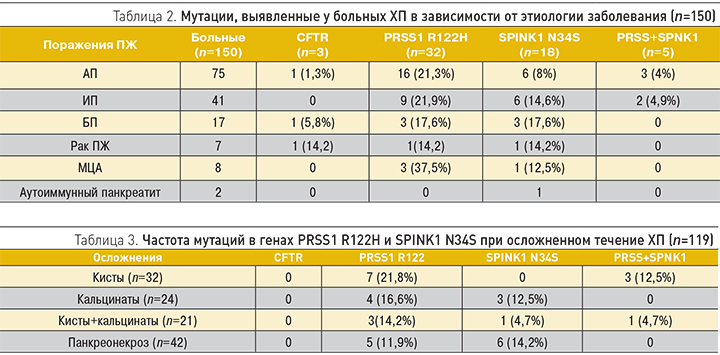
При анализе полученных данных (табл. 2) можно предположить, что наличие мутаций в генах PRSS1 и SPINK1 влияет на формирование АП и идиопатического панкреатита. При исследовании выявлена высокая встречаемость мутаций при МЦА. Данный факт требует дальнейших исследований. Из 7 больных с раком ПЖ мутации в генах были выявлены у 3 пациентов, однако это были мутации в разных генах.
Осложнения ХП различны по своему генезу, что обусловлено временем их появления. Кисты, псевдокисты, тромбоз селезеночной вены, экссудативный плеврит, асцит относятся к ранним осложнениям, а СД, кальциноз ПЖ, псевдотуморозный панкреатит – к поздним. Псевдокисты, как правило, результат некроза ПЖ при обострении панкреатита. Они могут появляться уже после первого тяжелого приступа.
Самая высокая частота осложнений встречалась, как было отмечено ранее, при АП. Причиной возникновения первого приступа ХП является не только злоупотребление алкоголем. Одной из частых причин является ЖКБ. У одного и того же больного часто встречаются несколько осложнений (табл. 3).
У 2 больных с мутациями в гене СFTR отмечалось неосложненное течение заболевания. Наиболее часто кисты формируются при мутации в гене PRSS1, а также при ее комбинации с мутацией в гене SPINK1 N34S.
Появление осложнений существенно отражалось на течении болезни, изменяло характер и степень выраженности клинических проявлений, что во многих случаях меняло тактику лечения больных.
Таким образом, изучение естественного течения ХП свидетельствует о том, что многочисленные клинические формы этого заболевания по существу являются стадиями развития, среди которых можно выделить следующие:
- 1 стадия – ранних клинических проявлений;
- 2 стадия – рецидивов;
- 3 стадия – осложнений;
- 4 стадия – декомпенсированной недостаточности функций ПЖ.
Однако течение ХП не всегда бывает типичным, и заболевание проходит не все стадии своего развития. Тяжесть и выраженность морфологических изменений, формирующихся при осложненном течении заболевания, обусловлена наличием мутаций в генах PRSS1 и SPINK1 и может привести к быстрому возникновению панкреатической недостаточности.


