Сахарный диабет (СД) – тяжелое прогрессирующее заболевание, имеющее глобальное мировое значение. По данным Международной федерации диабета (International diabetes federation, IDF) в 2015 г. были зафиксированы 415 млн случаев заболевания [1], т.е. практически каждый 11 взрослый человек на планете болен СД. Несмотря на достижения современной эндокринологии и фармацевтики, прослеживается устойчивая тенденция к дальнейшему распространению СД. Ежегодно число больных увеличивается как минимум на 9,52 млн. Если эта печальная закономерность сохранится, к 2040 г. СД будут страдать как минимум 642 млн человек в мире [1], т.е. практически каждый 10 житель планеты.
В России проблема СД стоит не менее остро, чем в остальных странах. Согласно данным, опубликованным в Государственном регистре СД, в РФ с 2010 г. по 2015 г. распространенность СД увеличилась на 23%, что в количественном выражении составило 930 тыс. новых пациентов [2]. В абсолютных значениях число больных в РФ к началу 2015 г. достигло 4,094 млн человек. Согласно зарегистрированной динамике роста распространенности СД каждый час в России фиксируется 15 новых больных СД.
Глубину проблемы СД в РФ продемонстрировало опубликованное в 2015 г. крупное российское исследование NATION, в рамках которого были проанализированы показатели уровня гликированного гемоглобина у 26 620 респондентов [3]. Согласно полученным результатам, 24,7% российской популяции имеет нарушения углеводного обмена: у 19,3% участников был выявлен предиабет, а у 5,4% – СД 2 типа. При этом у большинства респондентов обнаруженный в ходе скрининга СД был ранее не диагностирован (54% не диагностированных и 46% диагностированных пациентов с СД 2 типа). Исследование NATION подтвердило крайне высокую потребность больных СД в интенсивной сахароснижающей терапии: у 21% пациентов c CД уровень гликированного гемоглобина (HbA1c) колебался в пределах 7,5–9%, а 19% больных были глубоко декомпенсированы (HbA1c >9%). Особую озабоченность вызывает тот факт, что процент респондентов с HbA1c >9% оказался даже выше в группе ранее недиагностированных больных (21% по сравнению с 17% диагностированных участников).
СД характеризуется прогрессирующим течением и значительным количеством тяжелых осложнений. Так, это заболевание является ведущей причиной развития сердечно-сосудистых заболеваний, в т.ч. и кардиальных катастроф (25% инсультов развиваются на фоне СД или его сочетания с артериальной гипертензией), а также терминальной стадии почечной недостаточности, ампутации нижних конечностей, не связанных с травматизмом, слепоты у пациентов трудоспособного возраста [2, 4]. Во многих странах с высоким уровнем доходов СД является четвертой или пятой ведущей причиной смерти. Каждые 6 секунд в мире вследствие СД или его осложнений погибает 1 человек (5 млн зарегистрированных смертей в 2015 г.) [1]. Учитывая агрессивный характер распространенности СД и тяжесть его последствий, одной из ведущих задач современного здравоохранения является эффективная фармакотерапия заболевания с целью снижения риска развития отдаленных осложнений и улучшения качества жизни пациентов.
Ключевой задачей терапии СД по-прежнему считается эффективный контроль гликемии на протяжении суток, без резких колебаний содержания глюкозы в крови и с минимальным риском гипогликемических реакций, а также уменьшение инсулинорезистентности за счет снижения массы тела и фокусного воздействия на периферические инсулинчувствительные ткани-мишени. Согласно рекомендациям по терапии СД 2 типа ведущих международных профессиональных ассоциаций ADA, EASD, а также рекомендациям Российской ассоциации эндокринологов, пациентам, не достигшим целевого уровня HbA1c в течение 3 мес монотерапии метформином, показана интенсификация сахароснижающей терапии [5, 6]. Под ней подразумевается добавление к схеме лечения второго сахароснижающего препарата из группы производных сульфонилмочевины (ПСМ), тиазолидиндионов, ингибиторов дипептидилпептидазы-4 (иДПП4), агонистов рецепторов глюкагоноподобного пептида-1 (аГПП1), ингибиторов натрий-глюкозного котранспортера 2 типа (иSGLT2) или базального инсулина [6]. Подбор второго препарата осуществляется на основании его эффективности (снижения HbA1c), безопасности (количества гипогликемий на фоне приема), влияния на вес, наличия значимых побочных эффектов и стоимости терапии.
Принимая во внимание, что СД – заболевание со сложным, многофакторным механизмом развития, препараты для его лечения должны соответствовать целому ряду параметров. Несмотря на внушительный перечень требований к сахароснижающим препаратам, все современные противодиабетические средства во многом им отвечают, хотя группы, к которым они относятся, нередко существуют не одно десятилетие. Именно в таких традиционных классах выделены наиболее эффективные и безопасные представители, рекомендуемые для первоочередного назначения. Примером подобного лекарственного препарата является глимепирид – представитель группы ПСМ, используемых в эндокринологии уже более 50 лет. В качестве дополнительного требования для современных препаратов группы ПСМ выступает необходимость высокой селективности в преимущественном действии на калиевые каналы β-клеток при минимальном влиянии на калиевые каналы коронарных сосудов и других сосудистых бассейнов. При этом желательно, чтобы сахаро-снижающие препараты характеризовались доказанной сердечно-сосудистой безопасностью или даже проявляли дополнительные положительные эффекты, и прежде всего на сосудистую стенку, функцию эндотелия и реологические свойства крови, а также обладали антиатерогенными и антиоксидантными свойствами.
В существующих на данный момент группах сахароснижающих препаратов достаточно оптимальным соотношением приведенных выше факторов обладает группа ПСМ. Поэтому руководства ADA и EASD рекомендуют использовать ПСМ в сочетании с метформином для управления гликемическими параметрами у большой доли пациентов в качестве препаратов второй линии. Российские рекомендации предусматривают назначение комбинированных препаратов в качестве стартовой терапии метформина или препаратов групп иДПП-4, или аГПП-1, а при их непереносимости – ПСМ, за исключением глибенкламида [7]. При необходимости интенсификации терапии на втором этапе лечения ПСМ также могут применяться в комбинации с пероральными сахароснижающими препаратами (ПССП) различных фармакологических групп. Кроме того, согласно российским алгоритмам, ПСМ могут использоваться в комбинации с инсулином при поздней диагностике СД (HbA1c >9% в дебюте).
Таким образом, все рекомендации по лечению СД – и международные, и российские – оставляют место для ПСМ, в т.ч. и в комбинациях с ПССП разных групп. При этом за последние десятилетия было создано несколько поколений ПСМ, и ярким представителем последнего, третьего, поколения является глимепирид, обладающий выраженным сахароснижающим эффектом длительностью до 24 ч [8].
Эффект ПСМ основан на взаимодействии с регуляторными субъединицами АТФ-зависимых калиевых каналов (КАТФ). Глимепирид, в отличие от ПСМ второго поколения (например, того же глибенкламида), взаимодействующего с высокомолекулярной субъединицей SUR1, связывается с низкомолекулярной субъединицей SURx [8]. Примечательно, что и ассоциация, и диссоциация глимепирида происходит гораздо быстрее, чем у препаратов второго поколения. Это обеспечивает развитие сахароснижающего эффекта глимепирида при меньшем уровне инсулинемии, что снижает вероятность развития гипогликемий при длительном лечении, а также замедляет истощение запасов инсулина в β-клетках и снижает вероятность развития вторичной резистентности [8].
Кроме того, глимепирид является единственным ПСМ, который ни при каких условиях не блокирует митохондриальные КАТФ кардиомиоцитов, играющих основную роль в регулировании процесса адаптации клеток миокарда к ишемии, – так называемом прекондиционировании. Следует подчеркнуть, что ишемическое прекондиционирование [9] представляет собой феномен активации внутриклеточных механизмов адаптации к ишемии, возникающий при пережатии коронарной артерии на небольшой промежуток времени. Благодаря ему при повторном пережатии коронарной артерии ишемия без признаков нарушений может переноситься более продолжительный промежуток времени. Таким образом, ишемическое прекондиционирование – важнейший защитный механизм, снижающий тяжесть течения процессов ишемии в миокарде во время инфаркта или острого коронарного синдрома [10, 11].
Гипотеза о возможных различиях между ПСМ в отношении механизмов метаболической адаптации миокарда к ишемии получила название «гипотеза о влиянии на феномен ишемического прекондиционирования миокарда». Этот процесс, активизируемый при открытых КАТФ в мембранах миокардиоцитов, полностью подавляется глибенкламидом, блокирующим все виды КАТФ, и не нарушается глимепиридом, оставляющим открытыми КАТФ мембран миокардиальных митохондрий [12]. Различное воздействие ПСМ на процесс прекондиционирования было неоднократно подтверждено в клинических исследованиях [9, 13]. С этой точки зрения становится ясно, почему при сочетании метформина с глибенкламидом отмечается наибольшая смертность, а в сочетании с глимепиридом – наименьшая [14].
В ряде проведенных исследований выявлено нейтральное влияние глимепирида на такой важный показатель, как масса тела, а некоторые исследования демонстрируют даже незначительное снижение веса на фоне приема глимепирида [15–17]. С практической точки зрения главными достоинствами глимепирида являются его длительное действие, что позволяет принимать препарат 1 раз в день, и широкий спектр дозировок, обеспечивающий простую и точную титрацию дозы. Эти особенности препарата предоставляет лечащему врачу возможность максимальной индивидуализации сахароснижающей терапии.
Таким образом, глимепирид представляет собой ПСМ, который наиболее полно соответствует комплексу требований, предъявляемых к современным ПССП, и может применяться как в качестве монотерапии СД (например, при невозможности назначения метформина), так и стать незаменимым партнером для самых различных комбинаций в рамках двойной, тройной терапии и сочетания с инсулином. Идеология сочетания глимепирида как представителя препаратов группы ПСМ с традиционными и инновационными классами ПСП соответствует современной парадигме раннего и быстрого достижения гликемического контроля и позволяет осуществлять своевременную интенсификацию лечения. Роль глимепирида в комбинированной терапии заключается в достижении комплементарных и взаимно усиливающих свойств препаратов различных классов, усилении гипогликемизирующей эффективности без потери безопасности, максимальной коррекции различных патогенетических дефектов такого многофакторного заболевания, как СД 2 типа.
Национальные российские алгоритмы терапии СД, равно как и многочисленные международные рекомендации, нацеливают на применение наиболее рациональных комбинаций ПССП, в которых сочетаются представители разных классов, имеющие различные механизмы действия, изученные в рамках клинических исследований с предсказуемой эффективностью и безопасностью. Подбор наиболее подходящей индивидуально каждому пациенту комбинированной терапии представляется на сегодняшний день одним из самых сложных и не до конца решенных вопросов. Наиболее ярким примером рациональной, часто используемой комбинации может служить фиксированное или раздельное применение комбинации глимепирида с метформином и глимепирида с базальным инсулином или более инновационного и реже назначаемого сочетания глимепирида с иДПП-4 (вилдаглиптин, саксаглиптин, линаглиптин, ситаглиптин, алоглиптин), аГПП-1 (эксенатид, лираглутид, дулаглутид, ликсисенатид) и иSGLT-2 (эмпаглифлозин, дапаглифлозин, канаглифлозин). При этом тройные комбинации этих групп указанных препаратов также являются разрешенными и потенциально рациональными.
АНАЛИЗ ИССЛЕДОВАНИЙ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ГЛИМЕПИРИДА
Эффективность и безопасность применения глимепирида в различных комбинациях с сахароснижающими препаратами представляет большой интерес. Возможность оценить эти показатели предоставляется в рамках сравнительных мета-анализов сопоставимых долгосрочных исследований, изучающих результаты применения глимепирида. С этой целью мы проанализировали результаты поискового запроса «allintitle: glimepiride randomized controlled trial». Чтобы сосредоточить внимание на самых современных группах ПССП, из результатов исключили исследования, изучающие препараты группы тиазолидиндионов, а также все обзорные статьи, оставив только первичные публикации. Для поиска рандомизированных клинических исследований нами была использована поисковая система Google Scholar, позволяющая найти большинство онлайн версий рецензируемых научных журналов, книг, документов конференций, диссертаций, докладов и другой научной литературы и охватывающая около 80–90% всех статей, опубликованных на английском языке [18]. Кроме того, в мета-анализ не вошли исследования, в которых участвовали здоровые добровольцы и пожилые пациенты. Для анализа были отобраны только те исследования, целью которых была оценка эффективности коррекции углеводного обмена и снижение показателей гликемии. После этого в качестве дополнительного поиска был проведен анализ имеющейся доказательной базы в отношении конкретных представителей каждого из вышеперечисленных классов препаратов в отношении их сочетанного использования с глимепиридом, который либо добавлялся к уже существующей терапии, либо другие классы ПССП добавлялись к терапии глимепиридом. Целью настоящего обзора являлась оценка эффективности и безопасности применения глимепирида в различных комбинациях с ПССП у пациентов, не достигших целевых значений показателей углеводного обмена на фоне терапии СД 2 типа.
Если обратить внимание на литературные данные, в которых описывается возможность применения более новых классов сахароснижающих препаратов на фоне использования глимепирида, станет очевидным, что данная стратегия также имеет место в современной практике лечения пациентов с СД 2 типа. Доказательством признания глимепирида референсным препаратом может служить значительное количество исследований, в рамках которых применение этого препарата у пациентов с некомпенсированными показателями углеводного обмена не прекращается, а интенсифицируется при помощи препаратов других классов. В настоящий момент накоплена достаточная доказательная база, собранная на основании исследований, в которых изучалось назначение практически всех классов ПССП, в т.ч. иДПП-4, иSGLT-2, иГПП-1 и инсулина в сочетании с глимепиридом.
Мы отобрали исследования 2004–2016 гг., изучавшие опыт интенсификации сахароснижающей терапии у пациентов, принимающих ПСМ (глимепирид) или комплекс ПСМ и метформина. В качестве второго или третьего компонента сахароснижающей терапии в этих исследованиях применялись препараты группы иДПП-4 (линаглиптин [19], алоглиптин [20], ситаглиптин [21, 22], вилдаглиптин [23, 24]), аГПП-1 (дулаглутид [25], эксенатид [26], лираглутид [27]) и представитель нового класса ПССП иSGLT-2 – дапаглифлозин [28]. Согласно опубликованным данным [20], добавление к монотерапии ПСМ препарата группы иДПП-4 линаглиптина привело к снижению HbA1c на 0,54±0,07% (конечный показатель в среднем 8,06%). Однако показателя достижения уровня HbA1c<7% удалось достигнуть только 15,2% пациентов. Гипогликемии фиксировались редко — всего в 5,6% случаев. Опыт назначения на фоне монотерапии глимепиридом иДПП4 алоглиптина в дозах 12,5 и 25 мг продемонстрировал устойчивое снижение HbA1с, схожее в обеих группах пациентов, несмотря на разницу в дозировках иДПП-4 [20]. У пациентов, получавших 12,5 мг алоглиптина, HbA1c снизился на 0,59%, достигнув 7,95±0,59%, а 25 мг — на 0,65% (конечный HbA1c 7,89±0,65%). При этом среднее число пациентов, достигших уровня HbA1c <7%, оказалось выше в группе участников, получавших дозировку 12,5 мг (9,6% по сравнению с 7,7% в группе 25 мг). Закономерно, что в группе, получавшей большую дозу алоглиптина, почти в 2 раза чаще фиксировались гипогликемии (5,3% пациентов по сравнению с 2,7%), а также было зарегистрировано более негативное влияние на массу тела (0,56±1,225 кг и 0,27±1,105 кг в группах, получавших 25 и 12,5 мг алоглиптина соответственно).
В двух исследованиях, включенных в обзор, изучались особенности применения ситаглиптина в дозе 50 мг [19] и 100 мг [20] на фоне приема глимепирида и его комбинации с метформином [22]. Самой эффективной оказалась тройная комбинация иДПП-4, метформина и глимепирида: снижение HbA1c составило 0,59±0,15%, показатель достиг 7,68%. При этом дозировка ситаглиптина 50 мг также показала хорошие результаты: снижение HbA1c 0,6±0,6%, финальный уровень HbA1c составил 7,9%. При двойной терапии глимепиридом и ситаглиптином 100 мг удалось достичь снижения HbA1c на 0,3±0,18%, финальный показатель достиг 8,12%. Максимальное число пациентов, достигших HbA1c, оказалось в группе, получавшей глимепирид и 50 мг ситаглиптина (29%) [22]. Стоит отметить, что в данном исследовании тройная комбинация препаратов (глимепирид + метформин + иДПП-4) отличалась достаточно высоким риском гипогликемий (16,4% пациентов по сравнению с 7,5 и 5,6% в группах двойной терапии 100 и 50 мг ситаглиптина соответственно).
В обзор также вошли несколько исследований, в которых изучалась эффективность назначения комбинаций глимепирида с аГПП-1. В двух исследованиях в качестве аГПП-1 рассматривался дулаглутид. В первом, опубликованном F. Giorgino в 2015 г., исследовали эффективность и безопасность комбинации метформин + глимепирид + дулаглутид в дозировке 1,5 и 0,75 мг [25]. Лучшие показатели гликемии показал комплекс препаратов с более высокой дозировкой аГПП-1. В группах пациентов, пролеченных 1,5 и 0,75 мг дулаглутида, снижение HbA1c составило 1,08±0,06 и 0,76±0,06%, а доля пациентов, достигших HbA1c <7%, – 53,2 и 37,1% соответственно. На фоне высокой эффективности комбинация глимепирид + метформин + дулаглутид отличилась более высоким риском гипогликемий, независимо от дозировки аГПП-1 (55,3 и 54,4% в группах 1,5 и 0,75 мг соответственно). Кроме того, среди пациентов, получавших 1,5 мг аГПП-1, были зарегистрированы случаи тяжелых гипогликемий (0,73%), чего не было отмечено в других исследованиях.
В исследовании К. Dungan, опубликованном в 2016 г. [29], также изучался опыт применения глимепирида в комбинации с 1,5 мг дулаглутида, но, в отличии от предыдущей работы, в составе двухкомпонентной комбинации. В результате терапии среднее снижение HbA1c составило 1,4±0,8%, достигнув к концу исследования 7±1,4%. Более чем у половины пациентов уровень HbA1c составил <7% (55,3%). При этом частота зарегистрированных гипогликемий оказалась ниже, чем в исследовании F. Giorgino [25], но все-таки достаточно высокой – 20,9%.
Применение еще двух аГПП-1, эксенатида и лираглутида, на фоне терапии СМ в разные годы изучалось в исследованиях, опубликованных J. Buse [26] и M. Marre [27]. Снижение уровня HbA1c достигло 0,86±0,11% на фоне приема эксенатида и 1,1±0,2 и 1,1±0,25% – при назначении лираглутида в дозах 1,2 и 1,8 мг соответственно. Хорошие показатели были зарегистрированы и при анализе доли пациентов, достигших уровня HbA1c <7%: 34,2% при назначении эксенатида и 35 и 42% в группах лираглутида 1,2 и 1,8 мг соответственно. Применение эксенатида продемонстрировало достаточно значительное количество гипогликемий – 36%, в то время как на фоне использования лираглутида гипогликемические события фиксировались в 9,2 и 8,1% случаев в группах 1,2 и 1,6 мг соответственно.
В исследовании, опубликованном под первым авторством К. Strojek [28], изучался опыт добавления представителя нового класса иSGLT-2 дапаглифлозина в различных дозировках (2,5, 5 и 10 мг). В условиях добавления к монотерапии глимепиридом на протяжении 48 нед был продемонстрирован благоприятный профиль безопасности и эффективности этих комбинаций. В трех группах пациентов, схожих по индивидуальным показателям и исходному уровню HbA1c, после 48 нед терапии было зафиксировано снижение HbA1c, прямо пропорциональное дозе препарата: 0,41, 0,56 и 0,73% в группах 2,5, 5 и 10 мг соответственно. Та же закономерность прослеживалась в показателях доли пациентов, достигших показателя HbA1c <7%: 15,6, 28,2 и 30,5% соответственно. При этом количество гипогликемических событий отличалось незначительно: 9,7, 10,3 и 11,3% в группах 2,5, 5 и 10 мг соответственно.
По данным анализа приведенных выше исследований, ПСМ и глимепирид в частности проявляют выраженные сахароснижающие свойства в комбинации с препаратами различных фармакологических групп.
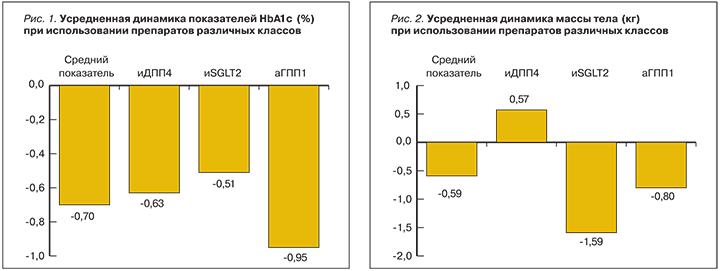
Во всех клинических исследованиях, которые вошли в данный анализ, стратегия интенсификации при помощи каких-либо новых препаратов была признана терапевтически эффективной. Средний показатель снижения уровня гликированного гемоглобина составил -0,70% (рис. 1).
Обзор зарубежных исследований 2004–2016 гг. показал, что максимального снижения HbA1c удалось достичь при назначении комбинации глимепирида и аГПП-1 (-0,95%). Интенсификация терапии ПССП за счет иДПП-4 и иSGLT-2 привела к снижению HbA1c на -0,63 и -0,51% соответственно.
При добавлении препаратов группы иДПП-4 к глимепириду уровень HbA1c наиболее выраженно снижался при назначении алоглиптина в дозе 25 мг [20], вилдаглиптина в дозе 100 мг [24] и ситаглиптина в дозе 50 мг [22]. Стоит отметить, что исследование эффективности ситаглиптина проводилось на пациентах азиатской этнической группы, у которых чаще применяют более низкие дозировки препаратов. В РФ разрешенная к применению доза ситаглиптина составляет 100 мг.
Среди комбинаций глимепирида с аГПП-1 наиболее эффективными оказались те, в которых использовались дулаглутид в дозе 1,5 мг (Dungan, 2016) и лираглутид в обеих дозах (1,2 и 1,8 мг).
Определенный интерес представляют данные, демонстрирующие динамику массы тела при добавлении препаратов различных групп к глимепириду. Назначение к ПСМ препаратов группы аГПП-1 и иSGLT-2 сопровождалось снижением массы тела, за исключением лираглутида в дозе 1,8 мг, прием которого сопровождался повышением веса на 0,3 кг. Введение в качестве второго (или третьего) компонента сахароснижающей терапии иДПП-4 приводило к незначительному повышению массы тела. Исключение составил вилдаглиптин в дозировке 50 мг (рис. 2).
Следует отметить ограничение нашего обзора – в нем проводится непрямое сравнение препаратов различных классов, из различных исследований, которые имели определенные различия по дизайну исследования, длительности наблюдения и в некоторых случаях проводились у разных этнических групп. Однако, принимая во внимание цель – оценить доказательную базу, в которой препараты различных классов могут комбинироваться с глимепиридом, мы считаем данное ограничение вполне приемлемым.
По данным анализа приведенных выше исследований, ПСМ и глимепирид в частности проявляют выраженные сахароснижающие свойства в комбинации с препаратами различных фармакологических групп. Несмотря на некоторые различия в эффективности и безопасности комбинаций ПССП, данные свидетельствуют, что глимепирид обладает универсальной совместимостью, т.е. может сочетаться с различными классами препаратов, в т.ч. и самыми современными, включая иSGLT-2. Использование глимепирида как препарата для базовой терапии СД в большом количестве исследований демонстрирует его признание как одного из основных ПССП в реальной клинической практике.
ЗАКЛЮЧЕНИЕ
Основой целью применения сахароснижающей терапии является профилактика возникновения микро- и макрососудистых осложнений, при этом снижение уровня глюкозы в крови – лишь механизм достижения этой цели. Эффективность и безопасность подобной стратегии для пациентов с СД 2 типа была впервые доказана для препаратов группы ПСМ в исследовании UKPDS [30], а затем подтверждена в исследовании ADVANCE [31]. Поэтому интенсификация сахароснижающей терапии за счет введения различных препаратов на фоне приема глимепирида или при помощи глимепирида (у пациентов, которые не компенсированы на терапии другими ПССП) сопровождается выраженным клиническим (сахароснижающим) эффектом и хорошим профилем безопасности, который проявляется низкой частотой гипогликемий и отсутствием или крайне незначительным увеличением массы тела. Именно в этой связи применение глимепирида в различных терапевтических режимах показано с целью коррекции гликемии, для улучшения исходов лечения у пациентов с СД 2 типа. Несмотря на то, что глимепирид довольно давно присутствует в практике лечения СД 2 типа, активное изучение возможности его применения в различных комбинациях позволяет широко использовать его в реальной практике в разно-образных клинических ситуациях. При этом препарат может использоваться как в составе монотерапии, так и в качестве компонента широко известной комбинации с метформином, а также в комбинациях с различными сахароснижающими препаратами, в т.ч. и новыми, и достигать отличных результатов.



